Диоксид сульфуру SO2 (оксид сульфуру (IV)) використовується як неводний розчинник при неорганічних синтезах. SO2 – перший газ, який був перетворений на рідину.
Молекула SO2 має кутову будову (ÐOSO = 1200; довжина зв’язку S – О дорівнює 1.43 нм.):

Це може бути наслідком sp2– гібридизації орбіталей сульфуру, оскільки кут між зв’язками О – S – О наближається до 1200. В молекулі SО2 зв’язок сульфуру з оксигеном кратний. Згідно МВЗ молекула SО2 являє собою резонансний гібрид[2]:
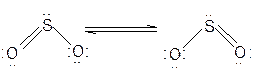
Кутова будова молекули SО2 обумовлює її полярність, і незначне екранування сульфуру оксигеном. Ці фактори, а також наявність в молекулі SО2 неподіленої пари електронів визначають хімічну активність SО2.
Незважаючи на велику розчинність SО2 у Н2О, концентровані розчини сульфітної кислоти отримати неможливо, через її нестійкість. Доказом нестійкості Н2SО3 є те, що з підвищенням температури розчинність SO2 в H2O зменшується.
Сульфітна кислота в розбавлених розчинах існує в двох ізомерних формах:

sp2-гібридний sp3-гібридний
атом сірки атом сірки
Сульфітна кислота слабка: Кдис= 10–11(К/дис= 1.3·10–2; К//дис=10–8). Солі сірчистої кислоти піддаються гідролізу:
SO32– + H2O «HSO3– + OH–
HSO3– + H2O «H2SO3 + OH–
Оскільки сірка в сірчистому газі проявляє проміжний ступінь окиснення (+4), тому очевидно, що SO2 може виступати як в якості відновника так і окисника:
J2 + SO2 + H2O 2HJ + H2SO4,
SO2 + H2S 3S + 2H2O
В лабораторії SO2 отримують при взаємодії Cu з H2SO4 або спалюванням сірки в кисні:
Сu + 2H2SO4 CuSO4 + 2H2O + SO2
S + O2 SO2
Інші способи добування двооксиду сірки:
¨ 2ZnS + 3O2 2ZnO + SO2
¨ Na2SO3 + H2SO4 Na2SO4 + H2O + SO2
¨ H2SO3 H2O + SO2
¨ C + 2H2SO4 CO2 + 2SO2 + 2H2O
¨ S + 2H2SO4 3SO2 + 2H2O
¨ 4FeS2 + 11O2 2Fe2O3 + 8SO2
¨ 4CaSO4 + 2C 4CaO + 4SO2 + 2CO2
¨ 2H2S + 3O2 2H2O + 2SO2
Оксиди селену і телуру можна отримати шляхом їх спалювання на повітрі або в атмосфері кисню.
Хімічні властивості оксидів елементів підгрупи сульфуру
¨ SO2 + 1/2O2 SO3
¨ PbO2 + SO2 PbSO4
¨ SO2 + H2O «H2SO3
¨ MГ5 + SO2 «МОГ3 +SOГ2, де М – перехідний метал
¨ SeO2 + 2H2S Se + 2H2O + 2S
¨ TeO2 + 2NaOH Na2TeO3 + H2O
¨ TeO2 + 4HCl TeCl4 + 2H2O
Сполуки S, Se, Te з оксигеном із ступенем окиснення +6
Ангідрид сульфатної кислоти (SO3, триоксид сірки, оксид сірки (VI)) має декілька кристалічних модифікацій. -SO3 – голчаті, азбестоподібні кристали.-SO3 утворюється, коли на -SO3 попадає волога. Можливо, це нескінченні спіралі зв’язаних один з одним тетраедрів SO4

- SO3 утворюється при конденсації парів мономерного SO3, що побудовані з тримерів SO3:

В газовій фазі SO3 мономерний, його молекули мають плоску трикутну структуру:

Добування оксидів (+6) елементів підгрупи сульфуру
¨ 2SO2 + O2 2SO3
¨ H2SO4 H2O + SO3 (катал. – P2O5)
¨ K2SeO4 + SO3 K2SO4 + SeO3
¨ H2SeO4 SeO3 + H2O (катал. – P4O10)
¨ H6TeO6 TeO3 + 3H2O (>3000C)
Хімічні властивості SO3
SO3 – гігроскопічний. Ві активно взаємодіє з водою:
SO3 + H2O H2SO4
При взаємодії SO3 з сульфатною кислотою утворюється піросульфатна кислота:
H2SO4 + SO3 H2S2O7
Піросульфати – солі піросульфатної кислоти – одержують піролізом гідросульфатів або дисульфатів:
2NaHSO4 Na2S2O7 + H2O
Властивості оксидів сульфуру різних ступенів окиснення
| Формула | Cтупінь окиснення | Властивості |
| SO2 | +1 | Газ |
| SO | +2 | Безколірний газ, стійкий до високих температур, але при низьких температурах розкладається: 3SO SO2 + S2O |
| S2O3 | +3 | Тверда, зеленувата речовина, =1.663 гсм-3 |
| SO2 | +4 | Безколірний газ |
| SO3 | +6 | Безколірна тверда речовина |
| S2O7 | +6 | Масляниста речовина; легко розкладається, Тпл = 273К |
| SO4 | +6 | Тверда біла речовина; дуже сильний окисник |
Добування оксидів сульфуру
¨ SOCl2 + Ag2S S2O + 2AgCl (100-2000C)
¨ SOCl2 + H2S S2O + 2HCl (200-3600C)
¨ S + SO2 2SO (при темп. тліючого розряду)
¨ 2S + O2 2SO
¨ S + SO3 S2O3
¨ 4SO2 + 3O2 2S2O7 (при темп. тліючого розряду)
¨ 2SO3 + O2 2SO4 (при темп. тліючого розряду)






