| Елемент і ст. ок. | Сполуки | Елемент і ст. ок. | Сполуки | |||||
| S–2 | H2S, S2–, Sn2– | Se–2 | H2Se | |||||
| S–1 | H2S2 | Se0-1 | Кластерні катіони, наприклад Se42+ | |||||
| S0 | S6, S8 | Se+1 | Se2Cl2 | |||||
| S+1 | S2O, S2F2,, S2Cl2 | Se+2 | ? | |||||
| S+2 | SF2, SCl2 | Se+4 | SeO2, H2SeO3, SeO32–, SeOF2, | |||||
| S+3 | Na2S2O4 | SeOBr2, SeCl4, | ||||||
| S+4 | SO2, SO32–, SF4, SOCl2 | SeBr4, SeBr62–, SeOCl2 | ||||||
| S+5 | Na2S2O6 | Se+6 | SeO3, H2SeO4, SeO42–, SeO2F2, | |||||
| S +6 | SO3, H2SO4, HSO3F | SeF6 | ||||||
Властивості сполук елементів підгрупи сульфуру складу Н2Е змінюються в групі монотонно, а властивості сполук з оксигеном, навпаки, проявляють вторинну періодичність.
Звичайна модифікація твердої сірки у вузлах кристалічної структури містить молекули S8, будова яких нагадує правильну геометричну фігуру 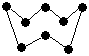 . Вона утворює дві кристалічні модифікації, які існують при кімнатній температурі. Це ромбічна і моноклінна сірка. Інакше їх називають - і -формою відповідно. Точка переходу ромбічної сірки в моноклінічну лежить при 950С. Хоч - і -форми мають однаковий молекулярний склад S8, вони в процесі кристалізації утворюють дещо відмінні кристалічні структури. Це яскравий приклад поліморфізму.
. Вона утворює дві кристалічні модифікації, які існують при кімнатній температурі. Це ромбічна і моноклінна сірка. Інакше їх називають - і -формою відповідно. Точка переходу ромбічної сірки в моноклінічну лежить при 950С. Хоч - і -форми мають однаковий молекулярний склад S8, вони в процесі кристалізації утворюють дещо відмінні кристалічні структури. Це яскравий приклад поліморфізму.
Температура плавлення призматичної сірки рівна 119.30С. Якщо повільно нагрівати сірку, то вона з ромбічної переходить в призматичну і повільно плавиться при температурі 119.30С. При швидкому нагріванні сірки спостерігається процес розплавлення ромбічної сірки.
Зміни, що проходять при нагріванні сірки

Молекули S8 при звичайних умовах мають кільцеву структуру. Всередині молекули S8 атоми сірки зв’язані один з одним зигзагоподібними розміщеними ковалентними одинарними зв’язками. Кільцеві молекули S8 при підвищеній температурі розриваються перетворюючись в ланцюжки S8. Атоми сусідніх ланцюгоподібних молекул S8 взаємодіють один з одним значно сильніше, ніж атоми сусідніх кільцеподібних молекул S8.
Якщо в пароподібній сірці при температурі її кипіння (444.60С) переважають лінійні молекули S8 (крім того присутні молекули S6, S4 і дуже мало S2), то при 6000С переважає форма S6, а при 9000С – S2. Газоподібна сірка при 20000С складається виключно із атомів.
При повільному охолодженні сірки протікають всі ті перетворення (в зворотному порядку), які спостерігалися при її нагріванні.
Крім двох вищезгаданих модифікацій сірки відома аморфна сірка, що виділяється, як правило, з розчинів, в яких протікають хімічні перетворення сульфурвмісних сполук. Наприклад, аморфна сірка утворюється при дії на розчин натрій тіосульфату сульфатної кислоти:
Na2S2O3 + 2H2SO4 [H2S2O3] + 2NaHSO4
[H2S2O3] S + SO2 + H2O
S2O32– + 6H+ + 4e 2S + 3H2O
S2O32– + H2O – 4e 2SO2 + 2H+
2 S2O32– + 4H+ 2S + 2SO2 + 2H2O
Встановлено, що аморфна сірка складається з молекул S6 і S8.
Хімічні властивості сульфуру, селену і телуру
üЕлементи підгрупи сульфуру, взаємодіють із різними металами:
Cu + S CuS + Q
S + Fe FeS
ü Елементи групи активно взаємодіють з неметалами. Внаслідок пропускання парів сірки над вуглецем утворюється сірковуглець:
S + C CS2
S + 6F SF6
ü Реакція сірки з фтором проходить бурхливо з утворенням SF6, який використовується як газоподібний діелектрик і джерело атомарного фтору.
ü Сірка хімічно активніша, ніж селен.
S + O2 SO2 + Q
Se + O2 SeO2 + Q






