4.1.1. Источники оптического излучения
Наиболее мощным источником электромагнитного излучения, обуславли-вающего жизнь на Земле, является Солнце. Поток солнечной радиации, приходящийся на 1 м2 площади границы земной атмосферы, составляет 1350 Вт и называется солнечной постоянной. В июле в Москве при наивысшем стоянии Солнца поток солнечной радиации на 1 м2 составляет 930 Вт/м2.
Дозированную солнечную радиацию используют как солнцелечение (гелиотерапия), а также как средство закаливания организма.
Долевое распределение солнечного излучения таково: 9% — УФ, 50% — ИК, 41% — видимое излучение. УФ короче 290 нм поглощается в основном озоновым слоем, преобладающая часть ИК — водяным паром. Максимум энергии излучения Солнца приходится в вакууме на 470 нм, на Земле, с учетом поглощения в атмосфере — на 555 нм.
В качестве искусственных источников теплового излучения используются лампы накаливания (даже у обычных осветительных ламп 90% энергии, подводимой от источника питания, преобразуется в тепловую энергию и только 10% — в световой поток), а также ИК излучатели, снабженные специальными фильтрами, задерживающими видимое излучение. Наряду с тепловыми источниками ИКИ используются лазеры и ртутные лампы высокого давления, имеющие в спектре ряд характерных линий, существенно отличающих спектр испускания от теплового. Использование электрического разряда в газах и парах металлов позволяет получить интенсивные источники УФ излучения вплоть до вакуумного ультрафиолета (УФ-С). В частности, получили широкое распространение эритемные люминесцентные лампы (ЭУВ) с излучением в диапазоне от 280 до 400 нм, и загарные люминесцентные лампы (ЗУВ), излучающие в диапазоне от 300 до 450 нм. Как правило, в УФ лампах используется плавленый кварц типа КУ, поскольку обычное оптическое стекло сильно ослабляет ультрафиолетовое излучение, особенно с длинами волн короче 280 нм. Между тем именно вакуумный ультрафиолет в диапазоне 240...260 нм обладает наиболее выраженным бактерицидным действием, поэтому ксеноновые и криптоновые лампы высокого давления, применяемые для обеззараживания помещений, изготавливаются из плавленого кварца. Кварц, кроме всего прочего, имеет исчезающе малый коэффициент температурного расширения, поэтому бактерицидные лампы высокого давления, работающие в жестких температурных условиях, просто не имеет смысла делать из обычного стекла еще и по этой причине. Для оценочного сравнения можно привести красноречивый пример: посуда из стекла с большой вероятностью растрескивается при наливании в нее крутого кипятка, т.е. держит тепловой удар в лучшем случае не более 100о С. Кварцевый же образец допускает разогрев газовой горелкой докрасна (это примерно 800о С), а затем не растрескивается даже при бросании в жидкий азот, т.е. выдерживает тепловой удар не менее 1000о С.
На сегодня имеется обширный опыт получения УФ излучения от самых различных источников (например, электрическая дуга в воздухе, применявшаяся для освещения еще задолго до появления ламп накаливания и испортившая зрение многим тысячам людей, а сегодня составляющая неотъемлемую часть сварочных технологий), однако наиболее эффективными в плане изучения фотохимических превращений источниками являются, безусловно, УФ-лазеры.
4.1.2. Искусственный загар
В последнее время (конец ХХ - начало ХХI века) большую популярность приобрели солярии, т.е. искусственные источники УФ излучения (ЭУВ и ЗУВ), вызывающие загар без пребывания под солнечным излучением. Появление соляриев стало формировать собственные группы поклонников. Дефицит свободного времени, особенно выраженный среди молодежи, не позволяет порой даже летом отправиться на речку, чтобы понежиться на солнышке. Приходится все время просиживать в офисе, куда никогда не доходит полноценный дневной свет. Поэтому чуть ли не единственным вариантом становится поход в солярий. Побыть немного под ультрафиолетовыми лучами, не выбираясь на пляж, можно в любое время, даже когда солнце уже давно скрылось. Более того, солярии активно помогают и зимой. Солярии стали превосходной альтернативой обычному солнцу.
Как только армия «солярных поклонников» во всем мире достигла многомиллионной численности, стали высказываться медики. Особенно активно заговорили онкологи. Известно, что людям пожилого возраста и склонным к опухолевым заболеваниям врачи не рекомендуют отдыхать в условиях повышенной против привычной нормы солнечной радиации, поскольку даже естественный источник УФ излучения может служить провокатором злокачественных новообразований. На этот счет у фототерапевтов существует даже определенная гипотеза о том, что каждому человеку определена индивидуальная предельная доза ультрафиолета, подобно тому, как накапливается полученная доза ИИ. Особенно это относится к диапазону 240...260 нм, куда попадают полосы поглощения ДНК (см. §3.2.1). Тем более это относится к «искусственному солнцу», которое работает в узком диапазоне спектра с целью вызвать загар меньшими дозами облучения, чем естественное. В результате кожа, воспринявшая своеобразный «лучевой удар», становится зоной мутагенности, провоцирующей раковые опухоли, причем не обязательно наружного характера (воздействие является системным, т.е. отражается на состоянии всего организма).
В доказательство своей теории исследователи стали призывать статистику, а она показала несомненное увеличение вероятности раковых заболеваний у любителей искусственного загара. Немецкий профессор Томас Шварц из Клиники заболеваний кожи (г. Мюнстер) утверждает, что искусственное солнце нарушает нормальную жизнедеятельность клеток кожи, и именно поэтому в Германии резко возросла заболеваемость раком — ежегодно там регистрируют до 8 тысяч случаев. Специалисты Американского института по исследованию рака (г. Нью-Йорк) опубликовали новейшие данные, согласно которым люди, принимающие солнечные ванны в солярии, в полтора-два раза чаще страдают от рака кожи и воспаления меланом. Американцы утверждают (а в США солярии наиболее распространены), что любая, даже самая минимальная доза искусственного ультрафиолета грозит спровоцировать необратимые дерматологические процессы. Особенно тревожно то, что от солярия страдает главным образом молодежь: наибольшую опасность искусственный загар представляет для людей, не достигших 20 лет (для них опасность заболеть возрастает в 1,8-3,6 раза).
По данным экспертов, ежегодно в мире регистрируется более 132 тысяч случаев злокачественной меланомы и около 66 тысяч смертей от этой или других форм рака кожи. Эти цифры продолжают расти: в Норвегии и Швеции уровень ежегодной заболеваемости меланомой за последние 45 лет вырос более чем в три раза. В Соединенных Штатах за прошедшие 30 лет количество злокачественных заболеваний кожи увеличилось в два раза, достигнув 1,1 миллиона случаев в год. Наивысший уровень отмечен в странах, население которых имеет светлую кожу. Наибольшее распространение патология получила в Австралии, Новой Зеландии, Северной Америке и североевропейских странах.
В России солярии распространены меньше, чем на Западе, но ситуация в мегаполисах практически аналогична зарубежной. Например, запрос в системе «Яндекс» по названию «солярии Москвы» выдает около 3 млн. (!!) ссылок, в основном, рекламного характера. В Москве сегодня функционирует более 2,5 тысячи салонов красоты и парикмахерских, и во многих из них функционируют солярии как сопутствующий вид услуг. При этом никакого контроля за их деятельностью не ведется.
После ознакомления с вышеупомянутой зарубежной статистикой Мосгордума решила обратить пристальное внимание на городские солярии. Роспотребнадзор провел проверку и выяснил, что в трети подобных заведений отсутствуют приборы контроля мощностных и спектральных характеристик облучателей, в одной пятой никак не контролируется срок годности люминесцентных ламп (а при выработке гарантийного ресурса спектральные характеристики излучателей меняются в неблагоприятную сторону). Более того, в половине соляриев не соблюдаются элементарные санитарные нормы. Как правило, посетителей не предупреждают о противопоказаниях и опасности искусственного солнца для здоровья.
Главный дерматолог г. Москвы Ю. Перламутров (2005 г.) заметил, что в структурных подразделениях медицинских учреждений соляриев нет. Они относятся к отделению физиотерапии, где применяются для лечения заболеваний органов дыхания, опорно-двигательного аппарата и др. по назначению и под контролем врача. В соляриях разного рода салонов не существует медицинского контроля, и, кроме того, там зачастую используются лампы, отслужившие свой срок, что еще больше способствует развитию онкологических заболеваний.
Несмотря на все исследовательские доводы, солярии — полезный вид услуг, ведь это не просто красивая кожа. Это еще и пополнение своего организма витамином D, даже если и делается это при помощи искусственного солнца. Но, чтобы хоть как-то отдалить себя от «ультрафиолетовой онкологии», необходимо неукоснительно соблюдать правила безопасной эксплуатации установок.
Во-первых, каждый солярий должен быть оснащен необходимым набором измерительной аппаратуры для строгого контроля спектрального состава излучения и его энергетических характеристик. Во-вторых, каждый пациент солярия должен проходить предварительное исследование с набором тестов на чувствительность организма к воздействию УФ излучения, которые должны учитывать состояние кожных покровов, периферического кровообращения, вегетативной нервной системы, основных желез внутренней секреции и т.п. Этот набор тестов должен установить главную характеристику: дозу облучения, которая в принципе определяется индивидуально. Обращаясь к зарубежному опыту (во всяком случае, для наиболее современных соляриев), следует каждого посетителя снабдить индивидуальным чипом, куда занесены все необходимые результаты указанного выше обследования, и без вставленного в аппарат чипа сеанс облучения не может быть проведен.
На сегодня подобное оснащение московских соляриев отсутствует. В лучшем случае выдаются обобщенные рекомендации, не ориентированные на индивидуальные особенности пациента. Именно:
— между кожей и люминесцентными трубками должно быть расстояние не меньше 15- 20 см;
— первый сеанс должен продолжаться не более 5 минут, а последующие — не более 15 минут не чаще двух раз в неделю;
— под воздействием УФ-излучения кожа сильно обезвоживается, поэтому после сеанса не следует мыться с мылом, лучше принять душ с нейтральным гелем для чувствительной кожи;
—перед облучением следует нанести на кожу слой легкого увлажняющего крема или лосьона, желательно с витамином Е.
Перечисленные рекомендации могут быть расценены как «лучше, чем ничего», но ни в коем случае не могут рассматриваться как по-настоящему научно обоснованные. К сожалению, ситуация в фототерапии в целом мало отличается от «искусственных солнц». Типовые облучатели «искусственного солнца» показаны на рис. 4.1, 4.2.
4.2. Некоторые диагностические применения лазеров в биологии и медицине. Флуоресцентная диагностика
Задача диагностики — возможно более достоверное извлечение информации о состоянии организма и патологических изменениях в нем. С этой точки зрения любое «воздействие» извне нежелательно, поскольку оно так или иначе искажает истинную картину происходящих в организме процессов. Однако без воздействия нет и отклика организма, который является единственным источником необходимой информации.
 |  | ||
Для диагностических применений низкоинтенсивные воздействия, не вызывающие необратимых изменений в организме, имеют куда более широкую область применения, чем высокоинтенсивные, после которых биоткань либо перестает существовать вообще как организованная структура, либо погибает как биоткань. Однако вообще исключать возможность диагностического при-менения высокоинтенсивного лазерного излучения нецелесообразно, поскольку имеется ряд примеров весьма эффективной диагностики заболеваний по анали-зу продуктов разрушения биоткани высокоинтенсивным излучением, по само-му характеру изменения биоткани в процессе облучения и т.п. Поэтому диагно-стическое применение лазеров всегда должно быть привязано к конкретной диагностической задаче и, в сущности, не поддается общей классификации.
В любом случае при диагностическом воздействии следует соблюдать ус-ловие малости энергии взаимодействия по сравнению с запасенной в объекте энергией и возможно более высокой локальности. Трудность соблюдения этих условий на практике, по-видимому, является основной причиной того, что диаг-ностические применения лазеров до сих пор составляют ничтожно малую долю от всех применений лазеров в медицине, хотя богатейшие возможности лазер-ной диагностики с самого начала не вызывали и сейчас не вызывают сомнений.
Существуют десятки различных методов определения физиологических параметров клетки и организма, основанные на флуоресцентном анализе. Они делятся на разрушающие и неразрушающие методы диагностики в биомедицине с помощью лазеров.
В основе применения лазерных методов диагностики в медицине лежит тот факт, что все органические макромолекулы (белки, НК, полисахариды), все форменные элементы крови, большинство жирных и аминокислот, нуклеотидов и другие биохимические компоненты клеточных и внутриядерных субстратов обладают характерными спектрами оптического поглощения, отражения, рассеяния и люминесценции. Эти спектры различны для окисленного и восстановленного состояния молекулярных компонентов, а соотношение различных форм этих компонентов и их объемная концентрация в исследуемой области определяется общей функциональной активностью различных клеточных структур и органов, в том числе в немалой степени и клеток крови. Это отражается на общих оптических свойствах тканей, которые могут быть зареги-стрированы методами лазерного спектрального анализа, лазерной доплеровской флуометрии, фотоплетизмографии, лазерной биоспектрофотометрии и др.
Лазерные методы не требуют расходных лабораторных препаратов, неинвазивны и асептичны, являются существенно более дешёвыми по сравнению с рентгеновскими и томографическими исследованиями и позволяют получать результат практически в реальном масштабе времени.
Одним из первых эффективных применений лазеров в биомедицине была пролетная цитометрия, когда лазер был применен для ускорения анализов и сепарации отдельных клеток млекопитающих за счет точных измерений их оптических свойств — характеристик вызванной лазером флуоресценции. При этом использовались аргоновые и He-Cd лазеры (последний работает в фиолетовом диапазоне на длине волны 441 нм, а аргоновый лазер излучает более 10 линий, охватывающих диапазон от ближнего УФ (370 нм) до зеленого (514, 5 нм)).
В конце 80-х годов минувшего века в университете Твенте (Голландия) был развит многопараметрический подход к лазерной пролетной цитометрии, основанный на светорассеянии, иногда в сочетании с микрофлуоресценцией. При таком подходе одновременно измеряется ряд сигналов от отдельной клетки, например, интенсивности рассеяния вперед и под 90° (ортогональное рассеяние), полная интенсивность ортогонального рассеяния, поляризованного параллельно поляризации падающего на образец лазерного излучения и параллельно току клеток (I ||),и его компонента, поляризованного в плоскости, перпендикулярной плоскости поляризации падающего излучения и направлению пролета клеток (деполяризованного компонента I ^), и другие комбинации сигналов.
Такой подход позволяет довольно эффективно дифференцировать клетки крови по их морфологии. Информация о типе клеток определяется соотношением интенсивности ортогонального рассеяния и его деполяризованного компонента. Наибольшее значение коэффициента деполяризации  имеют эозинофилы (0,044). Это объясняется большим количеством малых внутриклеточных частиц (гранул), которые дают многократное рассеяние, вследствие чего происходит деполяризация света.
имеют эозинофилы (0,044). Это объясняется большим количеством малых внутриклеточных частиц (гранул), которые дают многократное рассеяние, вследствие чего происходит деполяризация света.
Двухпараметрические карты интенсивности ортогонального рассеяния и рассеяния вперед показывают с хорошим разрешением области рассеяния гранулоцитами (нейтрофилы), моноцитами, лимфоцитами и эритроцитами с остатками клеток (рис. 4.3).

В университете Твенте был построен пролётный цитометр на базе He-Ne лазера мощностью 5 мВт с одновременной регистрацией четырех компонент рассеяния для дифференциального счета четырех типов белых клеток крови. Он дает достаточно хорошую корреляцию с обычными измерениями: 0,99 для лимфоцитов, 0,76 для моноцитов, 0,99 для нейтрофилов и 0,98 для эозинофилов. Может использоваться для экспресс-диагностики различных видов лейкемии.
Другое, не менее эффективное, применение лазеров — лазерная анемометрия: измерение малых скоростей движения биологических жидкостей на основе доплеровского сдвига частоты излучения лазера.
К неразрушающим методам микроспектрального анализа биообъектов относится микрофлуориметрия отдельных живых клеток или органелл. Пространственное разрешение метода 0,3 мкм, временное – 0,2 нс. Он может быть полезен при флуоресцентном картировании генов, пространственного распределения флуорофоров в клетках, мембранах, для количественного аминокислотного анализа, определения концентрации свободных ионов кальция Ca2+ внутри живых клеток, идентификации и изучении свойств пигментов и красителей внутри живой клетки. Например, при изучении фотоповедения одноклеточных водорослей этим методом была выявлена органелла, исполняющая роль фоторецептора, и молекула фотопигмента.
Инструментальная база флуоресцентной микроскопии содержит лазер, ФЭУ[1] в режиме счета фотонов, видеодетекторы, работающие при очень низких уровнях интенсивности флуоресценции.
Микроспектрофлуориметр можно использовать для исследования загрязнения окружающей среды, в токсикологии, иммунологии, онкологии, криминалистике, геологии и др. Чувствительность метода весьма высока: он даёт информацию о присутствии того или иного вещества в образце в концентрациях порядка 10-8 моль/ол (соответствующий показатель для спектрального анализа – порядка 10-6 моль/л).
В медицине люминесценция используется для диагностики важнейших физиологических процессов, для контроля над поступлением, превращением и выводом из организма лекарств, для диагностики большого числа заболеваний и т. д.
Флуоресценция может использоваться и при диагностике опухолевых заболеваний. При этом используется свойство некоторых красителей избирательно накапливаться в опухолевых клетках. Для диагностики используют фотосенсибилизатор с высоким уровнем интенсивности флуоресценции.
Флуоресцентный анализ также позволяет исследовать механизм избирательного накопления тестового красителя в раковых клетках. При этом характер флуоресценции красителя (спектры, время и характер затухания) сильно зависят от его непосредственного окружения, агрегации и способности образовывать комплексы с другими структурами.
Другим способом различия здоровых и опухолевых тканей является наблюдение существенного сдвига спектров флуоресценции тканей в синюю область по сравнению со здоровыми.
Исследование спектров собственной люминесценции живых тканей в видимой области представляет особый интерес. Во-первых, это связано с возможностью прямого визуального наблюдения свечения с выявлением его цветовых оттенков, во-вторых, спектры люминесценции в видимой области содержат ценную информацию о жизненно важных процессах транспорта веществ через кровь (красное свечение порфиринов, входящих в состав цитохромов, гемоглобина, миоглобина и др.), клеточного метаболизма (сине-голубое свечение восстановленной формы никотинамидадениндинуклеотидов — НАД·Н и НАДФ·Н и желтое — окисленных форм флавопротеинов (ФП)). Каждый из этих видов люминесценции заслуживает специального рассмотрения, поскольку отражает состояние жизненно важных процессов на клеточном уровне. Флуориметрический анализ отношения интенсивностей свечения в сине-голубой (455...460 нм) и желто-зеленой (530...550 нм) исключительно информативен в части исследования клеточного дыхания. Важным преимуществом этого метода исследования является возможность его проведения в любом из органов, к которым можно подвести свет, возбуждающий люминесценцию, и отвести свечение in situ на регистрирующий прибор. Это можно делать эндоскопически, пункционно, с помощью специального оптического катетера и т.п.
Для лазерной диагностики по спектрам поглощения или флуоресценции часто используют в качестве реперных так называемые изобестические точки, т.е. длины волн, на которых интенсивность поглощения или флуоресценции молекулы при переходе из одной формы её существования в другую не меняется. Изобестические точки в спектрах имеет также ряд флуоресцентных зондов. Например, на длинах волн 430, 586 и 805 нм поглощение света оксигемоглобином и восстановленным гемоглобином крови практически одинаково. Проводя измерения на промежуточных длинах волн в сочетании с измерениями на двух изобестических точках, можно определить процент оксигенированной крови.
Методы отражательной и флуоресцентной спектроскопии, а также их комбинации успешно применяются для исследования кожи in situ. Они позволяют определять индексы эритемы и пигментации кожи, концентрацию гемоглобина содержащейся в коже крови и степени её оксигенации, оценивать изменения цвета кожи, проводить диагностику состояния кожного покрова в процессе лечения, изучать биофизику кожи, проводить исследования эффективности применения фотозащитных препаратов.
4.3. Фото- и лазеротерапия. Лазерная хирургия
4.3.1. Однофотонные фотобиохимические процессы. Многофотонное возбуждение. Лазерная терапия
В основе лазерной терапии лежит управление биохимическими процес-сами с помощью света, который возбуждает биомолекулы. Возбужденная моле-кула либо сама принимает участие в химической реакции, либо передает своё возбуждение другой молекуле, участвующей в химических превращениях. Различают однофотонное возбуждение (малые интенсивности света — линей-ная фотобиология) и многофотонное (большие интенсивности — нелинейная фотобиология), когда молекула может поглощать больше одного фотона. Однофотонные и многофотонные переходы подчиняются разным правилам отбора, поэтому они дают дополнительную по отношению друг к другу спектроскопическую информацию. При двухфотонном поглощении два фотона поглощаются одновременно, что приводит к возбуждению одной молекулы и переходу её на верхние энергетические уровни:
 .
.
Поскольку это нелинейный процесс, сечение поглощения для него на много порядков меньше сечения однофотонного поглощения.
Двухфотонное поглощение может использоваться для зондирования возбуждённых состояний, недостижимых при однофотонном возбуждении. В молекулах, обладающих центром симметрии, электронные состояния можно разделить на чётные (g) и нечётные (u). Однофотонные переходы из g в g или из u в u запрещены, однако, двухфотонные переходы между этими состояниями разрешены.
При наличии мощных лазерных источников можно с большой вероятностью индуцировать многофотонные переходы, которые сравнительно легко регистрируемы. Таким образом, при использовании спектроскопии многофотонного поглощения можно изучать набор новых электронных колебательных и вращательных состояний и переходы между ними, которые нельзя наблюдать при однофотонном поглощении.
Однофотонные фотобиохимические процессы лежат в основе фототерапии или фотохимиотерапии желтухи новорожденных (избыточная билирубинемия), различных заболеваний кожи и рака.
Билирубин (БР) не является фотосенсибилизатором. Он очень фотолабилен, но продукты его фотолиза не вызывают заметных негативных эффектов. Содержание билирубина в крови новорождённых много выше, чем в крови взрослых (20 мг%[2] по сравнению с 1 мг%), т. к. печень младенцев не обеспечивает устранение билирубина из крови. При желтухе гемоглобин деградирует в билирубин, что приводит к поражению нервной системы. Билирубин разрушается при облучении синим светом 400...500 нм, что является основой фототерапии желтухи в роддомах.
Основными равновероятными механизмами разрушения билирубина являются:
1) фотодинамическое окисление с образованием 1O2: 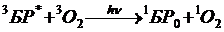 , далее окисление и вывод из организма;
, далее окисление и вывод из организма;
2) фотоизомеризация БР под действием света, далее вывод из организма.
Однофотонные процессы возможны при сравнительно низких интенсивностях света (порядка 1÷100 мВт/см2), которые можно получить от некогерентных источников излучения. Однако использование лазеров дает ряд преимуществ: высокая спектральная интенсивность, пространственная когерентность, малая расходимость (узконаправленный пучок) обеспечивают возможность селективного воздействия и эффективной доставки излучения к труднодоступным тканям с помощью оптических волноводов. В итоге эффективность фототерапии существенно повышается.
Лазерная терапия применяется в дерматологии, ортопедии (в том числе при несрастающихся переломах костей), в невропатологии при лечении пери-ферической и центральной нервной системы. При этом применяют лазерную рефлексотерапию (лазеропунктуру), облучая биологически активные точки, рекомендуемые для воздействия при соответствующем заболевании в классической рефлексотерапии, гинекологии, стоматологии и т.п.
Рассмотрим в качестве примера лечение псориаза. При лечении используют экзогенный фотосенсибилизатор псорален дозой 0,6 мг/кг массы больного и спектром биодействия 320...390 нм. В зависимости от специфики патологии псорален назначается как в виде инъекций, так и неинвазивно (мази, таблеток, ванн). В качестве источников излучения применяются как газонаполненные (ртутные и ксеноновые) лампы так и УФ-лазеры (эксимерные, газовые или твердотельные на высших гармониках). Механизм действия псоралена сводится к трём пунктам:
1) димеризация ДНК и РНК,
2) фотодиссоциация,
3) образование свободных радикалов.
Для лечения трофических и долго не заживающих ран и язв применяют низкоинтенсивное лазерное облучение в видимом и ближнем ИК диапазонах. Механизмы терапевтического действия низкоинтенсивного лазерного излучения изучены недостаточно, несмотря на большой (более 40 лет) накопленный опыт применения этого вида фототерапии. Часто в литературе лечебный эффект лазерного излучения связывается с его высокой степенью когерентности или поляризованности. Однако ряд наблюдений (в частности, наличие лечебного эффекта при использовании некогерентных источников) показывает, что непосредственного влияния на механизмы отклика организма когерентность и поляризация не производят. Как местный, так и системный (безусловно, присутствующий, что доказано многолетним практическим применением) лечебный эффект низкоинтенсивного излучения на длинах волн He-Ne (l=632,8 нм), He-Cd (l=441,6 нм), Ga-As (l=844-890 нм) лазеров, по-видимому, связан с регуляторным действием света этих длин волн на пролиферативную активность клетки (скорость прохождения клеточного цикла), когда свет выступает в роли регулятора клеточного метаболизма. Фотоакцепторами низкоинтенсивного монохромного лазерного излучения в клетке являются эндогенные (внутренние) сенсибилизаторы. В качестве таковых рассматриваются связанные молекулярные газы (кислород, оксиды азота и т.п.). Процесс передачи энергии возбуждения через фотоакцепторы весьма сложен и на сегодня не может считаться в достаточной степени изученным. Хотя за последние 20 лет в изучении механизмов отклика биообъекта на низкоинтенсивное фотовоздействие определились некоторые сдвиги, но они совершенно недостаточны для выработки общего мнения как исследователей и разработчиков аппаратуры, так и врачей. Поэтому для практических применений пока еще используются эмпирические методики. Вместе с тем такое положение дел при лавинообразном расширении рынка фототерапевтической аппаратуры становится все менее терпимым и повышает актуальность проблемы изучения механизмов отклика организма на низкоинтенсивное фотовоздействие в норме и при различных патологиях. В этом аспекте роль когерентности и поляризованности лазерного излучения должна учитываться, но не непосредственно как фактора, определяющего лечебный эффект, а как вспомогательного параметра воздействия, позволяющего оптимизировать дозу облучения.
Для терапии наиболее эффективными параметрами лазерного излучения считаются плотность мощности падающего излучения от 0,5 до 50 мВт/см2, плотность энергии поглощённого излучения от 0,1 до 10 Дж/см2 («терапевтический коридор»). Однако приблизительность и неоправданная «универсальность» этих цифр только подчеркивают необходимость выяснения преобладающих механизмов отклика организма.
Многофотонное возбуждение биомолекулы можно обеспечить с помощью короткого лазерного импульса сравнительно небольшой энергии, но большой пиковой мощности (до 109 Вт/см2). Фотохимические превращения проходят, как правило, в виде однофотонных фотохимических процессов. Исключение представляют условия мощного светового лазерного возбуждения, когда за время возбуждённого состояния молекула успевает поглотить второй квант. За счет исключения синглет-триплетной конверсии двухфотонное возбуждение по сравнению с однофотонным позволяет повысить эффективность фотохимической реакции. Высокоинтенсивное возбуждение дает более сильный цитотоксический эффект, чем низкоинтенсивное. С помощью нелинейной фототерапии производятся значительные фотохимические эффекты при таких малых временах воздействия, когда тепловые эффекты отсутствуют.
Следует подчеркнуть, что разделение фотобиологических воздействий на линейные в однофотонном и нелинейные в многофотонном случаях в значи-тельной мере условно и не выдерживает критики с точки зрения корректности. Даже повсеместно принимаемое как низкоинтенсивное фотовоздействие, заведомо не вызывающее тепловых изменений в тканях, практически всегда приводит к изменению оптических характеристик тканей, т.е. не может считаться линейным с точки зрения классической оптики. Этот вопрос наряду с проблемой выявления преобладающих механизмов отклика более подробно обсуждается ниже, в связи с дозиметрией неионизирующих излучений.
4.3.2. Медицинское применение ФДТ
При проведении фотодинамической терапии опухолевых заболеваний (см. §3.3.4) обычно применяется дозировка производных гематопорфирина ПГП 2,5...5 мг на 1 кг веса тела пациента, световая доза облучения примерно 20...120 Дж/см2 (l=630 нм), время между инъекцией ПГП и облучением 1-5 суток (табл. 5.1). Учитывая принципиальные недостатки Фс на базе ПГП, идет постоянный поиск новых, более эффективных Фс. Некоторые из них приведены в табл. 4.1 (для сравнения с отечественным препаратом Фотогем и американским Фотофрин-2 на основе ПГП взяты синтетический препарат Фотосенс на основе фталоцианина и Радахлорин на основе хлорина е 6).
Таблица 4.1. Сравнительные характеристики некоторых применяемых в клинической практике и перспективных фотосенсибилизаторов (Фс).
| Фотосенсибилизатор | Фотофрин 2 США | Фотогем Россия | Фотосенс Россия | Радахлорин Россия-Белоруссия |
| Квантовый выход интерконверсии | ~0.9 | ~0.9 | ~0.8 | ~0.8 |
| Квантовый выход синглетного кислорода | ~0.55 | ~0.55 | ~0.3 | ~0.5 |
| Период выведения из здоровых тканей | 30-90 дней | 30-90 дней | 15-30 дней | 1-2 дня |
| Средний контраст накопления онкотканями | 2 – 3 | 2 – 3 | 3 – 7 | 5 – 10 |
| Необходимая инъектируемая концентрация (мг/кг веса) | 2.5 – 5 | 2.5 – 5 | 1 – 2 | 1 – 1.5 |
| Рабочая длина волны максимума поглоще-ния, нм | 625 + 5 | 625 + 5 | 670 + 10 | 660 + 10 |
| Коэффициент молярной экстинкции на рабочей длине волны моль-1*см-1 (оценка) | ~5*103 | ~5*103 | ~105 | ~5*104 |
| Пороговая плотность мощности измерения для ФДЭ мВт/см2 (оценка) | 30 – 40 | ~50 | ~5 | ~10 |
Фотодинамический эффект зависит от того, где локализуется Фс (ткань органа, мембрана клетки, цитоплазма, митохондрии, ядро). Именно это является предметом первоочередного изучения при разработке новых Фс. Очевидно, что эта проблема прямо связана с проблемой выяснения основного субстрата реакции и проблемой избирательного накопления Фс в патологических тканях. Даже для наиболее распространенных Фс на основе ПГП нельзя признать проблему локализации решенной. Более того, обширные исследования, проведенные с этими типами Фс, привели врачей и разработчиков к убеждению, что возможности этих Фс близки к исчерпанию. Избирательность их накопления невысока (рабочая концентрация in vivo в опухолевых тканях не более, чем в 2-3 раза превышает концентрацию в здоровых тканях). Спектральные характеристики, определяющие выбор лазерного источника, далеки от оптимальных: 5 пиков поглощения в ближнем УФ и видимом диапазоне (рис. 4.4). Самый интенсивный пик поглощения препарата Фотогем расположен в районе 400 нм — там, где мягкие биоткани, ввиду их существенной кровенаполненности, очень плохо пропускают свет. Характерная глубина проникновения излучения здесь не превышает 1 мм, что не позволяет проводить ФДТ для имеющих практическое значение слоев биоткани (разве только для облучения новообразований в бронхах, что проводилось на ранних этапах применения ФДТ). Самый же длинноволновый пик поглощения, расположенный в области достаточно высокой прозрачности биотканей (625...630 нм), является настолько слабым, что в этом случае необходимо обеспечить высокий уровнь интенсивности облучения (пороговое значение плотности потока составляет не менее 50 мВт/см2, при обеспечении выходной мощности лазера порядка 0,5...1 Вт), а также высокую концентрацию препарата, что почти невозможно ввиду его достаточно высокой токсичности.

Всё это ограничивает возможности лечения достаточно широкого круга заболеваний (см. табл.4.1). С перечисленными недостатками связаны чисто клинические побочные явления: повышение фоточувствительности кожи, воспаление и отек окружающих зону облучения тканей, накопление препаратов не только в патологических тканях, но и в кроветворных и кровоочищающих органах (печень, почки, селезенка). Тем самым возможности лечения существенно сужаются. Перечисленные трудности клинического характера, с одной стороны, заставили более объективно оценить возможности ФДТ, с другой — дали мощный толчок поиску новых, более эффективных, Фс.
В последние годы появилось много перспективных Фс, получивших назва-ние Фс второго поколения (если считать, что первое поколение — это препара-ты на основе ПГП). Для Фс второго поколения характерно наличие сильных пиков поглощения в красной и ближней ИК области, причем наиболее типич-ные из них имеют практически единственный пик в этой области. Фс второго поколения находятся на пороге широкого клинического применения, и в ближайшие годы следует ожидать мощного потока информации, позволяющего объективно оценить их лечебные возможности. В первую очередь это относится к препаратам типа Фотосенс фталоцианинового ряда и Радахлорин хлоринового ряда (табл. 4.1), разработанным в России и СНГ (Белоруссия).
Однако, несмотря на то, что Фс второго поколения еще не вошли в широкую клиническую практику, активно разрабатываются и новые Фс, именуемые (пока еще не в общепринятой терминологии) Фс третьего поколения. Для этих Фс характерно не просто продвижение в ближнюю ИК область, но и формирование интенсивных пиков поглощения в этом диапазоне, соответствующих максимальному проникновению излучения в мягкие ткани (0,8...1,1 мкм). Это, с одной стороны, обеспечивает наиболее эффективное облучение максимально возможных объемов опухоли, с другой — позволяет достигнуть максимального контраста норма-патология с оптической точки зрения, поскольку именно в этой области спектра уменьшаются паразитные засветки за счет рассеяния (существенные в красной области), достигается максимальное отношение сигнал/шум для фотоприемных устройств дозиметрического контроля процесса облучения и имеются весьма перспективные источники лазерного и низкокогерентного высокомонохроматического излучения (светодиоды). Все это в принципе позволяет превратить установку для ФДТ из сложного стационарного комплекса аппаратуры в компактный и экономичный аппарат настольного типа, допускающий использование в поликлинических и амбулаторных условиях.
Сегодня большие надежды связываются с двумя семействами Фс: бактериохлорины (производные из хлорофилла, вырабатываемого бактериями) и бензофеноцианины, являющиеся полностью синтетическими препаратами. Компания Scotia Quantanova Pharmaceuticals’ (Гилфорд, Великобритания) разрабатывает препараты бактериохлоринового ряда, основным преимуществом которых (типичный представитель — препарат SQN400) является наличие главного максимума поглощения на 740 нм.
В результате проведенных биологических испытаний установлено, что хлориновые тетрапиррольные фотосенсибилизаторы обладают интенсивной полосой поглощения в длинноволновой области, оптимальным соотношением флюоресценция/интерконверсия и проявляют на порядок большую световую токсичность, чем большинство фотосенсибилизаторов, при отсутствии темновой токсичности. Общие токсические свойства при введении хлориновых фотосенсибилизаторов в организм оказываются лучше, чем у порфириновых олигомеров или сульфированных фталоцианинов, а скорости выведения препаратов из организма не сравнимы: Фотосенс и Фотогем сохраняются в организме на период более трёх месяцев против 2-х суток у водорастворимых хлориновых фотосенсибилизаторов.
Новые препараты для ФДТ. Сегодня имеется ряд новейших препаратов для ФДТ, полностью синтезированных и обладающих уникальными свойствами. В настоящее время в России в ФГУП ГНЦ «НИОПИК» синтезирована по оригинальной технологии стандартная субстанция 5-аминолевулиновая кислоты (5-АЛК), на основе которой изготавливается лекарственный препарат Аласенс. Зарубежным аналогом препарата Аласенс является препарат Levulin, разработанный фармацевтической компанией Dusa Pharmaceuticals Inc. (Торонто, США) на основе 5-аминоливалаланиновой кислоты (5-АLА). Этот препарат сам по себе не является сенсибилизатором, но производит особенное лечебное воздействие: он заставляет организм усиленно производить собственные Фс. В метаболизме клеток организма всегда присутствует генерация протопорфирина IХ (Пп IХ), который является сырьем для производства гемопротеинов (в первую очередь, гемоглобина). Обычно генерация Пп IХ сбалансирована потребностями организма в гемопротеинах, но в присутствии 5-АLА Пп IХ генерируется в избытке и накапливается в клетках. Таким образом, введение 5-АLA в опухолевые ткани сенсибилизирует их, заставляя производить избыточный Пп IХ. Облучая затем сенсибилизированные ткани, можно традиционным для ФДТ способом уничтожить их. Наиболее интересной особенностью Фс на основе 5-АLA является возможность не угнетения иммунных реакций организма, что обычно для всех ранее разработанных экзогенных Фс, а их стимуляции ввиду эндогенности действия препарата. В отличие от других Фс, Levulin изготавливается в любой форме: раствора, геля, крема и т.д.
Фирма Ergo Science Corp. (Чарлстоун, Массачусетс, США), позже других приступившая к разработкам Фс, специализируется на бензофеноцианинах. Эта фирма разрабатывает Фс, действие которых принципиально отличается от препаратов порфиринового семейства. Исходя из того, что препарат должен быть химически нейтральным, но при этом избирательно накапливаться в опухолевых клетках, синтезировано около 25 таких соединений. Они обладают широкой полосой поглощения в красном диапазоне и более эффективны, как Фс, чем большинство порфиринов. К тому же они внедряются и выводятся из организма гораздо быстрее, так что облучение можно проводить не позже 3 часов после введения препарата, а выведение из организма происходит не дольше 24 часов. Основным преимуществом этого типа Фс, по данным предварительных исследований, является не собственно цитотоксическое действие препарата, а стимуляция иммунных реакций организма. В этом плане разработки фирмы перекликаются с разработками компании Dusa Pharmaceuticals Inc. (Торонто, США), специализирующейся на препаратах на базе 5-ALA.
Источники света для ФДВ. При фотодинамическом воздействии могут использоваться любые источники света со спектром испускания, соответствующим спектру поглощения фотосенсибилизатора, и достаточной мощностью излучения. Поскольку возбуждение фотосенсибилизатора осуществляется светом определенной длины волны, причем эффективность цитотоксической реакции возрастает с уменьшением ширины полосы поглощения Фс, очевидно, что данный метод не мог получить должного развития в «долазерную эпоху», хотя само по себе фотодинамическое действие света было описано еще в начале ХХ века.
К преимуществам использования лазеров для ФДВ относятся: узкий спектр излучения (для лазеров на красителях возможно перестраивать длину волны); высокая выходная мощность излучения в требуемом спектральном диапазоне; возможность волоконно-оптической доставки излучения к опухоли без значительной потери мощности; возможность точно измерять и изменять дозу облучения. Однако He-Ne лазеры обладают малой мощностью, а лазеры на красителях дороги и трудоемки в обслуживании и настройке. Идеальным является случай совпадения максимума поглощения Фс с максимумом спектральной плотности источника света. К сожалению, на практике это удается реализовать далеко не всегда (даже если in vitro желаемое совпадение достигнуто, введение препарата in situ, как правило, изменяет положение максимума Фс малопредсказуемым образом). Поэтому используется либо перестраиваемый в широком диапазоне лазер (как правило, лазер на красителе), либо широкополосный источник. Ламповые источники практически вышли из употребления, но в последнее время большой интерес вызывают источники на светодиодах, монохроматичность которых гораздо выше, чем для ламп, хотя и существенно ниже, чем для лазеров.
На рис. 4.5 представлены характерные спектры поглощения для водных растворов отечественных препаратов Радахлорин и Фотосенс в сопоставимых концентрациях. Препарат Фотосенс имеет основной (самый интенсивный) пик поглощения в районе 670 нм, Радахлорин — 650...660 нм. Такое расположение максимумов в спектрах поглощения указанных Фс в диапазоне глубокого проникновения излучения в мягкие ткани позволяет снизить пороговую плотность потока излучения примерно на порядок по сравнению с препаратом Фотогем. Тем самым открывается возможность проведения эффективной ФДТ с применением светодиодных источников, поскольку в этом диапазоне спектра имеются интенсивные светодиодные излучатели. Наиболее характерное значение выходной мощности такого светодиода составляет 1 мВт в непрерывном режиме при токе через p-n- переход 10 мА и ширине спектра на половине высоты около 60 нм. Достичь плотности потока энергии порядка 10 мВт/см2, считающейся пороговой для возникновения ФДВ в большинстве литературных источников, вполне возможно, если светодиодный облучатель выполнен в виде матрицы и применена оптическая система, собирающая выходной пучок в пятно диаметром около 1 см. Фактором, ограничивающим применение светодиодных источников, является пока ещё недостаточная эффективность ввода излучения в волоконные световоды, поэтому ФДТ внутренних органов остается пока прерогативой лазерных источников.
При разработке источников лазерного излучения для ФДТ необходимо учитывать следующие требования.
1. Близость (в идеале — совпадение) длины волны излучения к положению максимума поглощения Фс в состоянии in situ. Последнее означает, что должна быть обеспечена перестройка частоты излучения в достаточно широких пределах, поскольку максимум поглощения Фс в зависимости от локализации препарата в различных тканях и клетках может меняться.
2. Возможность передачи излучения через оптическое волокно с высокой эффективностью для обеспечения проведения ФДТ как для наружных патологий, так и для внутренних органов.
3. Достаточная выходная мощность для превышения порога фотодинамического действия и необходимый запас мощности для случаев облучения больших объемов биоткани.
4. Малогабаритность, экономичность, простота управления.
Последнее требование до недавних пор не ставилось во главу угла, но с разработкой Фс второго и третьего поколений оно становится весьма актуальным. В этом плане имеются богатые возможности использования для ФДТ твердотельных лазеров с умеренными уровнями выходной мощности, работающих в импульсном режиме с воздушным охлаждением и полупроводниковых лазеров, имеющих на сегодня уже вполне достаточную для ФДТ мощность. Но наиболее благоприятные перспективы применения здесь имеют волоконные лазеры, в которых в качестве активной среды используется активированное оптическое волокно.
 |
Особый интерес представляют разработки новых средств доставки лазерного излучения к объекту фотодинамического воздействия. В аппаратуре первого поколения это были, как правило, моноволоконные световоды длиной несколько метров со световедущим диаметром 200...800 мкм. В этом случае требуется дополнительное оборудование для облучения больших объемов биоткани, с одной стороны, и для пункционного введения дистального конца световода внутрь облучаемой ткани, с другой стороны. Возникшие при клиническом применении лазерной аппаратуры первого поколения проблемы привели к появлению специальных оптических катетеров для ФДТ, которые имеет смысл рассматривать как элементы лазерной аппаратуры второго поколе-ния. Обязательной принадлежностью такого катетера является специальный оптический наконечник на дистальном конце («optical tip»), формирующий заданное пространственное распределение интенсивности. Такие микролинзовые системы делят на планарные (для облучения наружных образований), цилиндрические (для облучения трубчатых полостей типа пищевода или бронха) и сферические (для облучения либо внутренних полостей, либо больших объёмов ткани при пункционном введении). Что же касается лазерной аппаратуры третьего поколения (особенно на базе волоконных лазеров), то для нее разработка средств доставки неотделима от разработки собственно лазерных источников. Сегодня эта задача уже стоит на повестке дня.
При разработке световодных систем принципиальное значение приобретает мониторный контроль интенсивности излучения непосредственно в сердцевине световода, поскольку обычные методы контроля вводимого в световод излучения (измерение уровня мощности на входе и выходе световода) здесь не годятся. Однако, контролируемым такое воздействие до сих пор удавалось сделать только при облучении образований, сосредоточенных в достаточно тонких слоях ткани (например, опухолях мочевого пузыря, бронхов, пищевода). Благоприятность подобных случаев лечения заключается в том, что оптимальная доза,не повреждающая здоровых тканей, но максимально поражающая патологические, может быть рассчитана заранее. Клинический опыт показывает, что в таких случаях применение ФДТ дает исключительно высокий процент успешного лечения (более 90%). Уже одно это стоит того, чтобы развивать методику, ведь именно такие случаи считаются у онкологов наиболее трудно излечимыми. Однако столь высокий процент излечения не должен вызывать эйфории, поскольку общее число больных, подлежащих такому лечению, относительно невелико.
Многочисленные попытки обеспечить оперативный и эффективный дозиметрический контроль при облучении больших объемов ткани, где при расчете фотодинамической дозы следует учитывать не только обесцвечивание Фс, но и затухание излучения при прохождении толстых оптически неоднородных слоев, до сих пор успеха не имели. Можно, тем не менее, указать направления исследования, продвижение в которых может способствовать достижению необходимых результатов.
Так, в ряде работ предложены методы мониторного контроля интенсив-ности лазерного излучения, пропускаемого через световод. Эти методы основаны на применении интегральной фотометрии излучения, проходящего через оболочку световода (интегральный фотометр как бы «надевается на световод», причем для управляемого возрастания сигнала, регистрируемого фотометром, можно либо задавать изгиб световода внутри фотометрической полости, либо контролируемо повреждать оптическую оболочку). Такая методика позволяет контролировать как уровень мощности непосредственно проходящего через световод излучения, так и регистрировать «добавку», связанную с попаданием в световод диффузно отраженного излучения в процессе облучения биоткани. Если использовать сигнал с интегрального фотометра в качестве управляющего, то дозу облучения можно устанавливать в ходе оперативной обработки сигнала прямо в ходе сеанса. Безусловно, такая задача должна решаться с применением информационных технологий, поскольку при таком подходе главным элементом системы управления является ЭВМ.
Современные волоконно-оптические технологии позволяют изготавливать не только моноволоконные световоды для передачи излучения во внутренние полости, но и специальные многоволоконные оптические катетеры, позволяющие передавать оптическое изображение исследуемой области. Такой катетер может быть введен в инструментальный канал эндоскопа, а может вводиться и самостоятельно, пункционным образом. В качестве примера можно привести отечественный комплекс «Фотодин» (НПО «Комета», Москва), сочетающий в себе как диагностические возможности (фоконный волоконно-оптический зонд, позволяющий передавать люминесцентный «портрет» операционного пространства, регистрируемый ПЗС-камерой и запоминаемый ЭВМ), так и терапевтические (избирательное воздействие на операционную область с использованием светомодулирующего устройства, задающего пространственное распределение интенсивности облучения в соответствии с люминесцентным «портретом»). Управление светомодулирующим устройством с помощью ЭВМ позволяет в режиме реального времени отслеживать изменения в операционном пространстве и автоматически изменять параметры воздействия. Комплекс «Фотодин» представляет собой прототип аппаратуры для ФДТ третьего поколения, где возможен концептуальный прорыв в лечении онкологических заболеваний с применением информационных технологий. Он пока не имеет зарубежных аналогов.
Еще одним примером отечественных достижений в области медицинских применений ФДТ являются установки, разработанные в Лаборатории лазерной биоспектроскопии при Институте общей физики РАН (Москва) под руководством проф. В.Б. Лощенова. Эти установки ориентированы на работу с двумя сенсибилизаторами: типа Фотосенс и типа Аласенс.

Лабораторией лазерной биоспектроскопии разработана и передана в серийное производство установка типа ЛФТ-630-01-БИОСПЕК для использования совместно с Фс типа Аласенс. Максимум поглощения препарата находится на длине волны 630 нм, источником излучения служит лазерный диод, работающий на этой длине волны. Установка выпускается в компактном исполнении, не требует трудоемкого технического обслуживания, излучатель работает при комнатной температуре без принудительного охлаждения. Предназначена для ФДТ внутриполостных, внутритканевых и поверхностных образований. Комплектуется набором волоконно-оптических инструментов для терапии различных локализаций. Внешний вид установки и пример ее применения для лечения наружных новообразований показан на рис. 4.6.
В той же лаборатории разработана установка типа ЛФТ-675-01 БИОСПЕК для работы с Фс типа Фотосенс. Установка оснащена системой экспресс-диагностики, позволяющей локально определять степень накопления фотосенсибилизатора в любых органах и тканях, доступных для волоконно-оптического зонда. Как и ЛФТ-630-01, установка достаточно универсальна и может использоваться для терапии внутритканевых, внутриполостных и поверхностных опухолей. Источником излучения служит лазерный диод, работающий на длине волны 675 нм. Внешний вид и примеры применения установки типа ЛФТ-675-01 показаны на рис. 4.7.
 |
Установки типа ЛФТ-630-01 и ЛФТ-675-01 разработаны на базе ранее разработанной установки типа ЛЭСА-01, предназначавшейся для контроля ФДТ с применением произвольных фотосенсибилизаторов и для флуоресцентной диагностики опухолевых новообразований.
Нетрудно заметить, что практически все современные установки для ФДТ сочетают в себе как лечебную, так и диагностическую функции.
Диагностическое применение Фс. Поскольку большинство Фс являются люминофорами, они могут использоваться для ранней диагностики. Селективное накопление Фс злокачественными клетками позволяет по характерному флуресцентному свечению с большой точностью выявить границы и степень ракового поражения. Особое значение такая диагностика имеет при раковых заболеваниях органов с малым кровоснабжением (например, мочевого пузыря и бронхов), когда нет выраженного визуального изменения тканей, а присутствует только замена здоровых клеток злокачественными. Требования к Фс, определяющие его эффективность для терапии и диагностики, противоположны: для терапии необходимо, чтобы квантовый выход интерконверсии g ик был близок к единице, для диагностики — наоборот, g ик должен стремиться к нулю. В связи с этим для ФДТ требуется поиск двух классов фотосенсибилизаторов: диагностических (с высоким квантовым выходом флуоресценции) и терапевтических (имеющих высокий квантовый выход генерации 1O2).
В настоящее время созданы два типа перспективных диагностических Фс – производные гематопорфирина с иттербием (Гайдук М.И., Григорьянц В.В., Миронов А.Ф., Румянцева В.Д. и др.) и с платиной (Миронов А.Ф., Румянцева В.Д. и др.). Особенность этих препаратов состоит в том, что ионы иттербия и платины, введенные в соответствующие производные гематопорфирина, делают их структуры весьма устойчивыми по отношению к световому воздействию, в том числе и лазерному. Другими словами, введение иттербия и платины в ПГП подавляет их исходную фототоксичность, и, что особенно важно, никак не влияет при этом на их способность избирательно накапливаться в опухолях. Яркость же люминесценции и контраст по отношению к естественной люминесценции окружающей опухоль здоровой ткани у разработанных препаратов значительно выше, чем у известных терапевтических Фс. Особенно перспективны в качестве диагностических Фс с иттербием, который имеет узкую и интенсивную линию люминесценции на длине волны 0,98 мкм, где здоровая биоткань практически не светится. Это позволяет надеяться на создание электронной аппаратуры с рекордной обнаружительной способностью по отношению к злокачественным опухолям различной природы и создать действительно раннюю диагностику онкологических заболеваний. Фотодинамическая диагностика, хотя и близка по своей природе к фотодинамической терапии, в лечебном отношении она никак с ней не связана. Это означает, что диагностические данные, получаемые перед началом лечения и в его процессе с помощью фотодинамическая диагностики, могут одинаково успешно использоваться при лечении онкологических больных всеми известными в настоящее время методами или их наиболее эффективной комбинацией. В этом случае можно надеяться на значительное повышение вероятности полного излечения больных.
Применение ФДТ за пределами онкологии. Возможности метода не ограни-чиваются онкологией. Имеется ряд интересных сообщений о применениях ФДТ в ряде других областей медицины. Возможность перенесения средств и методов фотодинамической терапии на лечение неопухолевых заболеваний открывается также благодаря тому, что фотосенсибилизаторы, выступающие важнейшим компонентом в ФДТ, избирательно поглощаются не только онкологическими, но и другими патологическими клетками. Расширение сферы применения ФДТ тесно связано с поиском новых Фс.
Механизмы ФДТ на сегодня еще не изучены до уровня повседневных методических рекомендаций, поэтому каждый медицинский центр, где применяется ФДТ, является одновременно и научным центром.
Рассмотрим различные направления применения фотодинамической терапии и диагностики.
1) Лечение опухолей. За счёт чего же накапливается Фс в опухолях? Перечислим несколько возможных причин избирательного накопления.
· тропность – распознаётся онкоклетками как «свой»;
· скорость роста опухолевых клеток почти в 100 раз больше, чем нормальных клеток. При этом опухолевые клетки питаются за счёт окружающих клеток, в том числе и фотосенсибилизатором;
· более кислая среда опухоли из-за избытка кислых метаболитов и др.
2) Бактериология. Поскольку бактериальные клетки растут ещё быстрее, чем опухолевые, метод ФДТ был успешно опробован для лечения заболеваний, вызванных различными бактериями. Обнаружено, что Фс накапливается у всех видов бактерий в цитоплазме, ядре, внутриклеточных органеллах, а в граммположительных бактериях во внешней оболочке мембраны, которая у этих видов бактерий является рыхлой. Устойчивость патогенов к антибиотикам и необходимость проведения системного лечения создают множество вторичных проблем (проблемы нефро-, гепато- и нейротоксичности). Одна из таких проблем – проблема системной токсичности антибактериальных препаратов. Она может быть рассмотрена с точки зрения "волшебной пули", гипотетически представляющей антимикробное средство, целевым образом доставляемое в очаг поражения и взаимодействующее только с возбудителем инфекционного заболевания, но не с тканями и клетками организма-хозяина. В данном контексте таким средством представляется ФДТ.
а) Стоматология. Граммположительные бактерии живут во влажных местах организма, в том числе и во рту. Благодаря хорошему накоплению ими Фс возможно применение ФДТ для лечения различных стоматологических заболеваний.
Так, например, в Бэкмановском лазерном институте в Ирвине (Калифор-ния, США) ведутся исследования возможностей диагностики злокачественных новообразований в ротовой полости с помощью 5-ALA. Проблема заключается в том, что белесоватые повреждения слизистой оболочки, являющиеся предраковыми образованиями, могут длительное время (в течение ряда лет) вести себя бессимтомно. Если же они переходят уже в злокачественную форму (малигнизируются), то в дальнейшем процесс резко ускоряется. Единственная возможность своевременного обнаружения малигнизации образований заключается в регулярном взятии биопсии, однако ни для пациентов, ни для дантистов нежелательно усугублять повреждения слизистой оболочки рта с частотой не менее, чем раз в полгода. Использование 5-ALA в качестве диагностического теста в случае начинающейся малигнизации дает характерную розовато-красную люминесценцию патологических тканей при засветке голубовато-синим светом. Люминесцентная диагностика может сочетаться с ФДТ (лечением) обнаруженных патологий.
Аналогичные исследования, проводимые в лаборатории лазерной биоспектроскопии, позволили разработать комплекс аппаратуры, предназначенной для флуоресцентной диагностики и ФДТ заболеваний тканей пародонта. В отличие от американского аналога, ориентированного на препараты на основе 5-ALA, отечественная установка может работать как с препаратом Аласенс, так и с препаратом Фотосенс.
б) Фс хорошо накапливается в туберкулёзных палочках, что делает возможным успешное применение ФДТ при лечении туберкулёза. В этой связи представляет интерес комбинированное воздействие ФДТ на микобактерии туберкулеза in vitro с сульфированным фталоцианином алюминия (НИОПИК, Россия) и лазерного излучения с длиной волны 675 нм в дозе 20 Дж/см2. Для исследования были использованы жизнеспособные культуры M. tuberculosis. Результатом явилась отчетливая задержка роста колоний микобактерий. В контроле (только Фс и только лазерное воздействие) задержки роста колоний не наблюдали. С хорошим клиническим эффектом применена ФДТ (с сульфированным фталоцианином алюминия и внутрикавернозным лазерным облучением на длине волны 675 нм при дозе 300 Дж/см2) в комплексном лечении прогрессирующего фиброзно-кавернозного туберкулеза в Сибирском центре лазерной медицины (Новосибирск).
в) В Бернском университете (Швейцария) предложено использовать ФДТ для уничтожения бактерий Helicobacter pylori, вызывающих язву желудка. Обнаружено, что можно уничтожать эти бактерии еще до того, как они вызовут повреждение слизистой оболочки и тем самым предотвращать язвенную болезнь. Данный метод лечения имеет решающее преимущество в том, что не способствует появлению устойчивых к действию лекарств штаммов бактерий, как это имеет место в случае лечения антибиотиками. В этом отражается та особенность ФДТ, что некоторые Фс могут проникать в ядро клетки и производить генетическое воздействие, тогда как большинство антибиотиков ограничены соматическим воздействием. Этот механизм пока еще не изучен хотя бы на уровне простейших математических моделей.
г) Инфицированные раны и длительно незаживающие язвы. Рана представляет собой повреждённую покровную ткань. При заражении она выстилается гнойно-некротическим слоем, где живут, в частности, бактерии, которые могут активно накапливать Фс (рис.4.8). Накопление Фс бактериями i n vitro происходит примерно за 12 часов, in vivo – за 24 часа. 
В настоящее время для лечения гнойных ран и незаживающих язв используется импрегнация в них антибиотиков с помощью ультразвука. В специальный волновод для обработки ран заводится ультразвук с частотой 26,5 кГц и амплитудой 20...40 мкм. При воздействии ультразвуковой волны создаётся акустическое давление, возникает кавитация, акустические потоки, которые помогают антибиотику внедряться в ткани. На основе этого метода предложено сочетать фотосенсибилизацию и ультразвуковое воздействие. При этом импрегнируется Фс. Время накопления Фс в этой методике уменьшается до 5 минут, а вся процедура вместе с облученем длится 10...15 минут. При таком лечении рана заживает в 3...4 раза быстрее, чем в традиционных случаях. В развитие предложенной методики решено было использовать вместе с Фс и антибиотик. Поскольку в ране могут находиться как граммположительные, так и граммотрицательные бактерии,






