ЩЁЛОЧЕЙ
1. Металл + H 2 O = ЩЁЛОЧЬ + Н2↑
2Na + 2H2O = 2NaOH + H2
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba, Ra)
2. ОКСИД МЕТАЛЛА + H 2 O = ЩЁЛОЧЬ
Na2O + H2O = 2 NaOH
Здесь, ОКСИД МЕТАЛЛА (основный оксид, растворимый в воде) – щелочного металла (Li, Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra)
НЕРАСТВОРИМЫХ ОСНОВАНИЙ
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
МехАу+ Ме*(OH) n = Me (OH)у↓+Ме*хА n
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.

Классификация кислот
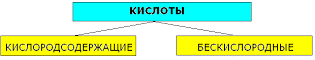
1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная n = 2 двухосновная n = 3 трехосновная
2. По составу:
а) Таблица кислородсодержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
| Кислота (НnА) | Кислотный остаток (А) | Соответствующий кислотный оксид |
| HClO4хлорная | ClO4 (I) перхлорат | Cl2O7 оксид хлора (VII) |
| H2SO4 серная | SO4 (II) сульфат | SO3 оксид серы (VI), серный ангидрид |
| HNO3 азотная | NO3 (I) нитрат | N2O5 оксид азота (V) |
| HMnO4 марганцевая | MnO4 (I) перманганат | Mn2O7 оксид марганца (VII) |
| H2SO3 сернистая | SO3 (II) сульфит | SO2 оксид серы (IV) |
| H3PO4 ортофосфорная | PO4 (III)ортофосфат | P2O5 оксид фосфора (V) |
| HNO2 азотистая | NO2 (I) нитрит | N2O3 оксид азота (III) |
| H2CO3 угольная | CO3 (II) карбонат | CO2 оксид углерода (IV), углекислый газ |
| H2SiO3 кремниевая | SiO3 (II) силикат | SiO2 оксид кремния (IV) |
б) Таблица бескислородных кислот
| Кислота (НnА) | Кислотный остаток (А) |
| HCl соляная, хлороводородная | Cl (I) хлорид |
| H2Sсероводородная | S(II) сульфид |
| HBrбромоводородная | Br (I) бромид |
| HI йодоводородная | I(I) йодид |
| HFфтороводородная,плавиковая | F(I) фторид |
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости.известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниеваяH2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Способы получения кислот
| бескислородные | кислородсодержащие |
| HCl, HBr, HI, HF, H2S | HNO3, H2SO4и другие |
ПОЛУЧЕНИЕ






