Повторение
«Основные классы неорганических веществ»
Классы неорганических соединений
| Оксиды Э а О b | Основания М(ОН) а (гидроксиды) | ||||||||||||||||||
| основные | кислотные | растворимые (щелочи) | нерастворимые | ||||||||||||||||
|
|
|
| ||||||||||||||||
| Кислоты H a X и H a ЭО b | Соли средние M a Y b | ||||||||||||||||||
| бескислородные | кислородсодержащие | ||||||||||||||||||
|
|
| |||||||||||||||||
| Соли кислые MH a Y | Cоли основные M(OH) a Y | ||||||||||||||||||
|
| ||||||||||||||||||
| Металл + кислород | |||||||||||||||||||
Условные обозначения: Э – химический элемент, М – металл, а и b – индексы, Х и Y – кислотные остатки.
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность равной 2. Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Называются они просто - "оксид + название элемента" (см. таблицу). Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента.
| Формула | Название | Формула | Название |
| CO | оксид углерода (II) | Fe2O3 | оксид железа (III) |
| NO | оксид азота (II) | CrO3 | оксид хрома (VI) |
| Al2O3 | оксид алюминия | ZnO | оксид цинка |
| N2O5 | оксид азота (V) | Mn2O7 | оксид марганца (VII) |
Классификация оксидов
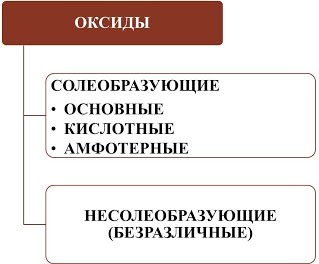
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
| Оксиды металловМехОу | Оксиды неметалловнеМехОу | |||
| Основные | Кислотные | Амфотерные | Кислотные | Безразличные |
| I, II Ме | V-VII Me | ZnO,BeO,Al2O3, Fe2O3, Cr2O3 | > II неМе | I, II неМе CO, NO, N2O |
1). Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксидыметаллов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид берилия):

2). Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO3-оксид хрома (VI), Mn2O7 - оксид марганца (VII)):

3). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV, а также цинк и бериллий (Например, BeO, ZnO, Al2O3, Cr2O3).
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например,N2O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность равной 2. Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Называются они просто - "оксид + название элемента" (см. таблицу). Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента.
| Формула | Название | Формула | Название |
| CO | оксид углерода (II) | Fe2O3 | оксид железа (III) |
| NO | оксид азота (II) | CrO3 | оксид хрома (VI) |
| Al2O3 | оксид алюминия | ZnO | оксид цинка |
| N2O5 | оксид азота (V) | Mn2O7 | оксид марганца (VII) |
Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.

| Оксиды металловМехОу | Оксиды неметалловнеМехОу | |||
| Основные | Кислотные | Амфотерные | Кислотные | Безразличные |
| I, II Ме | V-VII Me | ZnO,BeO,Al2O3, Fe2O3, Cr2O3 | > II неМе | I, II неМе CO, NO, N2O |
1). Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксидыметаллов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид берилия):

2). Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO3-оксид хрома (VI), Mn2O7 - оксид марганца (VII)):
3). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV, а также цинк и бериллий (Например, BeO, ZnO, Al2O3, Cr2O3).
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например,N2O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Химические свойства оксидов
| ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ 1. Основной оксид + Кислотный оксид = Соль (р. соединения) CaO + SO2 = CaSO3 2. Основной оксид + Кислота = Соль + Н2О (р. обмена) 3K2O + 2H3PO4 = 2K3PO4 + 3H2O 3. Основной оксид + Вода = Щёлочь (р. соединения) Na2O + H2O = 2NaOH |
| ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ 1. Кислотный оксид + Вода = Кислота (р. соединения) СO2 + H2O = H2CO3, SiO2 – не реагирует 2. Кислотный оксид + Основание = Соль + Н2О (р. обмена) P2O5 + 6KOH = 2K3PO4 + 3H2O 3. Основной оксид + Кислотный оксид = Соль (р. соединения) CaO + SO2 = CaSO3 4. Менее летучие вытесняют более летучие из их солей CaCO3 + SiO2 = CaSiO3 +CO2 |
| ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ Взаимодействуют как с кислотами, так и со щелочами. ZnO + 2 HCl = ZnCl2 + H2O ZnO + 2 NaOH + H2O = Na2[Zn(OH)4] (в растворе) ZnO + 2 NaOH = Na2ZnO2 + H2O (при сплавлении) |
Основания - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами - ОН. Общая формула:

По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
| Формула | Название | Формула | Название |
| LiOH | гидроксид лития | Ca(OH)2 | гидроксид кальция |
| NaOH | гидроксид натрия | Cu(OH)2 | гидроксид меди(II) |
| KOH | гидроксид калия | Fe(OH)3 | гидроксид железа(III) |
Классификация оснований

Щёлочи – это основания растворимые в воде. К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные - нерастворимые.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью -как кислоты.
Классификация оснований по числу групп ОН:
n=1 однокислотное n=2 двухкислотное n=3 трехкислотное
Физические свойства
Большинство оснований – твёрдые вещества с различной растворимостью в воде.





 основный оксид: 2Ca + O2 = 2CaO.
основный оксид: 2Ca + O2 = 2CaO. .
. + соль4 (р-р): К2SO4 + BaCl2 = BaSO4
+ соль4 (р-р): К2SO4 + BaCl2 = BaSO4 

