В настоящем разделе рассмотрены следующие темы:
1. Основные понятия молекулярно-кинетической теории (МКТ) и термодинамики.
2. Уравнение Менделеева–Клапейрона и основное уравнение МКТ. Опытные законы идеального газа. Строение реальных веществ. Газ Ван-дер-Ваальса.
3. Распределения Максвелла и Больцмана.
4. Степени свободы. Внутренняя энергия идеального газа (ИГ), работа, количество теплоты. Первое начало термодинамики.
5. Теплоемкость.
6. Применение первого начала термодинамики к изопроцессам. Адиабатический процесс.
7. Энтропия. Второе начало термодинамики. Круговой процесс. Цикл Карно.
8. механика жидкостей
В условиях задач этого раздела температура может задаваться в градусах Цельсия. При проведении числовых расчетов необходимо перевести температуру в градусы Кельвина исходя из соотношения 0 °С = 273,15К. Также необходимо перевести в систему СИ все остальные величины. Например, 1л = 10-3 м3, 1 см3 = 10-6 м3, 1 мм рт.ст. = 133 Па, 1 атм = 760 мм рт. ст. = 1,013 ·105 Па.
Основные законы и формулы
Основные понятия молекулярно-кинетической теории
И термодинамики
Количество вещества системы (в молях) равно
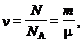
где N – число частиц системы; N A – число Авогадро; m, m – масса и молярная масса вещества.
Если система представляет смесь нескольких газов, то количество вещества системы равно
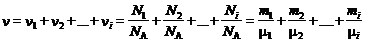 ,
,
где n i , Ni , mi , m i – соответственно количество вещества, число молекул, масса, молярная масса i -го компонента смеси.
Молярная масса смесигазов вычисляется по формуле
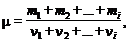
где тi и n i – масса и количество вещества i -го компонента смеси.
Массовая доля w i i -го компонента смеси газа (в долях единицы или в процентах) равна
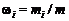 ,
,
где т – масса смеси.
Концентрация молекул (число частиц в единице объема) равна
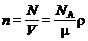 ,
,
где N – число частиц, содержащихся в данной системе; r – плотность вещества; N А– постоянная Авогадро.
Средняя энергия молекул идеального газа
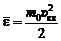 ,
,
где υ кв – средняя квадратичная скорость.
Скорости молекул определяются формулами:
а) средняя квадратичная 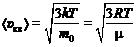 ;
;
б) средняя арифметическая 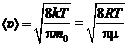 ;
;
в) наиболее вероятная 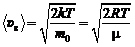 ,
,
где т 0 – масса одной молекулы.
Закон равнораспределения энергии по степеням свободы
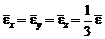 ,
,
где 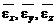 – средние значения энергии поступательного движения молекул, связанные соответственно с движением частиц относительно осей x, y, z;
– средние значения энергии поступательного движения молекул, связанные соответственно с движением частиц относительно осей x, y, z; 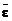 – средняя энергия молекулы идеального газа.
– средняя энергия молекулы идеального газа.
Зависимость давления газа от концентрации молекул и температуры p = nkT.
Размерность давления в системе СИ: [ P ] = Н/м2 = паскаль (Па). На практике часто используются и другие единицы измерения давления: 1 мм рт.ст., 1 мм вод. ст.,физическая (1 атм) и техническая атмосферы (1 ат).
1 мм рт. ст. = 1 Торр = 133 Па,
1 мм вод. ст.= 9,81 Па,
1 атм = 760 мм рт. ст. = 1,013 ·105 Па,
1 ат = 1кг/см2 = 0,981· 105 Па.
Средняя кинетическая энергия поступательного движения молекулы
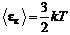 ,
,
где k – постоянная Больцмана, k =1,38×10-23 Дж/К.
Средняя полная кинетическая энергия молекулы
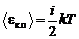 ,
,
где i - число степеней свободы молекулы.
2.1.2. Уравнение Менделеева–Клапейрона и основное






