Химия» для специальности
31.05.01 «Лечебное дело»
31.05.02 «Педиатрия»

Поиск: Рекомендуем:  Почему я выбрал профессую экономиста
Почему я выбрал профессую экономиста
 Почему одни успешнее, чем другие
Почему одни успешнее, чем другие
 Периферийные устройства ЭВМ Периферийные устройства ЭВМ
 Нейроглия (или проще глия, глиальные клетки) Нейроглия (или проще глия, глиальные клетки)
Категории:
|
Важной характеристикой раствора является концентрация. Этой величиной определяются многие свойства растворов.
Химия» для специальности 31.05.01 «Лечебное дело» 31.05.02 «Педиатрия» |
Химия» для специальности 31.05.03 «Стоматология» | |||
| 1. | Введение в лабораторный практикум. Величины, характеризующие количественный состав растворов. Приготовление раствора с заданной концентрацией. | 1. | Введение в лабораторный практикум. Величины, характеризующие количественный состав растворов. Приготовление раствора с заданной концентрацией. | ||
| 2. | Основы химического анализа. Качественный и количественный анализ. Основы титриметрического анализа. Метод кислотно-основного титрования. Алкалиметрия. | 2. | Основы химического анализа. Качественный и количественный анализ. Основы титриметрического анализа. Метод кислотно-основного титрования. Алкалиметрия. | ||
| 3. | Химическая термодинамика и кинетика биохимических реакций. Химическое равновесие. | 3. | Химическая термодинамика и кинетика биохимических реакций. Химическое равновесие. | ||
| 4.
| Растворы. Законы растворимости. Растворы электролитов. Теории кислот и оснований. Коллигативные свойства растворов. Диффузия. Осмос. | 4. | Окислительно-восстановительные взаимодействия. Основы электрохимии. | ||
| 5. | Растворы. Законы растворимости. Растворы электролитов. Теории кислот и оснований. Коллигативные свойства растворов. Диффузия. Осмос. | ||||
| 5. | Кислотно-основное равновесие в организме. Водородный показатель биологических жидкостей. Буферные системы. Буферная емкость. | 6. | Кислотно-основное равновесие в организме. Водородный показатель биологических жидкостей. Буферные системы. Буферная емкость. | ||
| 6. | Коллоидные растворы: получение, очистка и свойства. Коагуляция коллоидных растворов. Коллоидная защита. | 7. | Коллоидные растворы: получение, очистка и свойства. Коагуляция коллоидных растворов. Коллоидная защита. | ||
| 7. | Биогенные s–, p– и d– элементы: биологическая роль, применение в медицине. Комплексообразование в биологических системах. Метод комплексонометрии. | 8. | Биогенные s–, p– и d– элементы: биологическая роль, применение в медицине. Комплексообразование в биологических системах. Метод комплексонометрии. | ||
| 8. | Классификация, номенклатура, изомерия биоорганических соединений. Реакционная способность углеводородов. | 9. | Классификация, номенклатура, изомерия биоорганических соединений. Реакционная способность углеводородов. | ||
| 9. | Строение и реакционная способность гидрокси-, оксосоединений и карбоновых кислот. | 10. | Строение и реакционная способность гидрокси-, оксосоединений и карбоновых кислот. | ||
| 10. | Углеводы. Строение и химические свойства моно-, ди- и полисахаридов. | 11. | Углеводы. Строение и химические свойства моно-, ди- и полисахаридов. | ||
| 11. | Строение, свойства и биологическая роль простых и сложных липидов. Неомыляемые липиды. | 12. | Строение, свойства и биологическая роль простых и сложных липидов. Неомыляемые липиды. | ||
| 12. | Классификация, строение и значение биологически важных гетероциклических соединений. Общая характеристика витаминов. Строение и биологическая роль нуклеозидов, нуклеотидов и нуклеиновых кислот. | 13. | Классификация, строение и значение биологически важных гетероциклических соединений. Общая характеристика витаминов. Строение и биологическая роль нуклеозидов, нуклеотидов и нуклеиновых кислот. | ||
| 13. | Строение, свойства и биологическая роль α-аминокислот. Структурная организация и физико-химические свойства белков. Высокомолекулярные соединения. | 14. | Строение, свойства и биологическая роль α-аминокислот. Структурная организация и физико-химические свойства белков. Высокомолекулярные соединения. | ||
Занятие № 1. Тема: „Введение в лабораторный практикум. Определение исходного уровня знаний. Величины, характеризующие количественный состав растворов. Приготовление раствора с заданной концентрацией ”.
Химия входит в число наук, составляющих фундамент медицины. Химические методы исследования постоянно используются в диагностике заболеваний и профилактических обследованиях. Химический синтез является основой изготовления лекарств. Поэтому, для дальнейшего изучения материала, необходимо знать теоретические основы химии. Наряду с теоретической базой, в медицине применяются экспериментальные методы, помогающие освоению материала.
В настоящее время практикуму, как специфической и важнейшей форме учебной работы, уделяется особое внимание, так как усвоение изучаемого материала, может происходить только в ходе активной деятельности самого учащегося. Эта деятельность реализуется на практике и лабораторных занятиях в процессе решения различных ситуационных задач. Без знания техники лабораторных работ нельзя быть уверенным в точности поставленного эксперимента.
Многие химические процессы протекают лишь при условии, что участвующие в них вещества находятся в растворенном состоянии. Растворы имеют большое значение, как в промышленности, так и в медицине. Важнейшие биологические жидкости – кровь, лимфа, моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биохимические реакции в живых организмах протекают в растворах. В жидких средах организма поддерживается постоянство кислотности, концентрации солей и органических веществ (концентрационный гомеостаз). Биологические жидкости участвуют в транспорте питательных веществ (жиров, аминокислот, кислорода), лекарственных препаратов к органам и тканям, а также в выведении из организма метаболитов (мочевины, билирубина, углекислого газа и т.д.). Приведенные примеры подчеркивают важность изучения свойств растворов для медиков.
Важной характеристикой раствора является концентрация. Этой величиной определяются многие свойства растворов.
Изучить правила техники безопасности при работе в химической лаборатории. Ознакомиться с основной лабораторной посудой. Изучить способы выражения концентрации растворов: массовую долю, молярную концентрацию, моляльную концентрацию, молярную концентрацию эквивалента, мольную долю. Научиться готовить растворы заданной концентрации.
| 1. | Правила работы в лаборатории. Правила техники безопасности. |
| 2. | Оборудование лаборатории. Виды лабораторной посуды: основная лабораторная посуда. |
| 3. | Правила работы с химическими реактивами: общеупотребительные (кислоты, щелочи, ряд солей, индикаторы) и специальные (только для определенных работ) химические реактивы; чистота реактивов (х.ч., ч.д.а., ч.). |
| 4. | Понятия: раствор, растворитель, растворенное вещество. |
| 5. | Способы выражения концентраций (массовая доля, молярность, моляльность, молярная концентрация эквивалента, мольная доля). Закон эквивалентов. |
| 6. | Физические характеристики растворов (коэффициент преломления, плотность). |
| 7. | Биологическое значение и применение растворов. |
4. Задания для самостоятельного решения (выполнить письменно):
| 1. | К какому классу соединений относится следующее вещество: Cu(OH)2 | |
| A | оксид | |
| B | гидроксид | |
| C | пероксид | |
| D | соль основная | |
| 2. | Дать название оксиду по международной номенклатуре: N2O | |
| A | оксид азота (II) – «веселящий газ» | |
| B | оксид азота (IV) – «бурый газ» | |
| C | оксид азота (I) – «веселящий газ» | |
| D | оксид азота (V) – аммиак | |
| 3. | Определить формулу соли натрия гидросульфат: | |
| A | Na2S2O3 | |
| B | Na2SO4 | |
| C | NaHSO4 | |
| D | NaHSO3 | |
| 4. | Какая из приведенных кислот является одноосновной? | |
| A | Угольная | |
| B | Щавелевая | |
| C | Плавиковая | |
| D | Сернистая | |
| 5. | Дайте название кислоте: H2SO3 | |
| A | тиосерная | |
| B | сероводородная | |
| C | серная | |
| D | сернистая | |
| 6. | Какая из приведенных кислот не может образовать кислую соль? | |
| A | Уксусная | |
| B | Щавелевая | |
| C | Серная | |
| D | Сернистая | |
| 7. | Соли какой кислоты называются ацетаты? | |
| A | Хлорной | |
| B | Уксусной | |
| C | Сероводородной | |
| D | Азотной | |
| 8. | Определить степень окисления серы в Н2SO3: | |
| A | -2 | |
| B | +2 | |
| C | +4 | |
| D | +6 | |
| 9. | К какому типу солей относится следующее вещество: Cu(OH)Cl | |
| A | соль средняя | |
| B | соль кислая | |
| C | соль двойная | |
| D | соль основная | |
| 10. | К какому типу солей относится следующее вещество: KHCO3 | |
| A | соль средняя | |
| B | соль кислая | |
| C | соль двойная | |
| D | соль основная | |
| 11. | Формула для расчета молярной концентрации: | |
| A | 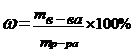
| |
| B | 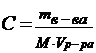
| |
| C | 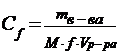
| |
| D | 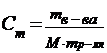
| |
| 12. | Формула для расчета молярной концентрации эквивалента: | |
| A | 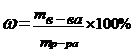
| |
| B | 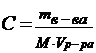
| |
| C | 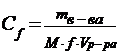
| |
| D | 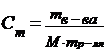
| |
| 13. | Фактор эквивалентности для HCl, H2SO4, H3PO4 равен: | |
| A | 1, 2, 3 | |
| B | 1, ½, 1/3 | |
| C | ½, 1/3, 1/6 | |
| D | ½, 1/3, 1 | |
| 14. | Фактор эквивалентности для ZnCl2, K2SO4, Na3PO4 равен: | |
| A | 1, 2, 3 | |
| B | ½, ½, 1/3 | |
| C | ½, 1/3, 1/6 | |
| D | ½, 1/3, 1 | |
| 15. | Единицы измерения молярной концентрации: | |
| A | Моль/л, М | |
| B | Моль/л ∙ экв, N | |
| C | Моль/кг | |
| D | % | |
| 16. | Единицы измерения моляльной концентрации: | |
| A | Моль/л, М | |
| B | Моль/л ∙ экв, N | |
| C | Моль/кг | |
| D | % | |
| 17. | Степень окисления азота в NH4Сl равна: | |
| A | +1 | |
| B | +2 | |
| C | +3 | |
| D | –3 | |
| 18. | 40 г CaCO3 соответствует следующее количество вещества: | |
| A | 0,4 моль | |
| B | 0,2 моль | |
| C | 0,1 моль | |
| D | 0,6 моль | |
| 19. | Химическая реакция между раствором хлорида калия и нитрата серебра является реакцией: | |
| A | нейтрализации | |
| B | гидролиза | |
| C | обмена | |
| D | окислительно-восстановительной | |
| 20. | Какой из элементов имеет высшую степень окисления +7: | |
| A | C | |
| B | Mn | |
| C | S | |
| D | Au |
1. Определить массовую долю (в %) раствора, если в воде массой 285 г растворено 15 г иодида натрия.
2. Какая масса соли необходима для приготовления 500 мл 2% раствора бромида калия с плотностью 1,01 г/мл.
3. Определить молярную концентрацию эквивалента раствора, в 50 мл которого содержится 0,96 г карбоната калия.
4. Какая молярная концентрация соответствует 40% раствору этилового спирта в воде? Плотность раствора – 0,94 г/мл.
5. Для приготовления 500 мл раствора серной кислоты Сf (H2SO4) = 2,0 моль/л использован 10% раствор серной кислоты плотностью 1,2 г/мл. Рассчитать объем (в мл) исходного раствора.
|
|
|
|
|
|
Дата добавления: 2018-10-14; Мы поможем в написании ваших работ!; просмотров: 398 | Нарушение авторских прав
Лучшие изречения: