
§11. Атомы, ионы, молекулы

Атом и его строение
Над тем, как устроено вещество, люди размышляли с глубокой древности. Античные греческие ученые предполагали, что вещества состоят из мельчайших, невидимых глазу частиц разной формы, которые соединяются друг с другом при помощи различных крючков и присосок. Слово «атом» в переводе с греческого означает «неделимый».
 Так ли это? Действительно ли атом неделим? Существование атома было доказано лишь в XIX веке путем эксперимента. Установлено, что атом содержит еще более мелкие по размеру частицы. Атом состоит из ядра и электронов, находящихся в околоядерном пространстве. В ядре сосредоточена практически вся масса атома. Вклад
Так ли это? Действительно ли атом неделим? Существование атома было доказано лишь в XIX веке путем эксперимента. Установлено, что атом содержит еще более мелкие по размеру частицы. Атом состоит из ядра и электронов, находящихся в околоядерном пространстве. В ядре сосредоточена практически вся масса атома. Вклад
электронов в массу атома крайне мал. Масса электрона составляет 9,1 · 10−31 кг. Каждый электрон заряжен отрицательно, условно его заряд принимают равным –1. Символ, которым принято обозначать электрон – ē.
Электроны движутся вокруг ядра, перемещаясь по сложным траекториям.
Ядро атома состоит из двух типов частиц: протонов и нейтронов.
Протоны обозначают буквой р, а нейтроны – n. Заряды и массы протона, нейтрона и электрона, приведены в таблице 1:
устройства атома
Таблица 1. Некоторые характеристики элементарных частиц
| Элементарная частица | Символ | Заряд | Масса |
| Электрон | ē | –1 | 9,1 · 10−31 кг |
| Протон | р | +1 | 1,67 · 10−27 кг |
| Нейтрон | n | 0 | 1,67 · 10−27 кг |
 В целом атом электронейтрален, то есть его заряд равен нулю. С учетом электронейтральности атома, количество электронов в атоме всегда
В целом атом электронейтрален, то есть его заряд равен нулю. С учетом электронейтральности атома, количество электронов в атоме всегда
совпадает с количеством протонов.
 С учетом того, что в ядре только протоны заряжены (нейтроны заряда не имеют), и заряд каждого протона +1, ядро имеет заряд.
С учетом того, что в ядре только протоны заряжены (нейтроны заряда не имеют), и заряд каждого протона +1, ядро имеет заряд.

Как определить количество электронов и протонов в атоме?
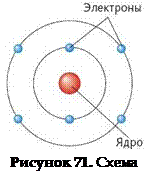
Рисунок 72. Схема атома водорода
На рисунке 72 приведена схема строения атома водорода. Видно, что атом водорода состоит из одного отрицательно заряженного электрона и положительно заряженного ядра, состоящего из одного протона.
Обратимся к Периодической Системе химических элементов. Порядковый номер водорода 1. Порядковый номер элемента равен заряду его ядра (Z) и имеет второе название – протонное число.


Рассмотрим другой пример. Определим количество электронов, протонов и заряд ядра для атома кислорода. Порядковый номер кислорода – 8. Значит, в его атоме содержится 8 электронов, 8 протонов, заряд ядра +8 (рисунок 73).
Как определить количество нейтронов? В начале параграфа уже упоминалось, что практически вся масса атома сосредоточена в его ядре. В свою очередь ядро состоит из протонов и нейтронов. Относительная атомная масса элемента, записанная в Периодической Системе, приблизительно равна сумма масс протонов и нейтронов, поскольку масса электронов очень мала. Сумму масс протонов и нейтронов, равную округленной атомной массе химического элемента, называют массовым (нуклонным) числом и обозначают А.
Определим количество нейтронов в атоме кислорода. Относительная атомная масса кислорода с учетом округления равна 16. Вычтем количество протонов: 16 – 8 = 8. В атоме кислорода 8 нейтронов.
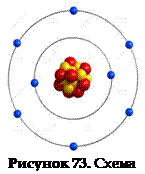
атома кислорода Синие частицы – ē Красные частицы – р Желтые частицы – n
С учетом вышесказанного можем записать несколько простых выражений:
· количество электронов равно количеству протонов ē = p;
· заряд ядра равен количеству протонов и имеет знак +, Z = p.


Протоны и нейтроны имеют общее название – нуклоны (от лат. nucleus – «ядро»).
Термином нуклид обозначают атом с определённым порядковым номером Z и массовым числом А, т.е. с определённым набором протонов и нейтронов. Нуклиды с одним и тем же атомным номером, но с разными массовыми числами называются изотопными нуклидами или просто изотопами (от греч. «изос» – «равный» и «топос» – «место»). Другими словами, в ядрах всех изотопов данного элемента содержится одинаковое число протонов, но разное число нейтронов.
Нуклиды обозначают символом элемента и массовым числом: 12С, 14N, 16O; другая форма записи: углерод-12, азот-14, кислород-16. Если массовое число не указывать, то подразумеваются все природные изотопы данного элемента. Иногда указывают и атомный номер элемента, но это не обязательно, поскольку символ элемента однозначно связан с определённым Z.
Так, для атомов водорода Z = 1, для азота Z = 7, для кислорода Z = 8 и т.д. Разных нуклидов значительно больше, чем элементов. Например, в природе найдены три изотопа водорода – нуклиды 1Н, 2Н (другое обозначение D – дейтерий) и 3Н (или Т – тритий), три изотопа углерода (12С, 13С и 14С), четыре – серы, пять – кальция, шесть – селена, семь – молибдена, восемь – кадмия, девять – ксенона и десять – олова (это рекорд). Есть и элементы- одиночки, представленные всего одним нуклидом: 9Ве, 19F, 23Na, 27Al, 31P и др.
Некоторые природные нуклиды нестабильны: со временем они распадаются; это – радионуклиды.
Ионы
В отличие от атомов, ионы – это заряженные частицы. Ионы образуются в том случае, если нейтральный атом «потеряет» или «приобретет» часть электронов.
Например, в результате некоторой реакции, атом натрия утратил один электрон. Обратимся к Периодической Системе, согласно которой узнаем, что в атоме натрия 11 электронов. Если один электрон покинет атом, их останется 10, тогда нарушится принцип электронейтральности атома и положительно заряженное ядро будет доминировать, то есть частица приобретет положительный заряд.
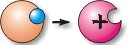 Na 0 – ē ® Na +
Na 0 – ē ® Na +
Частица Na+ и есть ион. Возможен и другой вариант, атом, в результате химической реакции, может присоединять электроны. В этом случае образуется избыток электронов и, следовательно, суммарный отрицательный заряд электронов больше, чем положительный заряд ядра. Такой ион будет заряжен отрицательно.


Молекулы
Из курса природоведения вам известно, что молекулы образуются из атомов посредством их взаимодействия в результате химических реакций. Например, молекула водорода Н2, образуется при взаимодействии двух атомов водорода.

Рисунок 74. Схема образования молекулы водорода

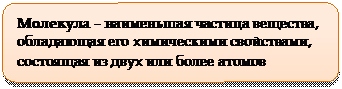
Подобно молекулам водорода образуются и другие молекулы, например: молекула азота N2, кислорода О2, хлора Cl2 и другие молекулы.
Конечно же, существуют и более сложные молекулы, состоящие из большего числа атомов. Например, сладкий вкус фруктам придает глюкоза. Модель ее молекулы изображена

 на рисунке 75.
на рисунке 75.
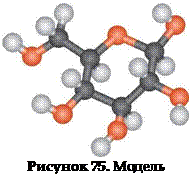 молекулы глюкозы
молекулы глюкозы
Существуют очень большие молекулы, в состав которых входят десятки, сотни и даже тысячи атомов! Например, молекулы белков, из которых
1. Определите сколько атомов водорода
(белые шарики), кислорода (красные шарики) и углерода (черные шарики) входит в состав молекулы глюкозы.
состоят все живые организмы, состоят из сотен и тысяч различных атомов!
Атомно-молекулярная теория
Процесс познания складывается таким образом, что блестящие догадки и великие теории, являвшиеся в свое время результатом гениального творчества, через более или менее продолжительное время становятся едва ли не тривиальными фактами, которые большинство людей принимает на веру. Многие ли из нас могли бы самостоятельно, на основе наблюдений и размышлений, догадаться, что Земля круглая, или что Земля вращается вокруг Солнца, а не наоборот, и наконец, что существуют атомы и молекулы? С высоты современной науки основные положения атомно-молекулярной теории выглядят всем известными положениями. Но для ученых прошлого, пытавшихся решить два основных вопроса: 1) из чего состоят
вещества? и 2) почему вещества бывают разными, и почему одни вещества могут превращаться в другие? на решение их ушло более 2000 лет. Результатом стала атомно- молекулярная теория, основные положения которой можно сформулировать следующим образом:
1. Все вещества состоят из молекул. Молекула – наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов. Атом – наименьшая частица элемента в химических соединениях. Разным элементам соответствуют разные атомы.
3. Молекулы и атомы находятся в непрерывном движении.
4. При химических реакциях молекулы одних веществ превращаются в молекулы других веществ. Атомы при химических реакциях не изменяются.
Подведем итоги

Вопросы, упражнения и задачи
Сформулируйте определения: элементарная частица, атом, ион, молекула, ядро, протон, нейтрон, электрон.
Перечислите элементарные частицы. Какими символами они обозначаются? Каковы заряды элементарных частиц?
Как определить количество электронов, протонов, нейтронов и заряд ядра в атоме?
Определите количество электронов, протонов, нейтронов, заряд ядра для атомов лития, углерода, фтора, магния, серы, титана, никеля, цинка, олова.
Вставьте пропущенные слова:
а) в состав ядра входят... и...; д) общее число нейтронов в ядре равно...;
б) заряд протона равен...; е) заряд нейтрона равен...;
в) масса протона равна...; ж) масса нейтрона равна.... г) общее число протонов в ядре равно... ядра и... элемента;
Назовите элементы с зарядом ядра +2, +5, +19, +15. Охарактеризуйте их положение в ПС.
Назовите элементы с общим числом электронов 10, 14, 26, 34 и охарактеризуйте их положение в ПС.
Опишите процесс образования ионов из атомов. Какие виды ионов вам известны?
Могут ли из ионов образовываться атомы? Приведите примеры.
Составьте схемы образования ионов из атомов: калия (потеря 1 электрона), серы (присоединение 2 электронов), кальция (потеря двух электронов), хлора (присоединение одного электрона), алюминия (потеря трех электронов), азота (потеря четырех электронов).
Заполните пропуски в таблице:
| Символ элемента | Название | № периода | № группы | Количество электронов | Количество протонов | Количество нейтронов | Заряд ядра |
| Si | |||||||
| Барий | |||||||
| 3 | 5 | ||||||
| 24 | |||||||
| 35 | |||||||
| 51 | 71 | ||||||
| +29 |
Определите количество электронов, содержащихся в 1 кг электронов.
Определите заряд частицы, если она содержит: а) ядро с зарядом +26 и 26 электронов; б) ядро с зарядом +8 и 10 электронов; в) ядро с зарядом +11 и 10 электронов; г) ядро с зарядом
+ 6 и 6 электронов; д) ядро с зарядом +9 и 10 электронов; е) ядро с зарядом +12 и 10 электронов.
Заполните таблицу
| Элемент | Нуклонное число А | Протонное число Z | Количество | ||
| протонов | электронов | нейтронов | |||
| Li | 6 | ||||
| О | 16 | ||||
| Mg | 25 | ||||
| Аr | 40 | ||||
| Ті | 49 | ||||
Сколько протонов и электронов содержится в ионах S2−, Н+, Аl3+, F⎺, Са2+?
Сколько протонов и электронов содержится в ионах Н⎺, Сl⎺, Na+, Ті4+, Mg2+?
Что является общим в электронном строении ионов углерода, азота, магния: С−4, N−3,
Mg+2? Ответ обоснуйте.
Приведите полное обозначение нуклида, который содержит: а) 18 электронов и 22 нейтронов; б) 30 электронов и 34 нейтронов; в) 25 электронов и 30 нейтронов.
Приведите полное обозначение нуклида, содержащего: а) 21 нейтрон и 38 других частиц; б) 44 нейтрона и 70 других частиц; в) 16 нейтронов и 30 других частиц.
Нуклиды элементов X, Y и Z обозначаются так: 18 Х, 33 Y, 40 Z. Назовите элементы X, Y и Z. Какой состав ядра атома каждого из нуклидов?


Солнца. Размеры же атомов (порядка 10−10 м) приблизительно в 100 тыс. раз превышают размеры ядра (порядка 10−15 м для лёгких ядер)! Если увеличить ядро до 1 мм (булавочная головка), то сам атом вырастет до 100 000 мм = 100 м (размер футбольного поля). Ещё разительнее сопоставление объёмов ядра и атома – получается разница в 15 порядков. Это означает, например, что практически вся масса огромного свинцового куба с ребром 100 м (она равна 11 млн. тонн) сосредоточена в ядрах атома свинца, суммарный объём которых меньше спичечной головки! Трудно даже представить себе, насколько высока плотность ядерного вещества.
37. Гелий, Helium, Не (2). ЕГО НАШЛИ НА СОЛНЦЕ
18 августа 1868 г. ожидалось полное солнечное затмение. Астрономы всего мира деятельно готовились к этому дню. Они надеялись разрешить тайну протуберанцев – светящихся выступов, видимых в момент полного солнечного затмения по краям солнечного диска. Одни астрономы полагали, что протуберанцы представляют собой высокие лунные горы, которые в момент полного солнечного затмения освещаются лучами Солнца; другие думали, что протуберанцы – это горы на самом Солнце; третьи видели в солнечных выступах огненные облака солнечной атмосферы. Большинство же считало, что протуберанцы – не больше, как оптический обман.
К 1860 г. был уже изобретен спектроскоп – прибор, дающий возможность путем наблюдений видимой части оптического спектра определять качественный состав тела, от которого получается наблюдаемый спектр. Вот почему, готовясь к солнечному затмению 1868 г., каждый астроном в список инструментов для наблюдения включил и спектроскоп. Не забыл этот прибор и Жюль Жансен, известный французский ученый, отправляясь для наблюдения протуберанцев в Индию, где условия для наблюдения солнечного затмения по вычислениям астрономов были наилучшими.
В момент, когда сверкающий диск Солнца был полностью закрыт Луной, Жюль Жансен, исследуя с помощью спектроскопа оранжево-красные языки пламени, вырывавшиеся с поверхности Солнца, увидел в спектре, кроме трех знакомых линий водорода: красной, зелено-голубой и синей, новую, незнакомую – ярко-желтую. Ни одно из веществ, известных химикам того времени, не имело такой линии в той части спектра, где ее обнаружил Жюль Жансен.
Такое же открытие, но у себя дома, в Англии, сделал астроном Норман Локиер.
25 октября 1868 г. парижская Академия наук получила два письма. Одно, написанное на следующий день после солнечного затмения, пришло из Гунтура, маленького городка на восточном побережье Индии, от Жюля Жансена; другое письмо, от 20 октября 1868 г., было из Англии от Нормана Локиера.
Полученные письма были зачитаны на заседании профессоров парижской Академии наук. В них Жюль Жансен и Норман Локиер, независимо один от другого, сообщили об открытии одного и того же «солнечного вещества». Это новое вещество, найденное на поверхности Солнца с помощью спектроскопа, Локиер предлагал назвать гелием от греческого слова «солнце» – «гелиос».
В 1895 г. лондонский химик Генри Майерс обратил внимание Вильяма Рамзая, известного английского физика-химика, на тогда уже забытую статью геолога Хильдебранда. В этой статье Хильдебранд утверждал, что некоторые редкие минералы при нагревании их в серной кислоте выделяют газ, не горящий и не поддерживающий горения. В числе таких редких минералов был клевеит.
Рамзай решил исследовать природу газа, содержащегося в клевеите. Во всех химических магазинах Лондона помощникам Рамзая удалось купить всего только... один грамм клевеита, заплатив за него всего 3,5 шиллинга. Выделив из полученного количества
клевеита несколько кубических сантиметров газа и очистив от примесей, Рамзай исследовал его с помощью спектроскопа. Результат был неожиданным: выделенный газ из клевеита оказался... гелием!
Не доверяя своему открытию, Рамзай обратился к Вильяму Круксу, крупнейшему в то время в Лондоне специалисту спектрального анализа, с просьбой исследовать выделенный из клевеита газ.
Крукс исследовал газ. Результат исследования подтвердил открытие Рамзая. Так, 23 марта 1895 г. на Земле было обнаружено вещество, 27 лет назад найденное на Солнце. В тот же день Рамзай опубликовал свое открытие, отправив одно сообщение в Лондонское Королевское общество, а другое – известному французскому химику академику Бертло. В письме к Бертло Рамзай просил сообщить о своем открытии ученому собранию профессоров парижской Академии.
Через 15 дней после Рамзая, независимо от него, шведский химик Ланглэ выделил гелий из клевеита и так же, как Рамзай, сообщил о своем открытии гелия химику Бертло.
В третий раз гелий был открыт в воздухе, куда, по мысли Рамзая, он должен был поступать из редких минералов (клевеита и др.) при разрушении и химических превращениях на земле.
В небольших количествах гелий был обнаружен и в воде некоторых минеральных источников. Однако больше всего было обнаружено гелия в некоторых минералах. Он содержится в самарските, фергусоните, колумбите, монаците, уранините. В минерале торианите с острова Цейлон содержится особенно много гелия. Килограмм торианита при нагревании докрасна выделяет 10 л гелия.
Вскоре было установлено, что гелий встречается только в тех минералах, в составе которых находятся радиоактивные уран и торий. Альфа-лучи, испускаемые некоторыми радиоактивными элементами, представляют собой не что иное, как ядра атомов гелия, которые, присоединяя электроны, превращаются в атомы гелия.
Гелий – прозрачный газ, без вкуса и запаха, следующий по величине атомного веса после водорода элемент. Он абсолютно инертен, т.е. не вступает ни в какие реакции. Из всех веществ гелий имеет самую низкую температуру кипения –269°С. Жидкий гелий – самая холодная жидкость. «Замерзает» гелий при –272°С. Эта температура всего на один градус выше температуры абсолютного нуля.
 Рисунок 76. Символ элемента, выполненный из газоразрядных трубок, наполненных гелием.
Рисунок 76. Символ элемента, выполненный из газоразрядных трубок, наполненных гелием.
Рисунок 77. Два сосуда Дьюара по 250 л с жидким гелием
Рисунок 78. Сжиженный гелий. Этот гелий – не только сжижен, он охлажден до точки сверхтекучести. Капля жидкости на дне стакана представляет собой гелий, самопроизвольно вытекающий из контейнера через край

§12. Простые и сложные вещества
Простые вещества и их классификация
При изучении материала предыдущих параграфов, вы уже познакомились с некоторыми веществами. Так, например, молекула газа водорода, состоит из двух атомов химического элемента водорода – Н + Н = Н2.


К простым веществам, из числа известных вам веществ, относят: кислород, графит, серу, азот, все металлы: железо, медь, алюминий, золото и т.д. Сера состоит только из атомов химического элемента серы, а графит состоит из атомов химического элемента углерода.

 Нужно четко различать понятия
Нужно четко различать понятия
«химический элемент» и «простое вещество». Например, алмаз и углерод – не
одно и тоже. Углерод – химический элемент, а алмаз – простое вещество, образованное
химическим элементов углеродом. В данном случае химический элемент (углерод) и простое вещество (алмаз) называются по-разному. Часто химический элемент и отвечающее ему простое вещество называются одинаково. Например, элементу кислороду, соответствует простое вещество – кислород. Различать, где идет речь об элементе, а где о веществе, необходимо научиться! Например, когда говорят, что кислород входит в состав воды – речь идет об элементе кислороде. Когда говорят, что кислород – это газ, необходимый для дыхания
– здесь идет речь о простом веществе кислороде.
Простые вещества химических элементов подразделяют на две группы – металлы и неметаллы.

Металлы и неметаллы кардинально отличаются по своим физическим свойствам. Все металлы при нормальных условиях твердые вещества, исключение составляет ртуть – единственный жидкий металл. Металлы непрозрачны, обладают характерным металлическим блеском. Металлы пластичны, хорошо проводят тепло и электрический ток.



| |||||||



| |||||||
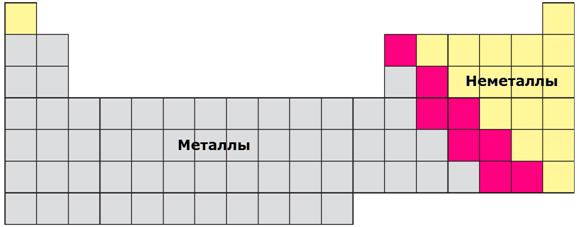
Рисунок 81. Размещение металлов и неметаллов в Периодической Системе: серым цветом обозначены металлы, желтым – неметаллы,
красным – элементы, проявляющие свойства и металлов и неметаллов
Сложные вещества и их классификация

 Если в состав простых веществ входят атомы только одного вида, несложно догадаться, что в состав сложных веществ будут входить несколько видов различных атомов, как минимум двух. Примером сложного вещества является вода, ее химическая формула вам известна – Н2О. Молекулы воды состоят из двух видов атомов: водорода и кислорода.
Если в состав простых веществ входят атомы только одного вида, несложно догадаться, что в состав сложных веществ будут входить несколько видов различных атомов, как минимум двух. Примером сложного вещества является вода, ее химическая формула вам известна – Н2О. Молекулы воды состоят из двух видов атомов: водорода и кислорода.
Сложные вещества – вещества, в состав которых входят атомы различных видов
Проведем следующий эксперимент. Смешаем порошки серы и цинка. Поместим смесь на металлический лист и подожжем при помощи деревянной лучины. Смесь загорается и быстро сгорает
2. Вспомните, что называют химическим явлением (реакцией)?
ярким пламенем. После завершения химической реакции образовалось новое вещество, в состав которого входят атомы серы и цинка. Свойства этого вещества совершенно другие, нежели свойства исходных веществ – серы и цинка.








