Составьте химические формулы веществ, в состав которых могут входить такие ионы:
Na+, Ba2+, Cl⎺, CO3
, OH⎺.
2−
Охарактеризуйте качественный и количественный состав следующих веществ:
1) молекулярные вещества – озон O3; глюкоза – С6Н12О6; природный газ – метан – СН4;
2) атомные вещества – оксид бора B2O3; оксид кремния (кварц) – SiO2;
3) ионные вещества – морская соль Na2SO4; известь – Сa(OH)2; мел – СaCO3.
Назовите число частиц (атомов или молекул), химические формулы которых записаны в виде: 3О; О3; 2Н; Н2; 3H2О2; H2SО4; 5H2SО4.
Назовите, какие атомы и в каком количестве содержатся в молекулах: 2СО2, 3H2S, 3S8, 10С2Н6О.
Составьте формульные единицы веществ, в состав которых входят ионы: Ca2+ и Br⎺; Pb2+ и SO42−; Zn2+ и NO3⎺; Fe3+ и PO43−; Ba2+ и PO43−; Cr3+ и NO3⎺; Al3+ и SO42−; Sn2+ и S2−.
Найдите соотношение ионов K+, Cr3+, S2−, NO3⎺ в каждом из соединений: K2S, KNO3,
Cr2S3, Cr(NO3)3.
Найдите соотношение ионов Na+, Al3+, SO42−, PO43− в каждом из соединений: Na2SO4, Na3PO4, Al2(SO4)3, AlPO4.
 Блокнот эрудита
Блокнот эрудита
42. Дальтониды и бертоллиды
Дальтониды и бертоллиды – термины, введённые для обозначения химических соединений постоянного состава (дальтониды) и переменного состава (бертоллиды). Термин
«дальтониды» предложен в память Дж. Дальтона, а термин «бертоллиды» – в память К.Л. Бертолле. Молекулярные химические соединения являются дальтонидами – их состав удовлетворяет закону постоянства состава.
Бертоллиды – соединения переменного состава, не подчиняющиеся закону постоянства состава. Состав бертоллидов зависит от способа получения. Многочисленные случаи образования бертоллидов открыты в сплавах металлов, а также среди различных химических веществ немолекулярного строения. Например, вещество оксид ванадия VO, может иметь в зависимости от условий получения состав от V0,9 до V1,3, оксид марганца имеет переменный состав MnO1,6.
43. КЛОД ЛУИ БЕРТОЛЛЕ (1748–1822)
Французский химик Клод Луи Бертолле был практикующим врачом и аптекарем, лейб-медиком при дворе герцога Орлеанского. Одновременно занимался изучением естественных наук и исследованиями в области химии, организацией химических и металлургических производств. С 1780 г. Бертолле – член Парижской Академии наук. В 1794 г. он стал профессором Высшей нормальной и Политехнической школ в Париже.
В период Революции и Империи Бертолле много занимался вопросами, связанными с национальной обороной, а также
Рисунок 89. Клод Луи Бертолле (1748–1822)
прикладной химией (например, крашением ткани). Он впервые применил хлор для отбеливания бумаги и тканей. Бертолле был
научным консультантом Наполеона Бонапарта.
Основные исследования Бертолле относятся к неорганической химии, химии растворов и сплавов. Он становил состав аммиака, болотного газа, синильной кислоты, сероводорода.
Открыл соли хлорноватистой и хлорноватой кислот, в частности, хлорат калия («бертолетова соль»); открыл нитрид серебра («гремучее серебро»). В 1786–1787 гг. Бертолле вместе с А.Л. Лавуазье, Л.Б. Гитоном де Морво и А.Ф. Фуркруа разработал новую химическую номенклатуру и классификацию тел.
На основании наблюдений за процессами выпадения осадков из растворов Бертолле пришёл к выводу о зависимости направления реакций и состава образующихся соединений от массы реагентов и условий протекания реакций. Эти взгляды он высказал в своем «Опыте химической статики» (1803), в котором утверждал, что элементы могут соединяться друг с другом в любых пропорциях в зависимости от массы реагирующих веществ.
По вопросу о непостоянстве состава соединений и изменчивости сил химического сродства Бертолле вёл длительную полемику с Ж. Л. Прустом (1801–1808).
В начале XIX в. дискуссия завершилась в пользу Пруста и закон постоянства состава получил признание большинства химиков. Однако в начале XX в. Н.С. Курнаков открыл существование предвиденных Бертолле химических индивидуальных веществ переменного состава, которые в память Бертолле назвал бертоллидами. Это открытие разрешило противоречие между казавшимися несовместимыми взглядами Бертолле и Пруста.
44. ДЖОН ДАЛЬТОН (1766–1844)
Английский физик и химик Джон Дальтон родился в деревне Иглсфилд в Камбеоленде в семье ткача. Образование он получил самостоятельно, если не считать уроков по математике, которые он брал у слепого учителя Дж. Гауфа. В 1781–1793 гг. Дальтон преподавал математику в школе в Кендале, с 1793 г. – физику и математику в Нью-колледже в Манчестере. Научная работа Дальтона началась с 1787 г. с наблюдений над воздухом. В течение последующих 57 лет он вел метеорологический дневник, в котором записал более 200 000 наблюдений.
В 1793 г. Дальтон опубликовал свой первый труд –
Рисунок 90. Джон
Дальтон (1766–1844)
«Метеорологические наблюдения и этюды», в котором содержатся зачатки его будущих открытий. Стремясь понять, почему газы в
 атмосфере составляют смесь с определенными физическими свойствами, а не располагаются друг над другом слоями в соответствии со своими плотностями, он установил, что поведение газа не зависит от состава смеси.
атмосфере составляют смесь с определенными физическими свойствами, а не располагаются друг над другом слоями в соответствии со своими плотностями, он установил, что поведение газа не зависит от состава смеси.
Дальтон сформулировал закон парциальных давлений газов, а также обнаружил зависимость растворимости газов от их парциального давления. В 1802 г. Дальтон самостоятельно, независимо от Ж.Л. Гей-Люссака и Ж. Шарля, открыл один из газовых законов: при постоянном давлении с повышением температуры все газы расширяются одинаково.
Изучая составы химических соединений, Дальтон установил, что в различных соединениях двух элементов на одно и то же количество одного элемента приходятся количества другого, относящиеся между собой как простые целые числа (закон кратных отношений). Открытые законы Дальтон пытался объяснить с помощью развиваемых им же атомистических представлений. В качестве важнейшего свойства атома Дальтон ввёл понятие атомного веса. Приняв за единицу атомный вес водорода, Дальтон рассчитал атомные веса ряда элементов и составил первую таблицу относительных атомных масс (1803).
Химические реакции Дальтон рассматривал как связанные друг с другом процессы соединения и разъединения атомов, ибо только этим можно было объяснить скачкообразные изменения состава при превращении одного соединения в другое. Поэтому каждый атом любого элемента должен, кроме определенной массы, обладать специфическими свойствами и быть неделимым с химической точи зрения.
Сделанные Дальтоном расчёты атомных масс были неточны, поскольку он не делал различия между атомами и молекулами, называя последние сложными атомами. Тем не менее, именно благодаря Дальтону атомистика получила новое естественнонаучное обоснование; работы Дальтона стали важнейшей вехой в становлении химической науки. В 1804 г. Дальтон предложил также систему химических знаков для «простых» и «сложных» атомов.
45.  ЖОЗЕФ ЛУИ ПРУСТ (1754–1826)
ЖОЗЕФ ЛУИ ПРУСТ (1754–1826)
Французский химик Жозеф Луи Пруст родился в небольшом городке Анжере в семье аптекаря. Получив химическое образование в Парижском университете, в 1775 г. он был назначен на должность управляющего аптекой больницы Сальпетриер. В 1777 г. Пруст получил приглашение на кафедру химии и металлургии недавно основанной Королевской семинарии в Вергаре (Испания), где работал до 1780 г. В 1785 г. король Испании Карл III пригласил Пруста на должность профессора химии Артиллерийской школы в Сеговии. В дальнейшем Пруст руководил кафедрами химии в университете Саламанки (1789), а затем Мадрида (1791–1808).
Рисунок 91. Жозеф
Луи Пруст (1754–1826)
Благодаря значительной финансовой поддержке короля Пруст организовал в Мадриде очень хорошо оснащённую
лабораторию, собрал ценные коллекции минералов и реактивов.
В 1808 г., в период вторжения войск Наполеона в Испанию и подавления вспыхнувшего в стране народного восстания, лаборатория Пруста и его коллекции погибли. Пруст, который в это время находился во Франции, решил остаться там. В 1816 г. учёный был избран членом Парижской академии наук.
Самым выдающимся научным достижением Пруста стало открытие закона постоянства состава. В Испании Пруст занимался исследованием свойств и состава соединений различных металлов – олова, меди, железа, никеля и др. Он доказал, что при определении состава оксидов металлов многие его современники допускали ошибки, считая гидроксиды оксидами. Пруст показал также, что различные оксиды одного и того же металла имеют вполне определённый состав, который меняется скачкообразно. Исследование состава различных оксидов металлов, а также их хлоридов и сульфидов, выполненное в 1797–1809 гг., послужило основой для открытия им закона постоянных отношений. Пруст сформулировал его так: «Всегда неизменные отношения, эти постоянные признаки, характеризующие истинные соединения, как искусственно полученные, так и природные; одним словом, это постоянство природы, так хорошо виденное Шталем, всё это, я утверждаю, подвластно химику не более, чем закон избирательности <сродства>, который управляет всеми реакциями соединения».
Оппонентом Пруста в возникшей дискуссии о постоянстве состава химических соединений выступил его соотечественник – известный химик Клод Луи Бертолле. Полемику двух учёных, продолжавшуюся с 1801 по 1808 г., выдающийся французский химик Жан Батист Дюма позже охарактеризовал так: «...начался между этими двумя великими противниками, столь достойными помериться силами, длительный научный спор, замечательный как талантом, так и хорошим вкусом его участников. И по форме и по содержанию это один из прекраснейших образцов научной дискуссии».
Благодаря тому, что измерения Пруста были исключительно точными для своего времени, дискуссия закончилась в пользу Пруста и закон постоянства состава получил признание большинства химиков, став одним из краеугольных камней химической теории периода классической химии.
§14. Валентность

Валентность

 До сих пор вы пользовались химическими формулами веществ, приведенными в учебнике, или теми, которые
До сих пор вы пользовались химическими формулами веществ, приведенными в учебнике, или теми, которые
вам называл учитель. Как же правильно составлять химические формулы?
Химические формулы веществ составляются на основе знания качественного и количественного состава вещества. Веществ существует гигантское количество, естественно запомнить все формулы невозможно. Это и не нужно! Важно знать определенную закономерность, согласно которой атомы способны соединяться друг с другом с образованием новых химических соединений. Такая способность называется валентностью.


 газ.
газ.
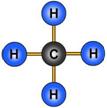
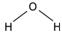
Рассмотрим модели молекул некоторых веществ, таких, как вода, метан и углекислый
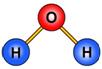
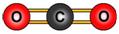
| Вода | Метан | Оксид углерода (II) |
| Рисунок 92. Модели некоторых молекул | ||
Видно, что в молекуле воды атом кислорода присоединяет два атома водорода.
Следовательно, его валентность равна двум. В молекуле метана атом углерода присоединяет четыре атома водорода, его валентность в данном веществе равна четырем. Валентность водорода в обоих случаях равна одному. Такую же валентность углерод проявляет и в углекислом газе, но в отличие от метана, атом углерода присоединяет два атома кислорода, так как валентность кислорода равна двум.
Существуют элементы, валентность которых не меняется в соединениях. О таких элементах говорят, что они обладают постоянной валентностью. Если же валентность элемента может быть различной – это элементы с переменной валентностью. Валентность некоторых химических элементов приведена в таблице 2. Валентность принято обозначать римскими числами.
Таблица 2. Валентность некоторых химических элементов
| Символ элемента | Валентность | Символ элемента | Валентность |
| H, Li, Na, K, F, Ag | I | C, Si, Sn, Pb | II, IV |
| Be, Mg, Ca, Ba, Zn, O | II | N | I, II, III, IV |
| Al, B | III | P, As, Sb | III, V |
| S | II, IV, VI | Cl | I, II,III, IV,V, VII |
| Br, I | I, III, V | Ti | II, III, IV |
| Символ элемента | Валентность | Символ элемента | Валентность |
| Cu, Hg | I, II | Mn | II, III, IV, VI, VII |
| Fe, Co, Ni | II, III | Cr | II, III, VI |
| Au | I, II, III | Os | II, III, IV, VI, VIII |
 Стоит отметить, что высшая валентность элемента численно совпадает с порядковым
Стоит отметить, что высшая валентность элемента численно совпадает с порядковым 
номером группы Периодической Системы, в которой он находится. Например, углерод находиться в IV группе, его высшая валентность равна IV.
Исключение составляют три элемента:
· азот – находится в V группе, но его высшая валентность IV;
· кислород – находится в VI группе, но его высшая валентность II;
· фтор – находится в VII группе, но его высшая валентность – I.
Исходя из того, что все элементы расположены в восьми группах Периодической Системы, валентность может принимать значения от I до VIII.
Составление формул веществ при помощи валентности
Для составления формул веществ при помощи валентности воспользуемся определенным алгоритмом:
| Алгоритм | Пример |
| 1. Записать химические формулы элементов | P O |
| 2. Вверху, над символами элементов записать значение их валентности. Для элементов с переменной валентностью конкретная валентность указана в условии | V II P O |
| 3. Найти наименьшее общее кратное (НОК) значений валентности, записать его вверху | 10
 V II
P O
V II
P O
|
| 4. Поделить НОК на значения валентностей элементов – это индексы, выражающие число атомов | 10: V = 2 (P) 10: II = 5 (O) P 2 O 5 |
Определение валентности по формуле вещества
Чтобы определить валентность элементов по формуле вещества, необходим обратный порядок действий. Рассмотрим его также при помощи алгоритма:
| Алгоритм | Пример |
| 1. Записать формулу вещества | Сl 2 O |
| 2. Указать известную валентность элемента (для элементов с постоянной валентностью) | II Cl 2 O |
| 3. Найти наименьшее общее кратное (НОК) валентности и индекса элемента | 2
 II
Cl 2 O 1
II
Cl 2 O 1
|
| 4. Поделить значение НОК на индекс элемента, валентность которого неизвестна | 2: 2 = 1 I II Cl 2 O |
При изучении данного параграфа были рассмотрены сложные вещества, в состав которых входят только два вида атомов химических элементов. Формулы более сложных веществ составляются иначе.


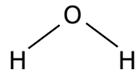
Для определения порядка последовательности соединения атомов используют структурные (графические) формулы веществ. В таких формулах валентности элементов обозначают валентными штрихами (черточками). Например, молекулу воды можно изобразить как
Н─О─Н
Графическая формула изображает только порядок соединения атомов, но не структуру молекул. В пространстве такие молекулы могут выглядеть иначе. Так, молекула воды имеет угловую структурную формулу:
Подведем итоги

Вопросы, упражнения и задачи
Что такое валентность? Каково минимальное и максимальное значение валентности для химического элемента.
Приведите примеры разных химических элементов, указав их минимальную и максимальную валентность.
Какие соединения называют бинарными?
Группу химических элементов: гелий, неон, аргон, криптон, ксенон, радон, называют инертными газами. Значение их валентности можно принять равным нулю. Объясните, что это значит.
Укажите символы химических элементов, имеющих переменную валентность: Ba, Fe, F, O, Cu, Pb, Zn, Ni, Au, N, H, Li, Br.
Определите валентность элементов в следующих соединениях: NH3, ZnO, Al2O3, KBr, OsO4, TiO2, Na2O, I2O5, CrO3, Ca3P2, Na3N, Mn2O7, BaH2, PbO2, Au2O3, PH3.
Составьте формулы соединений, образованных химическими элементами с постоянной валентностью: калием и водородом; магнием и кислородом; алюминием и кислородом; кальцием и фтором; бором и кислородом, бором и водородом, барием и фтором.
Составьте формулы соединений, в состав которых входит кислород (запишите его в формуле на втором месте) и такие химические элементы: N (II), As (V), Cr (III), Li, Cu (I), S (VI), Si (IV), Ni (II), B.
Составьте формулы соединений при помощи значений валентности элементов, которые входят в их состав: а) Cu (II) и S (II); б) Si (IV) и Cl (I); в) W (VI) и О; г) C (IV) и S (II); д) Al и P (III); е) Cr (III) и Br (I); ж) S(VI) и F; з) P (III) и Cl (I); и) Al и S (II).
Определите валентности элементов в соединениях с хлором (он проявляет валентность I): AgCl, FeCl2, AsCl3, ТіСl4, SbCl5, UCl6.
Определите валентности элементов в соединениях с серой (проявляет валентность II): Cu2S, CoS, Bi2S3, SnS2, As2S5, MoS3, Re2S7.
Определите валентность азота в его соединениях: a) N2O; б) NO; в) N2O3; г) NO2; д) N2O5.
Определите валентность ванадия в его соединениях: VCl2, VCl3, VCl4, V2O5, VO2, V2O3, VO.
Напишите формулы соединений с кислородом следующих элементов: а) меди (проявляет валентности I и II);
б) железа (проявляет валентности II и III); в) кремния (проявляет валентность IV);
г) фосфора (проявляет валентности III и V); д) хрома (проявляет валентности II, III и VI); е) осмия (проявляет валентности IV и VIII).
Составьте формулы соединений неметаллов с кислородом (оксидов):
| IV II | VI II | III II | V II | II II | IV II | ||||||||
| a) | S O | б) | S O | в) | P O | г) | P O | д) | C O | е) | C O | ||
| 14.16. Составьте формулы по валентности: | |||||||||||||
| II | III | III | I | II I | I | IV | IV | ||||||
| a) Na S | Ca P | Ba N | Al Cl | б) | Pb I | Zn Br | Al C | Ca Si | |||||
Составьте формулы водородных соединений неметаллов, если валентность неметалла минимальна: a) HF; б) НСl; в) HS; г) ВН; д) HO; е) HI; ж) НВr.
Зная, что в соединениях с металлами сера и хлор проявляют свою минимальную валентность, определите валентность металлов: a) FeCl3; б) Cu2S; в) FeCl2; г) PbS; д) МnСl2; е) СrСl3.
Определите валентности элементов в соединениях, формулы которых SiH4 и MgCl2. Составьте формулы соединения магния с кремния и соединения водорода с хлором, если валентности элементов в них такие же, как и в соединениях SiH4 и MgCl2.
Определите валентности элементов в соединениях, формулы которых АlВr3 и СН4. Составьте формулы соединений алюминия с углеродом и водорода с бромом, если валентности элементов в них такие же, как и в соединениях АlВr3 и СН4.


















|



| |||||||||||||||||||||||||||||||
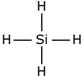
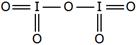
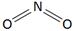
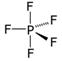
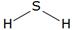
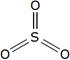
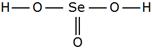
Определите валентность элементов в следующих соединениях и изобразите их графические формулы: PH3, SO2, Cl2O, HF, PCl5.
При составлении формул по валентности были допущены ошибки. Исправьте их.
|
В свободное время изготовьте модели молекул веществ. В качестве материала для изготовления моделей можно использовать пластилиновые шарики и зубочистки, или спички.
 Блокнот эрудита
Блокнот эрудита
46. Что такое валентность
Понятие валентности в химии долго считалось одним из основных. «Валентность – фундаментальное свойство атома, – писал более века назад знаменитый немецкий учёный, один из создателей теории химического строения Фридрих Кекуле, – свойство такое же постоянное и неизменяемое, как и самый атомный вес». Однако в современной научной литературе этот термин употребляется не очень широко.
Впервые идею об определённой «ёмкости насыщения» атомов металлов и кислорода высказал в 1853 г. английский химик Эдуард Франкленд (1825–1899). К концу 50-х гг. XIX в. большинство химиков признавали, что валентность (тогда говорили «атомность») углерода равна четырём, кислорода и серы – двум, фтора и хлора – единице. Сам термин
«валентность», предложенный в 1868 г. берлинским профессором Карлом Вихельхаусом (1842–1927), был взят из латыни (от лат. valentia – «сила»), однако длительное время почти не употреблялся. В классическом труде «Основы химии» Д.И. Менделеев лишь несколько раз использует как синоним валентности понятие «атомность», не останавливаясь на нём детально и не давая однозначного определения.
И это не случайно. «Ни одно понятие в химии не получало такого количества неясных и неточных определений, как понятие валентности», – писал в 1917 г. американский педагог Александр Смит. Вначале химики ошибочно полагали, что каждый элемент имеет одну валентность. Это неминуемо приводило к искажению химических формул, которые просто






