Химия
Класс
Учебное пособие для обучающихся основной школы
Донецк -2017
УДК 54(073)
ББК 54.262.4
Рекомендовано Министерством образования и науки Донецкой Народной Республики (приказ № 823 от 11.08.2017 г.)
Составители:
Дробышев Е.Ю., учитель химии Макеевской общеобразовательной школы I-III ступеней №4; Козлова Т.Л., заместитель директора по научной работе Государственного бюджетного нетипового общеобразовательного учреждения «Республиканский лицей-интернат «Эрудит» - центр для одаренных детей» Министерства образования и науки Донецкой Народной
Республики;
Голубничая М.С., учитель химии Муницупального общеобразовательного учреждения
«Донецкая специализированная школа с углубленным изучением гуманитарных дисциплин №18 города Донецка»
Общая редакция:
Полякова Л.П., министр образования и науки Донецкой Народной Республики, доктор наук по государственному управлению, профессор, член-корреспондент Российской академии естествознания
Чернышев А.И., ректор ГОУ ДПО «Донецкий РИДПО», кандидат педагогических наук, доцент, академик Международной академии наук педагогического образования
Рецензенты:
Игнатов А.В., кандидат химических наук, доцент кафедры неорганической химии Донецкого национального университета;
Столбцова Н.В., учитель химии Харцызской общеобразовательной школы I-III ступеней
№25 «Интеллект» с углубленным изучением отдельных предметов, учитель высшей категории, учитель-методист;
Кириченко В.Г., заместитель директора методического центра управления образования администрации г.Макеевки, учитель химии высшей категории
Консультанты:
Симонова И.В., заместитель министра образования и науки Донецкой Народной Республики
Зарицкая В.Г., проректор по научно-педагогической работе ГОУ ДПО «Донецкий РИДПО», кандидат филологических наук, доцент
Х75 Химия: 7 класс: учебное пособие / Дробышев Е.Ю., Козлова Т.Л., Голубничая М.С. – 2-е изд. – Донецк: Истоки, 2017. – 238 с.
Учебное пособие содержит весь теоретический материал, предусмотренный действующей программой по химии для 7 класса, указания к проведению практических работ, лабораторных опытов и домашних экспериментов.
К каждому параграфу предложены выводы, вопросы для контроля знаний, упражнения и задачи для усвоения материала. Теоретический материал дополнен рубрикой «Блокнот эрудита» с дополнительной интересной информацией: захватывающими фактами из истории химии, сведениями о выдающихся ученых и интересными задачами, которые помогут запомнить изучаемый материал. В конце учебника представлены алфавитный указатель, приложение с полезной информацией и ответы к расчетным задачам.
Учебное пособие предназначено для учащихся 7 классов общеобразовательных организаций.
© ГОУ ДПО «Донецкий РИДПО», 2017
Уважаемые семиклассники!
В этом учебном году вы начинаете изучать очень интересную науку химию.
Химики создают новые материалы различного назначения, лекарства, косметические средства, совершенствуют производство металлов и удобрений, переработку металлических руд, нефти, газа, промышленных и бытовых отходов. Человечество использует достижения химии для улучшения условий жизни, сохранения природы для будущих поколений. В наше время ни один человек не может обойтись без знаний, которые дает эта наука.
Химия – достаточно сложная наука, но она охотно раскрывает свои тайны всем, кто интересуется ею и стремится понять, что такое вещество, как и почему одни вещества превращаются в другие. Эта наука имеет свои законы, логику, язык.
Каждый из вас научится наблюдать за веществами во время химических опытов, сопоставлять увиденное и услышанное с прочитанным в учебнике, анализировать и делать выводы. Химия поможет вам расширить кругозор, развить навыки проведения опытов. Знания, полученные на уроках химии, пригодятся вам в жизни.
Химию нужно изучать системно и последовательно, с большим вниманием. В первую очередь необходимо усвоить основные законы и основные химические понятия, которые станут основой ваших знаний по химии.
Для того чтобы успешно усваивать химические знания, вам необходимо:
1. Быть собранным и внимательным на уроке, стараться понять учебный материал и разобраться в нем.
2. Перед выполнением домашнего задания внимательно прочитать материал учебного пособия, записи, сделанные на уроке. При необходимости активно используйте дополнительные источники информации, материалы из сети Интернет.
3. Внимательно всматривайтесь в окружающий вас мир, вдумывайтесь в процессы, которые в нем происходят, старайтесь исследовать вещества и понять, как устроен мир.
Запомните! Любую книгу по химии, в том числе и учебное пособие, необходимо внимательно и вдумчиво читать. Необходимо учиться анализировать содержимое параграфов и выделять из них наиболее важную информацию. Усвоение и запоминание учебного материала является эффективным, если придерживаться определенной системы при его изучении.
Как пользоваться учебным пособием
В начале каждого параграфа указано, какие основные темы будут в нем рассмотрены, в конце параграфа сформулированы выводы. Вопросы, на которые нужно ответить при изучении материала параграфа, расположены в тексте в синей рамке.
Чтобы помочь вам в работе с учебным пособием, основные определения, термины и понятия вынесены в оранжевые рамки и отмечены восклицательным знаком.
Дополнительная информация и интересные факты размещены после параграфа в блокноте эрудита. Следует отметить, что данная информация не является обязательной к изучению. Однако факты и информация, размещенные в конце параграфов, позволят вам расширить свой химический кругозор, и, тем самым, повысить свой уровень учебных достижений по предмету. Так же в конце учебного пособия приведен перечень занимательных опытов, которые вы можете провести дома в присутствии родителей или вместе с учителем химии.
После каждого параграфа приведены задания, упражнения и задачи, которые расположены, в основном, по возрастанию сложности. Чтобы убедиться в качестве своих знаний старайтесь ответить на все вопросы, выполнить все упражнения, решить все задачи, приведенные в конце параграфов.
В конце учебного пособия размещены ответы к некоторым задачам и упражнениям, предметный указатель. Он поможет быстро найти страницу учебника, на которой идет речь об определенном термине, веществе, явлении и т.п. Вам в помощь приведена справочная таблица, в которой описаны основные физические свойства некоторых простых и сложных веществ.
Мы стремились создать такое учебное пособие, по которому вам будет легко и интересно учиться. Надеемся, вы полюбите химию. Искренне желаем вам успехов!
§1. Предмет химии. Вещества

Вещества и тела
Окружающий нас мир состоит из множества разнообразных объектов, которые называют физическими телами. Всё то, из чего состоят физические тела, называют веществом.
Что же такое вещество, и чем оно отличается от физического тела? Из курса природоведения вам должны быть знакомы эти понятия и различия между ними. Рассмотрим процесс фотосинтеза, протекающий в растениях. Растение поглощает воду, минеральные удобрения, углекислый газ из воздуха. В результате фотосинтеза в атмосферу выделяется кислород, а в листьях растения накапливается глюкоза, которая является своего рода «пищей» для растения. И кислород, и глюкоза являются веществами! Немного поразмыслив можно прийти к выводу, что в нашем мире абсолютно все состоит из разнообразных веществ и их смесей.
На сегодняшний день количество химических веществ, известных человеку, уже составляет более 100 000 000. И это число непрерывно растет!
Что же изучает химия, о чем эта наука?


Рассмотрим рисунок 1, на котором изображены физические тела:



Рисунок 1. Физические тела
 Из каких веществ состоят тела, изображенные на рисунке? Очевидно, что ложка изготовлена из вещества – металла. Стаканы – из пластика. Для изготовления колеса были использованы два вещества – резина и металл.
Из каких веществ состоят тела, изображенные на рисунке? Очевидно, что ложка изготовлена из вещества – металла. Стаканы – из пластика. Для изготовления колеса были использованы два вещества – резина и металл.


 Стоит четко различать между собой вещества, тела, которые они образуют, а так же природные явления. Рассмотрим рисунки 2–4 и сделаем соответствующие выводы.
Стоит четко различать между собой вещества, тела, которые они образуют, а так же природные явления. Рассмотрим рисунки 2–4 и сделаем соответствующие выводы.



Рисунок 2 Рисунок 3 Рисунок 4
На рисунке 2 изображена вода, это – вещество. На рисунке 3 – кусочки льда, это – тело, оно имеет четкую форму и размеры. Данное тело состоит из вещества – воды. На рисунке 4 – изображено природное явление – дождь.
Вещества, используемые для изготовления предметов, оборудования, в промышленности и быту, называют материалами.


Первыми материалами, с которыми имел дело человек, были камень, глина, древесина. Со временем люди научились выплавлять металл, делать стекло, изготавливать кирпич, известь, цемент, пластмассы, резину и т.п.
Очень важной наукой является химическое материаловедение. Основная цель материаловедов – получение материалов с заданными свойствами, а основной метод – использование зависимости состава, структуры и свойств материала от способа получения.
Какой бывает химия?
Достоверно неизвестно откуда и когда появился термин «химия». По одной из версий термин «химия» произошел от египетского слова «хем» – арабского названия этой страны. Таким образом, дословно «химия» переводится как египетская наука.
Это же слово означало «черный» – видимо, по цвету почвы в долине реки Нил, протекающей по территории Египта. «Кем», или «Хем» (Khemia – «Черная страна», «страна с черной землей») – так называли в древней Греции Египет. В таком варианте слово «химия» переводится как «черная наука» или «наука черной земли».
Вторая версия выводит слово «химия» из греческого χυμος («хюмос»), которое можно перевести как «сок растения». Этот термин встречается в рукописях, содержащих сведения по медицине и фармакологии.
Согласно же третьей версии, слово «химия» происходит от другого греческого слова – χυμα («хюма»), означающего «литье», «сплав». В таком случае «химия» – это искусство литья выплавки металлов, то есть металлургии.
Термин «химия» впервые употребил греческий алхимик Зосима Панополитанский в V веке н. э. Он использовал этот термин в смысле «настаивание», «наливание». Современное слово для обозначения науки химии произошло от позднелатинского chimia и является интернациональным: например, в английском языке – chemistry, в немецком – Chemie, французском – chimie. В русском языке этот термин появился в эпоху Петра I.
Современная химическая наука развивается стремительно и активно. Постоянно открываются новые, ранее неизвестные вещества, с разнообразными интересными свойствами. В наши дни химию принято делить на отдельные химические области. Рассмотрим самые главные «ветви» химической науки:
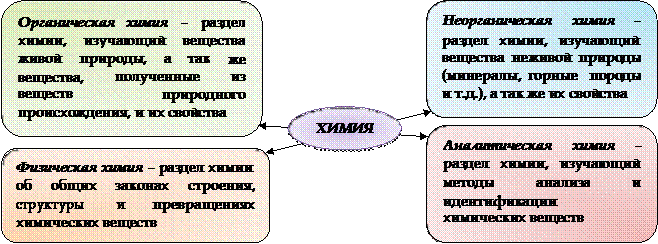

 В современном мире успешно развиваются и другие химические науки, например: космохимия, компьютерная химия, биохимия, химия
В современном мире успешно развиваются и другие химические науки, например: космохимия, компьютерная химия, биохимия, химия
сверхнизких температур и т.п.
Основные задачи химии
Какие же задачи сегодня стоят перед химической наукой и химиками? Наиболее важной задачей является получение новых веществ, с полезными для человечества свойствами. Например, сегодня не существует лекарств от многих болезней, и химики работают над созданием препаратов от таких болезней как сахарный диабет, грипп, онкологические заболевания.
 Человечество пока не может покорять другие планеты, но со временем, при изобретении более совершенных средств передвижения в пространстве, это станет возможным, здесь так же не обойдется без химии, ведь для создания космических кораблей
Человечество пока не может покорять другие планеты, но со временем, при изобретении более совершенных средств передвижения в пространстве, это станет возможным, здесь так же не обойдется без химии, ведь для создания космических кораблей
необходимо множество химических веществ и материалов. 
Десятилетиями человечество использовало ресурсы планеты не очень эффективно. Результатом этого стало существенное загрязнение окружающей среды. Кроме того,
возникла проблема нехватки природных ресурсов. Сегодня химики пытаются решить эти проблемы: сделать промышленные производства безопасными для окружающей среды, и создать альтернативу невозобновляемым природным ресурсам. Одним из решений данной проблемы является безотходное химическое производство.
За относительно небольшой промежуток времени человечество изучило свойства множества веществ и создало на их основе множество материалов. Нельзя однозначно сказать, какие вещества полезны, а какие вредны. Важно лишь то, с какой целью и как эти вещества будут использоваться: для пользы, или во вред человечеству, природе и нашей планете.
 Подведем итоги
Подведем итоги
· Химия – наука о веществах, их свойствах и превращениях
· Вещество – совокупность атомов, молекул или других частиц, находящихся в определенном агрегатном состоянии
· Физическое тело – материальный объект, имеющий постоянные массу, форму, а так же соответствующий ей объем и отделенный от других тел
· Современное слово для обозначения науки химии произошло от позднелатинского chimia и является интернациональным: например, в английском языке – chemistry, в немецком – Chemie, французском – chimie

Вопросы, упражнения и задачи
Сформулируйте четкое определение, что изучает химия.
Что такое физическое тело? Из чего состоят физические тела?
Составьте в тетради таблицу, в которую необходимо записать примеры 10 различных тел, и веществ из которых они состоят:
| Тело | Вещества, из которых состоит тело |
| Шариковая ручка | Пластмасса, чернила |
Из предложенного перечня отдельно выпишите вещества, тела, материалы и природные явления: капля воды, гроза, лед, снежинка, медная проволока, графит, лист бумаги, град, стакан, стекло, метель, бетон, колесо.
Приведите примеры тел, которые могут состоять из различных веществ, и тел, которые могут состоять только из одного вещества.
Устно охарактеризуйте следующие рисунки, и объясните ценность достижений химической науки и отрицательный эффект неправильного использования химических веществ и процессов.



Приведите примеры веществ, которые созданы человеком и не встречаются в природе.
Из дополнительных источников информации выясните, что изучают такие науки как: нанохимия, космохимия, химия сверхнизких температур, компьютерная химия, кристаллохимия, супрамолекулярная химия. Законспектируйте в тетрадь краткие сведения об этих науках.
На рисунке представлены различные вещества, попробуйте классифицировать их на органические и неорганические:



| Нефть | Железная руда | Рубин |
| Лимонная кислота | Мел | Сахар |


 Многие вещества известны человеку с давних времен: ртуть, уксус, сода, квасцы,
Многие вещества известны человеку с давних времен: ртуть, уксус, сода, квасцы,
купорос, бура, свинцовые белила, сажа, медь, олово, сера, мышьяк, железо, нашатырь, свинец, золото, винный спирт, соляная кислота, царская водка, серебро. С какими из них вы встречались в повседневной жизни? Расскажите об их применении.
Юный Химик составил список веществ и материалов, которые получают искусственным путем: малахит, хлопок, капрон, жемчуг, мел, полиэтилен, резина, маргарин, пластмасса, натуральный шелк, бумага, стекло, аспирин, витамин С, бетон. Однако в этот список ошибочно попали природные вещества и материалы. Укажите их названия.
Юный Химик описал свойства кислорода, графита и ртути при комнатной температуре. Однако он забыл указать, к какому из веществ эти свойства относятся. Дополните его записи.
1)? — серо-черное твердое вещество, мягкое, пачкает любую поверхность, проводит электрический ток;
2)? — бесцветный газ, не имеющий вкуса и запаха, умеренно растворим в воде, поддерживает горение;
3)? — жидкость с серебристым блеском, легко испаряется даже в обычных условиях, ядовита.
По каким свойствам можно отличить между собой сталь, чугун и железо? Какие предметы из них изготавливают?
Чем похожи и чем отличаются по свойствам: а) сахарная пудра и цемент; б) кухонная соль «Экстра» и лимонная кислота; в) алюминий и золото; г) пластмасса и железо; д) сера и парафин; е) графит и алмаз; ж) глина и медь?
Какие вещества называют токсичными? Приведите несколько примеров таких веществ.

2.  МИХАИЛ ВАСИЛЬЕВИЧ ЛОМОНОСОВ (1711–1765)
МИХАИЛ ВАСИЛЬЕВИЧ ЛОМОНОСОВ (1711–1765)
Великий русский ученый – Михаил Васильевич Ломоносов (1711–1765) был химиком, физиком, технологом, литератором. Он создал первую в России химическую лабораторию.
По его инициативе в 1755 г. был открыт Московский университет. Он много занимался русским языком, грамматикой и стихосложением. Одной из главных тем его поэзии была восторженная похвала науке, в том числе химии:
3. Такие разные вещества
В земное недро ты, Химия, Проникни взора остротой,
И что содержит в нем Россия, Драги сокровища открой...
Твердый водород – это самое легкое твердое вещество на Земле.
При температуре –260°С его плотность около 0,076 г/см3. А самое тяжелое вещество – осмий (плотность 22,48 г/см3). Значит, твердый водород легче твердого осмия в 296 раз. В число наиболее плотных веществ входит и платина.
...Однажды в ювелирную мастерскую француза Пьера-Франсуа Шабано при дворе испанского короля Карла III в Мадриде зашел некий маркиз Аранда, чтобы приобрести платиновые изделия. На столе ювелира стоял кованый платиновый кубик со стороной около 10 см. Старый маркиз хотел приподнять его, но не смог. «Вы смеетесь надо мной, – обиделся вельможа. – Платина приклеена чем-то к столу!». Но нет, кубик не был приклеен, просто он был слишком тяжел: его масса составляла 21,5 кг!
§2. Из истории химии

Химия в древнем мире
Наука о веществах и их превращениях зародилась в Египте – технически наиболее передовой стране древнего мира. Египетские жрецы были первыми химиками. Они владели многими до сих пор неразгаданными химическими секретами. Например, приемами бальзамирования тел умерших фараонов и знати, а также получением некоторых красок.
Такие отрасли производства, как гончарное производство, стеклоделие, крашение, парфюмерия, достигли в Египте значительного развития еще задолго до

Рисунок 5. Бальзамирование в древнем Египте
нашей эры. Химия считалась «божественной» наукой, находилась целиком в руках жрецов и тщательно скрывалась ими от всех непосвященных. Однако, некоторые сведения все же проникали за пределы Египта.
Известно, что в библиотеке египетского города Александрии, одном из семи чудес света, хранились манускрипты с описанием процессов прокаливания, перегонки, фильтрования и т.п.
В истории химии древнее греческое государство также играет значительную роль. Греки многому научились у египтян, в тоже время, сами внесли значительный вклад в науку о веществах.
Химические знания, непрерывно накапливаемые людьми, постепенно отделялись от религии и переходили в самостоятельную область человеческой деятельности. Одним из первых основоположников восприятия мира через познание был известный философ Аристотель, который предполагал, что все существующие предметы и вещества состоят только из четырёх фундаментальных элементов – воды, огня, земли и воздуха. Каждый из этих элементов характеризует собственное свойство: вода – влажность, земля – холод, огонь – тепло, воздух – сухость. Древнегреческий философ Демокрит предполагал, что вся существующая и
 окружающая нас материя состоит из мельчайших неделимых частиц.
окружающая нас материя состоит из мельчайших неделимых частиц.
Чрезвычайно продвинутыми в сфере науки и изобретательства были и древние китайцы, история Китая знает имена многих выдающихся учёных.
Одним из самых значительных ранних открытий в Китае можно считать изобретение фарфора. В начале II в. н.э. в Китае была изобретена бумага, которую изготавливали сначала из коры деревьев, пеньки, шелковой ваты и шелковых очесов, остававшихся от производства. Позднее на юге Китая для изготовления лучших сортов бумаги стали употреблять молодые побеги бамбука и тростника. Еще до нашей эры китайцы разработали способы получения сахара. Широкое распространение получили у них и красители, извлекаемые из растений. В Китае успешно развивалась лекарственная химия, были изобретены порох, тушь,
Рисунок 6. Производство бумаги
в древнем Китае
лаки. Китайские земледельцы еще до нашей эры начали применять органические удобрения.
Химия в средние века
В течение тысячелетий происходило накопление химических знаний человека.
Примерно в VII в. н.э. арабы переняли достояние и приемы работы египетских жрецов и обогатили человечество новыми знаниями. Арабы добавили к слову хеми приставку ал, и лидерство в изучении веществ, которое стало называться алхимией, перешло к арабам.
Следует отметить, что на Руси алхимия распространения не имела, хотя труды алхимиков были известны, и даже переводились на церковнославянский язык.

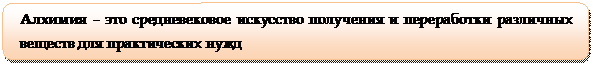
В отличие от древнегреческих философов, которые лишь наблюдали мир, а объяснение строили на предположениях и размышлениях, алхимики действовали, экспериментировали, делая неожиданные открытия и совершенствуя методику эксперимента.
Алхимики считали, что металлы – это вещества, состоящие из трех основных элементов: соли – как символа твёрдости и способности к растворимости; серы – как вещества, способного нагреваться и гореть при высоких температурах; ртути – как вещества, способного к испарению и обладающего блеском. В связи с этим предполагалось, что, например, золото, являвшееся драгоценным металлом, тоже обладает точно такими же элементами, а значит и получить его можно из любого металла! Считалось, что получение золота из любого другого металла связано с действием философского камня, которые безуспешно и пытались найти алхимики.
Кроме того, они верили, что если выпить эликсир, приготовленный из философского камня, то приобретешь вечную молодость! Но ни философского камня, ни золота из других металлов алхимикам найти и получить не удалось.
И, тем не менее, их деятельность дала положительные результаты: от них нам достался большой опыт работы со многими веществами, изобретенные приборы и оборудование, ими были открыты некоторые химические элементы и изучены их свойства.
 В истории алхимии стоит назвать некоторые выдающиеся имена. Так, немецкий алхимик Хенниг Бранд, впервые получил фосфор, предположительно в 1669 году. Одержимый поисками философского камня и золота, он считал, что все вещества, окрашенные в золотистый цвет, содержат частицы золота. Для экспериментов Бранд
В истории алхимии стоит назвать некоторые выдающиеся имена. Так, немецкий алхимик Хенниг Бранд, впервые получил фосфор, предположительно в 1669 году. Одержимый поисками философского камня и золота, он считал, что все вещества, окрашенные в золотистый цвет, содержат частицы золота. Для экспериментов Бранд
воспользовался мочой. При ее выпаривании
алхимик и получил белое вещество, похожее на воск, которое самовоспламенялось на воздухе – это был фосфор.
Рисунок 7. Алхимик Х. Бранд за работой
 в своей лаборатории
в своей лаборатории
Французский алхимик Николас Фламель – личность весьма загадочная. По некоторым данным считается, что именно этому алхимику все же удалось получить философский камень и эликсир жизни. Сведения об этом человеке обрывочны, считается, что после получения философского камня алхимик скрылся. Сегодня известно, что старейшее здание в Париже, построенное еще в 1407 году, являлось когда-то домом Николаса Фламеля.
XV век – период в истории химии, ознаменованный применением алхимии для изготовления различных медицинских препаратов. Благодаря развитию точных наук, развитие химии всё более приобретало научный характер. Алхимия постепенно
Рисунок 8. Николас
Фламель (1330–1418)

Рисунок 9. Парацельс
(1493–1541)
превращалась в химию. Химия постепенно отделялась от философии и уже, как наука, строилась на обобщениях и анализе отдельных наблюдаемых явлений.
Параце́льс (лат. Paracelsus, настоящее имя Филипп Ауреол Теофраст Бомбаст фон Гогенгейм, 1493–1541) – знаменитый швейцарский алхимик, врач, философ, естествоиспытатель, натурфилософ эпохи Возрождения, один из основателей ятрохимии. Парацельс был великим реформатором медицинской науки и практики, он подверг критическому пересмотру идеи древней медицины, способствовал внедрению химических препаратов в медицину. Считается одним из основателей современной науки.
Можно полагать, что Парацельс погиб от систематического отравления ртутью. Он считал, что когда-то все металлы были ртутью, и провел сотни опытов, чтобы из ртути получить золото. В конце жизни он признал неудачу, сказав: «Из семени лука вырастет лук, а не роза, орех или салат».
По одной из легенд, Парацельс открыл секрет вечной молодости и не умер, а живет среди нас. Могила Парацельса на кладбище святого Себастьяна в Зальцбурге стала местом паломничества. Существует предание, что здесь в 1831 г. остановилось продвижение эпидемии холеры. Считают, что рассказы о Парацельсе легли в основу легенды о докторе Фаусте.
Постепенно уровень развития химии позволил создавать сообщества, которые имели научный подход к изучаемым явлениям, могли передавать и продолжать накапливать знания. Это были первые академии. Так, в 1560 году такая академия образовалась в Неаполе. Через 100 лет подобная академия появилась в Лондоне.
 Во второй половине XVII века ирландским учёным Робертом Бойлем предпринята попытка объяснения некоторых химических превращений на основании применения понятия «атом». Работы Бойля имели большое значение для становления химии как науки. В книге «Химик-скептик» он сформулировал основную задачу химии – исследование состава разных физических тел, поиск новых химических элементов.
Во второй половине XVII века ирландским учёным Робертом Бойлем предпринята попытка объяснения некоторых химических превращений на основании применения понятия «атом». Работы Бойля имели большое значение для становления химии как науки. В книге «Химик-скептик» он сформулировал основную задачу химии – исследование состава разных физических тел, поиск новых химических элементов.
В книге содержалась обоснованная критика учения
Рисунок 10. Роберт Бойль (1627–1691)
o трех началах (сере, ртути, соли) и четырех стихиях. Трактат был издан анонимно, но имя автора вскоре стало
широко известно. Эта книга стала важным шагом на пути превращения алхимии в самостоятельную науку – химию.
Становление современной химии
 Первым этапом существования химии как самостоятельной науки можно считать открытие закона сохранения массы (вторая половина XVIII века). Этот закон был впервые сформулирован французским химиком Антуаном Лораном Лавуазье (1743−1794), который в процессе свое научной деятельности положил основы исследования вещества уже с научной точки зрения. Автор кислородной теории горения, один из авторов новой химической номенклатуры, он предложил первый перечень химических элементов и написал первый учебник «Элементарный курс химии».
Первым этапом существования химии как самостоятельной науки можно считать открытие закона сохранения массы (вторая половина XVIII века). Этот закон был впервые сформулирован французским химиком Антуаном Лораном Лавуазье (1743−1794), который в процессе свое научной деятельности положил основы исследования вещества уже с научной точки зрения. Автор кислородной теории горения, один из авторов новой химической номенклатуры, он предложил первый перечень химических элементов и написал первый учебник «Элементарный курс химии».
Первой (хотя и затем отвергнутой) теорией научной
химии была предложенная Георгом Шталем теория флогистона (XVIII в.). Флогистонная теория была главным условием и движущей силой развития учения об элементах. Она
Рисунок 11. Антуан Лоран Лавуазье (1743–1794)
способствовала полному освобождению химии от алхимии. Именно во время почти столетнего господства флогистонной теории завершилось начатое Бойлем превращение алхимии в химию.
К концу XVIII в. в химии был накоплен большой объем экспериментальных данных, которые необходимо было систематизировать в рамках единой теории. Создателями такой теории стали французский химик Антуан Лоран Лавуазье и русский ученый Михаил Васильевич Ломоносов. Они применяли точные измерения при изучении химических
реакций. Это позволило опровергнуть теорию флогистона, выявить суть процессов горения и дыхания, сформулировать закон сохранения массы.
Блестящие успехи количественных методов исследования веществ привели к фундаментальным изменениям в химии.
 Английский химик Джон Дальтон (1766–1844) экспериментально подтвердил атомистическую теорию. Период количественных законов (атомно-молекулярной теории) продолжался с 1789 по 1860 г.
Английский химик Джон Дальтон (1766–1844) экспериментально подтвердил атомистическую теорию. Период количественных законов (атомно-молекулярной теории) продолжался с 1789 по 1860 г.
С первой половины XIX в. химия начала свое стремительное и триумфальное развитие.
С увеличением объема знаний о веществах и их свойствах выделились ее отдельные области.
Рисунок 12. Джон Дальтон
(1766–1844)
Несомненно, самым значительным открытием химии стало открытие важнейшего закона природы – Периодического
 Закона. Периодический Закон был открыт в феврале 1869 года русским химиком Дмитрием Ивановичем Менделеевым. Сегодня
Закона. Периодический Закон был открыт в феврале 1869 года русским химиком Дмитрием Ивановичем Менделеевым. Сегодня
Периодическая Система химических элементов Д.И. Менделеева висит на стене любого кабинета химии во всем мире! Именно Периодический Закон объединил химические знания в стройную и логическую систему. Д.И. Менделеев предсказал существование элементов, которые в то время были еще не открыты. Предсказанные Менделеевым элементы вскоре были открыты, что служило подтверждением великого открытия!
На современном этапе развития естественных наук (с XX в.) появились принципиально новые физические методы исследования. Это предоставило химикам невиданные прежде возможности для изучения веществ.
В нынешнем, XXI веке, триумфальное шествие химии продолжается. Ее наивысшая цель – удовлетворять потребности каждого человека и всего общества.
Подведем итоги
Дмитрий Иванович Менделеев (1834–1907)

Вопросы, упражнения и задачи
Охарактеризуйте химические знания и умения древних египтян и китайцев.
Какова была основная цель алхимии?
Какой вклад внесли алхимики в развитие химической науки?
Подберите дополнительную информацию о загадочном французском алхимике Николасе Фламеле.
Немало важных открытий в химии сделали русские ученые. Подберите информацию о вкладе в химическую науку М.В. Ломоносова, Д.И. Менделеева, В.И. Вернадского.
М.В. Ломоносов в статье, опубликованной в 1745 г., писал: «При растворении какого- либо неблагородного металла, особенно железа, в кислотных спиртах из отверстия склянки вырывается горючий пар, который представляет собой не что иное, как флогистон». Как вы думаете, что принимал за флогистон М.В. Ломоносов?
Изучив информацию из дополнительных источников, объясните, когда и как потерпела крах теория флогистона.
Английский алхимик Джордж Рипли (1415–1490) дал такой рецепт получения
«философского камня» и «эликсира молодости», с помощью которых можно стать вечно молодым и превращать простые металлы в золото: «...возьми, сын мой, философской ртути и накаливай, пока она не превратится в зеленого льва. После этого прокаливай сильней, и он превратится в красного льва. Дигерируй этого красного льва на песчаной бане с кислым виноградным спиртом, выпари жидкость...» Как перевести этот текст на современный химический язык?
Алхимики в средние века безуспешно пытались превратить один элемент в другой, например медь в золото, а ртуть в серебро. Известны ли современной науке способы превращения одного металла в другой?
 Подготовьте небольшой рассказ о каком-либо интересном открытии алхимиков.
Подготовьте небольшой рассказ о каком-либо интересном открытии алхимиков.
4. Теория флогистона
Блокнот эрудита
Почему одни предметы горят, а другие нет? Что представляет собой процесс горения?
По представлениям древних греков все, что способно гореть, содержит в себе элемент огня, который в соответствующих условиях может высвобождаться.
Алхимики придерживались примерно той же точки зрения, но считали, что способные к горению вещества содержат в себе элемент серу.
В 1669 году немецкий химик Иоганн Бехер попытался дать рациональное объяснение явлению горючести. Он предположил, что твердые вещества состоят из трех видов «земли», и один из этих видов, названный им «жирная земля», служит горючим веществом.
Основоположником теории флогистона считается немецкий врач и химик Георг Шталь, который постарался последовательно развить идеи Бехера о «жирной земле», но в отличие от Бехера Шталь вместо понятия «жирная земля» ввел понятие «флогистон» – от греческого «флогистос» – горючий, воспламеняющийся.
Теория флогистона основана на убеждении, что все горючие вещества богаты особым горючим веществом – флогистоном и чем больше флогистона содержит данное тело, тем более оно способно к горению. То, что остается после завершения процесса горения, флогистона не содержит и потому гореть не может.
Теория флогистона Шталя на первых порах встретила резкую критику, но при этом быстро начала завоевывать популярность и во второй половине XVII в. была принята химиками повсеместно, так как позволила дать четкие ответы на многие вопросы. Однако один вопрос ни Шталь, ни его последователи разрешить не смогли. Дело в том, что
 большинство горючих веществ (дерево, бумага, жир) при горении в значительной степени исчезали. Оставшиеся зола и сажа были намного легче, чем исходное вещество. Но химикам XVIII в. эта проблема не казалась важной, они еще не сознавали важность точных измерений, и изменением в весе они пренебрегали. Теория флогистона объясняла причины изменения внешнего вида и свойств веществ, а изменения веса были не важны.
большинство горючих веществ (дерево, бумага, жир) при горении в значительной степени исчезали. Оставшиеся зола и сажа были намного легче, чем исходное вещество. Но химикам XVIII в. эта проблема не казалась важной, они еще не сознавали важность точных измерений, и изменением в весе они пренебрегали. Теория флогистона объясняла причины изменения внешнего вида и свойств веществ, а изменения веса были не важны.
5. Алхимия – наука или шарлатанство?
Алхимией занимались не только ученые, стремившиеся постигнуть тайны природы, но и всякого рода мошенники и неудачливые пророки. В XVIII в. в ходу было такое четверостишие:
Алхимию постигнуть каждый рад: Безмозглый идиот, старик и юный фат, Портной, старуха, юркий адвокат, Монах плешивый, пастырь и солдат.
6. Великий Ньютон и алхимия
К алхимикам принадлежал и великий английский физик и математик Исаак Ньютон (1643–1727). Он много времени и сил отдал поискам «философского камня» и универсального растворителя. Но Ньютона интересовали не столько способы получения золота при помощи химических реакций, сколько изучение взаимопревращений веществ.
7. М.В. Ломоносов – теоретик и практик
До середины VIII в. в России не было ни одной химической лаборатории. Первая научно-исследовательская и учебная лаборатория в России была построена благодаря усилиям выдающегося ученого М.В. Ломоносова. Три года ученый вел борьбу за создание лаборатории, писал:
... без лаборатории принуждён только одним чтением химических книг и теориею довольствоваться, а практику почти вовсе оставить и для того от ней со временем отвыкнуть
В октябре 1748 года, когда она, наконец, была построена, и получила оборудование, изготовленное по чертежам и проектам самого учёного, он начал проводить в ней экспериментальные исследования по химии и технологии силикатов, по обоснованию теории растворов, по обжигу металлов, а также – осуществлял пробы руд. Здесь он провёл более 4 тысяч опытов. Им разработана технология цветных стёкол, исследованы множество веществ, усовершенствованы и внедрены в промышленность химические процессы.
В своей химической лаборатории М.В. Ломоносов в 1752–1753 годах впервые за всю историю науки прочел курс физической химии студентам академического университета.
§3. Кабинет химии

Правила поведения в школьном кабинете химии
Одной из самых интересных наук о природе, химию делает, конечно же, ее объект исследования – вещества. Разнообразные эксперименты с веществами могут быть зрелищными, эффектными и запоминающимися. Однако необходимо помнить о соблюдении определенных правил поведения учащихся в кабинете химии и при выполнении экспериментальных работ.


Приемы обращения с лабораторной посудой и веществами
При выполнении химического эксперимента используется разнообразная химическая посуда. Она может быть изготовлена из стекла, пластика, фарфора.
Стеклянная посуда имеет разнообразное предназначение. Например, с помощью мерного цилиндра отмеряют необходимый объем жидкости, а в колбах хранят растворы веществ и проводят превращения одних веществ в другие.
Пробирки используют для проведения опытов с малым количеством веществ, воронки
– для переливания жидкостей.
Если условия опыта требуют больших количеств веществ, используют колбы, стаканы. Небольшие объемы жидкостей удобно отмеривать пипетками. Сыпучие вещества удобно отбирать при помощи шпателя.
Фарфоровая посуда менее разнообразна, чем стеклянная. Ступка с пестиком используется для измельчения веществ. Фарфоровая чаша необходима для нагревания веществ, а тигель – для прокаливания веществ в специальных печах при высоких температурах.
Пластиковая лабораторная посуда изготавливается из различных полимерных материалов, обеспечивающих легкость и прочность. Такой вид посуды пригоден для разбавления концентрированных растворов химических веществ, а также для проведения некоторых лабораторных операций.

| Штатив с пробирками | Химический стакан | Мерный цилиндр | Ступка и пестик | Штатив с пробирками |
| Кристаллизатор | Колба круглодонная | Колба коническая | Воронка | Холодильник |
|

| 
|
|
|
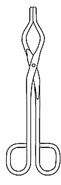
| Фарфоровая чаша | Фарфоровый тигель | Пипетка | Шпатель | Тигельные щипцы |
| Рисунок 14. Посуда из стекла и фарфора | ||||
В химической лаборатории все вещества хранятся в плотно закупоренных банках, как
правило, изготовленных из стекла. Перед началом эксперимента из банки берут необходимое количество вещества. Банку с остатком вещества сразу убирают на место.
 Каковы же основные правила, которые необходимо соблюдать при работе с веществами?
Каковы же основные правила, которые необходимо соблюдать при работе с веществами?
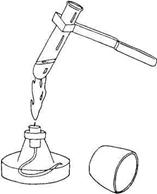
Крышку от банки, из которой вы берете вещество, необходимо класть на стол резьбой вверх, это необходимо для того, чтобы частицы вещества, находящиеся на крышке, не попали на стол (рисунок 15).
Сыпучие вещества необходимо насыпать с помощью ложечек или согнутого листа бумаги, избегая рассыпания. Если кусочки





 Рисунок 15. Правильное расположение крышки
Рисунок 15. Правильное расположение крышки
вещества слишком крупные, не бросать их в стеклянный сосуд, так как стекло от удара может треснуть.
Жидкости необходимо наливать аккуратно, прислоняя горлышко одного сосуда к другому, чтобы избежать разбрызгивания.
Жидкости можно переливать, используя стеклянную палочку: по ней жидкость стекает равномерно и не происходит разбрызгивание.
При растворении веществ в жидкостях перемешивайте смесь аккуратно, с помощью вращательных движений сосуда, или помешивая жидкость стеклянной палочкой. Нельзя закрывать отверстие сосуда пальцами, ладонью, и после этого производить перемешивание, едкое вещество может причинить вам химический ожог.
Для обнаружения запаха вещества необходимо расположить отверстие сосуда на уровне лица, на расстоянии 10–15 см, и при помощи взмахов ладони, «захватить» воздух, содержащий запах, и направлять его к носу.
Приемы обращения с лабораторным штативом
 Лабораторный штатив – приспособление, с помощью которого можно выполнить множество различных экспериментов. Благодаря многофункциональности в штативе можно закреплять как стеклянную, так и фарфоровую посуду, различные приборы, необходимые для опытов.
Лабораторный штатив – приспособление, с помощью которого можно выполнить множество различных экспериментов. Благодаря многофункциональности в штативе можно закреплять как стеклянную, так и фарфоровую посуду, различные приборы, необходимые для опытов.
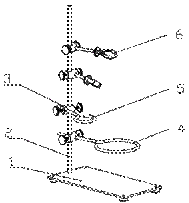
Рассмотрим устройство штатива. На рисунке 16 схематично обозначены его части: 1 – основание штатива; 2 – металлический стержень; 3 – муфта; 4, 5 – штативные кольца;
6 – лапка. При помощи лапки в штативе можно закрепить
различную стеклянную посуду. На штативное кольцо ставится, как правило, фарфоровая чаша.
Рисунок 16. Схема устройства
лабораторного штатива
Стеклянную посуду закрепляют в лапке штатива на расстоянии нескольких сантиметров от отверстия пробирки или колбы. С помощью поворотов лапки в муфте закрепляют сосуд под нужным для опыта углом. Например, на рисунках 17–18 показано правильное закрепление стеклянной посуды в штативе.
При закреплении стеклянной посуды в лапке штатива важно помнить, что стекло довольно хрупкое. Чтобы избежать растрескивания стекла, не закручивайте винт лапки слишком туго.
Фарфоровую чашу и вовсе не нужно крепить, ее достаточно поставить в углубление штативного кольца (рисунок 19).
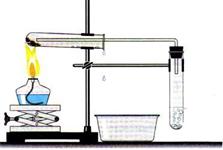

Рисунок 17. Закрепление пробирки в штативе
Рисунок 18. Закрепление колбы в штативе
Рисунок 19. Размещение чаши в штативном кольце
Приемы обращения с нагревательными приборами
Очень часто для проведения эксперимента необходимо нагревать вещества. Для этих целей в лаборатории используют газовые горелки, спиртовки, или приборы для сжигания сухого горючего (рисунки 20–22).
|
|

|
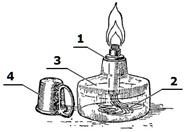
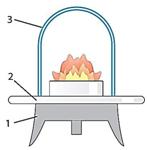
| Рисунок 20. Спиртовка 1 – трубка с диском; 2 – фитиль; 3 – резервуар для спирта; 4 – колпачок для гашения пламени. | Рисунок 21. Прибор для сжигания сухого горючего 1 – треножник; 2 – подставка из негорючего материала; 3 – колпачок для гашения пламени. | Рисунок 22. Газовая горелка Бунзена 1 – трубка; 2 – заслонка для воздуха; 3 – трубка для подачи газа; 4 – винт для регулирования тока газа. |
Существуют определенные правила обращения с нагревательными приборами.


 Поскольку при выполнении экспериментальных работ вы будете пользоваться спиртовкой, рассмотрим ее устройство.
Поскольку при выполнении экспериментальных работ вы будете пользоваться спиртовкой, рассмотрим ее устройство.
Спиртовка – стеклянный флакон, внутрь которого
 помещен фитиль. Флакон заполняется спиртом. При поджигании фитиля он горит за
помещен фитиль. Флакон заполняется спиртом. При поджигании фитиля он горит за
счет смачивания спиртом и создает высокую температуру.
Рисунок 23.
Пробиркодержатель
Рисунок 24. Нагревание жидкости в пробирке
При хранении спиртовка герметично закрывается винтовой крышкой или стеклянным колпачком.
Малые порции веществ, помещенные в пробирки, можно нагревать и без помощи штатива, для этого можно воспользоваться пробиркодержателем (рисунок 23). Нагревание пробирки с жидкостью производят под углом 40–45°(рисунок 24).
Правила техники безопасности при выполнении экспериментальных работ
Подведем итог и сформулируем определенные правила, которые необходимо неукоснительно соблюдать при выполнении лабораторных опытов.


· 
 Опыты с использованием или образованием ядовитых газов и газов с резким запахом необходимо проводить в вытяжном шкафу
Опыты с использованием или образованием ядовитых газов и газов с резким запахом необходимо проводить в вытяжном шкафу
· Берите вещества только в том количестве, которое необходимо для опыта. Аккуратно обращайтесь с имуществом химического кабинета
· Запрещается заполнять пробирку перед нагреванием более, чем на 1/3. При нагревании пробирки с жидкостью ее надо направлять отверстием от себя, но ни в коем случае не направлять на других людей, чтобы, в случае выброса нагретого вещества из пробирки, избежать несчастного случая
· Запрещается выполнять опыты, не запланированные в работе, смешивать какие-либо вещества, изменять условия эксперимента!
· Запрещается сливать (ссыпать) остатки веществ в склянки, где они хранятся
· Наблюдайте за процессом протекания опыта через стенки пробирки, не заглядывайте в ее отверстие, особенно во время нагревания
· При работе с нагревательными приборами соблюдайте особую осторожность. Нагревать пробирку с жидкостью нужно равномерно, чтобы прогрелась вся пробирка. В противном случае возможно ее растрескивание
· Ни в коем случае не оставляйте нагревательные приборы без присмотра!
· Горячие предметы ставьте на кафель или специальную подставку
· Запрещается брать вещества руками, пробовать их на вкус
· Нюхайте все вещества осторожно, не наклоняйтесь над сосудом и не вдыхайте полной грудью, а только направляйте к себе газ движениями руки
· Будьте особенно осторожны при работе со щелочами. Попадание в глаза даже разбавленных растворов щелочей может привести к полной потере зрения. Если раствор щелочи попал на руки, немедленно смывайте его большим количеством воды – до исчезновения ощущения мылкости
· Будьте осторожны при работе с кислотами. Особенно берегите глаза. В случае попадания раствора кислоты на руки немедленно смойте ее большим количеством воды
· Отработанные реактивы сливайте в раковину (после их нейтрализации), а ценные реактивы – в специальную химическую посуду
· Для опытов используйте чистую и неповрежденную лабораторную посуду
· После завершения опытов необходимо привести рабочее место в порядок, тщательно вымыть руки с мылом
· Если произошел несчастный случай, немедленно обратитесь к
Некоторые эксперименты требуют работы с едкими и ядовитыми веществами. Определить, представляет ли вещество опасность, можно по характерному знаку на этикетке посуды (рисунок 25), в которой оно храниться. При работе с едкими (кислоты, щелочи) и ядовитыми веществами необходимо соблюдать особую осторожность: работать в резиновых перчатках и защитных очках.

| Едкое вещество | Огнеопасное вещество | Вещество опасно для окружающей среды | Ядовитое вещество | Вещество требует осторожного обращения |
| Рисунок 25. Предупреждающие знаки | ||||




 Необходимо соблюдать осторожность при работе со стеклянной посудой, так как ее легко разбить.
Необходимо соблюдать осторожность при работе со стеклянной посудой, так как ее легко разбить.
Подведем итоги

Вопросы, упражнения и задачи
Что химики считают самым важным при работе в химической лаборатории?
Перечислите правила поведения учащихся в кабинете химии.
Для каких целей в лаборатории используют: стаканы, колбы, пробирки, воронки, стеклянные палочки?
Перечислите основные части лабораторного штатива и объясните, для чего они нужны.
Как правильно закреплять стеклянную посуду в лапке штатива?
Каковы основные правила работы со спиртовкой?
Как правильно нагревать жидкость в пробирке при помощи пробиркодержателя?
Как правильно переливать жидкости из сосуда в сосуд?
Как правильно производить растворение вещества?
Опишите последовательность действий, если по условию опыта необходимо определить запах вещества.
Проанализируйте рисунок, и обоснуйте действия, изображенные на нем:
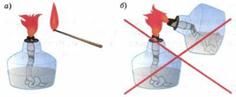
Перечислите лабораторную посуду и оборудование, которые необходимы для: переливания веществ, растворения в жидкости твердых веществ, нагревания веществ, испарения жидкости из раствора.
Иногда для перемешивания жидкостей используют стеклянную палочку с резиновым наконечником. Объясните предназначение резинового наконечника.
Почему детали лабораторного штатива изготавливают из металла, а не из пластика или другого материала?
 Можно ли нагревать герметично закрытую химическую посуду, например, колбу, закрытую резиновой пробкой? Ответ обоснуйте.
Можно ли нагревать герметично закрытую химическую посуду, например, колбу, закрытую резиновой пробкой? Ответ обоснуйте.
Блокнот эрудита
8. Требования к химической посуде
Посуда, применяемая в химическом эксперименте, должна удовлетворять ряду требований. Основными из них являются устойчивость к химическому воздействию и термостойкость. Большую её часть изготавливают из специального стекла. Такое стекло отличается большой химической стойкостью, оно очень слабо или вообще не разрушается под действием кислот, щелочей, растворов и расплавов солей а также других агрессивных веществ. Это свойство является очень важным, поскольку химическая посуда не должна выделять в вещество или в раствор, которые в ней находятся, своих составных частей, так как это приведёт к загрязнению вещества. Многие сорта химического стекла выдерживают сильное нагревание – до температуры красного каления. Однако резкое охлаждение горячего стекла практически всегда приводит к его растрескиванию. Растрескивание стекла может произойти также при неравномерном нагревании стеклянной посуды или приборов, поэтому перед нагреванием пробирку или колбу необходимо равномерно прогреть.
При необходимости сильного нагревания применяют посуду из кварцевого стекла. Кварцевое стекло выдерживает более сильное нагревание чем обычное химическое, кроме этого кварц обладает очень небольшим коэффициентом теплового расширения, поэтому посуда из кварцевого стекла выдерживает резкое охлаждение и при этом не растрескивается. Кварцевая посуда практически не выделяет в раствор своих составных частей, поэтому её используют при работе с особо чистыми веществами.
Химическую посуду, не предназначенную для нагревания, изготавливают также из обычного нетермостойкого стекла. Отличить нетермостойкую посуду от термостойкой, можно по следующим признакам: термостойкое стекло имеет толщину примерно 2–3 мм, которая, как правило, одинакова во всех частях изделия. Нетермостойкое стекло обычно большей толщины и может иметь неравномерные утолщения в различных частях посуды или прибора.
9. Весы и взвешивание
История процедуры взвешивания и конструирования точных весов уходит корнями в глубокую древность. Людям всегда необходимо было знать точную меру и вес предметов и веществ.
Весы были изобретены так давно, что еще в античные времена люди почитали их дарами богов. При раскопках древнего Вавилона археологи не раз находили каменные изделия правильной геометрической формы; иногда они напоминали фигурки животных. Оказалось, что это древние гири, которым больше 4,5 тысяч лет! На каждой гире указан ее вес. Единицей измерения у вавилонян служила довольно увесистая гиря массой (в современных единицах) около 0,5 кг. Эта единица называлась малой миной, она просуществовала несколько тысяч лет. Другие гири были еще тяжелее. С их помощью взвешивали зерно и другую сельскохозяйственную продукцию.
Работа современного химика немыслима без множества различных измерений. Одним из самых важных измерений всегда считалось взвешивание. Это одна из наиболее распространенных операций в химии. Поэтому уже в первых химических лабораториях можно найти весы (рисунок 26).
Для более точных измерений химики пользуются аналитическими весами. Когда-то каждый экземпляр аналитических весов изготовлялся мастером вручную и стоили хорошие весы очень дорого. Уже в начале XIX века точность самых лучших весов достигала 0,001 г (или
1 мг). Однако лишь немногие химики могли похвастаться такими весами. Даже знаменитый шведский химик Йенс Якоб Берцелиус имел в молодые годы плохо оборудованную лабораторию с довольно грубыми весами, поэтому для получения надежных результатов он был вынужден повторять один и тот же анализ по 20–30 раз! За 10 лет Берцелиус произвел анализ порядка 2000 соединений, состоящих из 43 элементов. Можно только восхищаться усердием, с каким он проделал эту колоссальную работу. Спустя почти столетие другой знаменитый химик Вильгельм Оствальд, один из первых лауреатов Нобелевской премии по химии, увидев в музее оборудование, с которым работал Берцелиус, сказал: «Мне стало совершенно ясно, как мало зависит от прибора и как много от человека, который перед ним сидит». Конечно, Оствальд имел в виду не только весы, и его слова остаются во многом справедливы и сегодня.
Со временем весы совершенствовались, и через несколько десятилетий уже каждый химик имел возможность взвешивать на стандартных аналитических весах несколько граммов вещества с точностью до 0,0001 г (рисунок 27). Такие
Рисунок 26. Весы Роберта Бойля (к левой чашке весов привязана нитка – для взвешивания предметов, погруженных в воду)
аналитические весы до сих пор можно встретить во многих лабораториях. Два больших цилиндра над чашками весов, внутри которых с маленьким зазором движутся цилиндры чуть меньшего диаметра, – это демпферы, назначение которых – быстро «успокоить» качание весов.
Рисунок 27.
Аналитические весы
Гири для аналитических весов должны быть очень точными. Поскольку коррозия может изменить массу гирь на несколько миллиграммов (а это совершенно недопустимо), гири покрывают тонким слоем золота. А чтобы они не пачкались, их разрешается брать при взвешивании только специальным пинцетом. Точное взвешивание на аналитических весах – дело долгое и кропотливое. Даже малейшее движение воздуха в комнате влияет на их показания, поэтому весы помешают в шкафчик со стеклянными дверцами. Аналитические весы – очень сложный и капризный механический агрегат. Их коромысло качается на опоре из особо твердого минерала – агата. Таким весам
 посвящались целые параграфы в учебниках, и аккуратной работе с ними ранее долго обучали студентов. Вот что писала в рекламной брошюре 1940 года фирма «Кристиан Беккер», производившая такие весы: «Простой расчет показывает, что средний химик проводит значительную часть рабочего времени у весов. В лаборатории нередко можно видеть химиков, ожидающих возле весов своей очереди, задерживающих важную работу, чтобы провести необходимое взвешивание. В связи с этим очевидна необходимость в быстро работающих, удобных и точных весах».
посвящались целые параграфы в учебниках, и аккуратной работе с ними ранее долго обучали студентов. Вот что писала в рекламной брошюре 1940 года фирма «Кристиан Беккер», производившая такие весы: «Простой расчет показывает, что средний химик проводит значительную часть рабочего времени у весов. В лаборатории нередко можно видеть химиков, ожидающих возле весов своей очереди, задерживающих важную работу, чтобы провести необходимое взвешивание. В связи с этим очевидна необходимость в быстро работающих, удобных и точных весах».
Возникла необходимость – и задача была решена. Постепенно эти красивые аналитические весы уходят в прошлое. Недавно в бюллетене Американского химического общества была опубликована заметка, где говорилось, что весы – один из основных инструментов химика, за последнее время потеряли шарм, который в свое время делал их центральным местом лаборатории. И потеряли они его в результате... усовершенствования.

§4. Практическая






