Комплексные соединения (иначе соединения высшего порядка) образуются при взаимодействии друг с другом простых соединений, то есть соединений первого порядка. Например:
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2.
Основу комплексного соединения составляют центральный атом (или ион), называемый комплексообразователем, и частицы (ионы или молекулы), располагающиеся вокруг комплексообразователя, которые называются лигандами. Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения. Ионы, нейтрализующие суммарный заряд частиц внутренней сферы и располагающиеся более отдаленно от комплексообразователя, называются внешней сферой. При написании формулы комплексного соединения внутреннюю сферу отделяют от внешней квадратными скобками. Например:
 |
Общее число связей, возникающих между комплексообразователем и его лигандами, называется координационным числом (КЧ) или координационной дентатностью комплексообразователя. Наиболее характерное значение координационного числа можно оценить по формуле
КЧ ≈ 2 · Z к,
где Z к – степень окисления комплексообразователя (иначе заряд иона).
Координационное число не является постоянной величиной данного комплексообразователя, а обусловлено также природой лиганда. Нейтральные лиганды обычно присоединяются в большем количестве, чем заряженные. Например, для комплексов кобальта (II) известно существование ионов [Co(H2O)6]2+ и [CoCl4]2–.
По числу связей, образованных с центральным атомом, различают:
1) монодентатные лиганды – образуют одну связь и занимают одно место в координационной сфере комплексообразователя. В этом случае координационное число совпадает с числом лигандов во внутренней сфере. К таким лигандам относятся Н2О, NH3, CO, Cl–, CN– и др.
Например, в ионах [Fe(CN)6]3– и [Cu(NH3)4]2+ координационные числа равны 6 и 4 соответственно;
2) бидентатные лиганды. Они связаны с комплексообразователем двумя связями. В этом случае координационное число в два раза больше числа лигандов. К таким лигандам относятся молекулы гидразина, аминоуксусной кислоты, этилендиамина, а также ионы С2О  , SO
, SO  , CO
, CO  .
.
Например, оксалат-ион – бидентатный, образует с ионом Cu2+ соединение K2[Cu(C2O4)2], в котором координационное число комплексообразователя равно 4. Следует помнить, что в зависимости от условий лиганды SO  и CO
и CO  могут быть как монодентатными, так и бидентатными;
могут быть как монодентатными, так и бидентатными;
3) полидентатные лиганды. Они занимают в координационной сфере более двух мест, т.е. соединены с комплексообразователем тремя или более связями. Например, этилендиаминтетраацетат (ЭДТА) – шестидентатный лиганд.
При определении заряда комплекса необходимо учитывать следующее:
1) если лигандами являются только нейтральные молекулы, то заряд комплекса равен заряду центрального иона;
2) если во внутреннюю сферу входят как ионы, так и молекулы, то заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов с учетом их количества.
Например, для определения заряда иона [Cr3+(H2O)  Cl–] x следует решить уравнение
Cl–] x следует решить уравнение
x = 1 × (+3) + 5 × 0 + 1 × (–1) = +2.
Номенклатура комплексных соединений
Образование названий комплексных соединений осуществляется по следующим правилам:
1. Порядок перечисления частиц. Если соединение является комплексной солью, то его название будет состоять из двух слов: сначала называется анион в именительном падеже, а затем катион в родительном падеже.
Если внутренняя сфера – катион, то для названия комплексообразователя используют русский корень элемента, а если внутренняя сфера – анион, то в названии применяют латинский корень. Степень окисления комплексообразователя указывается в скобках римской или арабской цифрой.
У нейтральных комплексов (без внешней сферы) название состоит из одного слова в именительном падеже с использованием русского корня комплексообразователя, при этом его степень окисления не указывается.
При названии комплексного иона сначала указываются лиганды, затем комплексообразователь. Перечисление лигандов ведут в следующем порядке: сначала анионы – ОН–, одноатомные, полиатомные; затем нейтральные лиганды (сначала неорганические, затем органические); далее катионы в любом порядке.
Записанная формула читается справа налево. При составлении формулы по ее названию в квадратных скобках сначала записывают комплексообразователь, а затем лиганды в обратном порядке их перечисления. Например:
K3[Fe(CN)6] – гексацианоферрат (III) калия;
[Pt(NH3)6]Cl4 – хлорид гексаамминплатины (IV);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина;
2. Названия лигандов. Для нейтральных лигандов используют однословные названия веществ без изменений. Например: N2 – диазот, N2H4 – гидразин, C2H4 – этилен. Для молекул Н2О, NH3, СО, NO применяют особые термины: аква, аммин, карбонил, нитрозил соответственно.
К названиям анионных лигандов прибавляют соединительную гласную «о». Например: Cl– – хлоро, SO  – сульфато, О2– – оксо, S2– – тио, ОН– – гидроксо, CN– – циано, NСS– – тиоцианато, Н– – гидридо, NO
– сульфато, О2– – оксо, S2– – тио, ОН– – гидроксо, CN– – циано, NСS– – тиоцианато, Н– – гидридо, NO  – нитро, NO
– нитро, NO  – нитрато и т.д. Исключение составляют анионы углеводородов, например, С5Н
– нитрато и т.д. Исключение составляют анионы углеводородов, например, С5Н 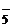 – циклопентадиенил.
– циклопентадиенил.
Громоздкие по написанию формулы органических лигандов заменяют буквенными обозначениями: NH2CH2CH2NH2 (этилендиамин) – Еn; C5H5N (пиридин) – py; (NH2)2CO (карбамид) – ur; NH2CH2COO– (глицинат-ион) – gly.
3. Приставки и окончания. Число простых лигандов указывают с помощью приставок греческих числительных: ди – 2, три – 3, тетра – 4, пента – 5, гекса – 6, гепта – 7, окта – 8, нона – 9, дека – 10, ундека – 11, додека – 12.
Для лигандов со сложными названиями, в которых уже имеются приставки (моно-, ди- и т.д.), используют приставки бис – 2, трис – 3, тетракис – 4, а названия таких лигандов заключаются в круглые скобки.
Для названия анионных комплексов применяют окончания: –ат, если комплексное соединение относится к классу солей; –овая или –ная, если комплексное соединение является кислотой. Для катионных и нейтральных комплексов типичных окончаний нет.
Например:
[Fe(Еn)3]Cl3 – хлорид трис(этилендиамин)железа (+3);
[Pt(Еn)(NH3)2(NO2)Cl]SO4 – сульфат хлоронитродиамминэтилендиаминплатины (IV);
H2[SiF6] – гексафторокремниевая кислота.
Классификация комплексных соединений
Комплексные соединения очень разнообразны по строению и свойствам, поэтому применяющиеся системы классификации основываются на различных принципах:
1. По принадлежности к определенному классу химических соединений различают: комплексные кислоты (например, Н[AuCl4]); комплексные основания ([Cu(NH3)4](OH)2); комплексные соли (K4[Fe(CN)6]).
2. По природе лигандов: аквакомплексы (лиганды – молекулы воды, например [Co(Н2О)4](NO3)2); аммиакаты (лиганды – молекулы аммиака, [Ag(NH3)2]Cl); ацидокомплексы (лиганды – анионы кислот, Na3[AlF6]); гидроксокомплексы (лиганды – гидроксогруппы, K3[Al(OH)6]); смешанного типа (содержатся лиганды нескольких видов, [Co(NH3)4Cl2]).
3. По знаку заряда комплекса: катионные – [Zn(NH3)4]2+Cl  ; анионные – Li+[AlH4]– ; нейтральные (без внешней сферы) – [Pt(NH3)2Cl2]0; бикомплексы – [Co(NH3)6][Fe(CN)6].
; анионные – Li+[AlH4]– ; нейтральные (без внешней сферы) – [Pt(NH3)2Cl2]0; бикомплексы – [Co(NH3)6][Fe(CN)6].
Равновесия в растворах комплексных соединений
При растворении в воде комплексные соединения, имеющие внешнюю сферу, диссоциируют как сильные электролиты с образованием комплексного иона, состоящего из частиц внутренней сферы, и ионов внешней сферы. Этот процесс называется первичной диссоциацией.
Например:
К4[Fe(CN)6] ® 4К+ + [Fe(CN)6]4–.
Наряду с этим процессом, как правило, протекает обратимая ступенчатая диссоциация внутренней сферы, которую называют вторичной диссоциацией. Так, для иона [Fe(CN)6]4– этот процесс идет по следующим ступеням:
первая ступень [Fe(CN)6]4– ↔ CN– + [Fe(CN)5]3–;
вторая ступень [Fe(CN)5]3– ↔ CN– + [Fe(CN)4]2– и т.д.
Количественной характеристикой прочности комплексного иона в растворе является константа равновесия процесса вторичной диссоциации, которую называют константой нестойкости K нест. Например, для иона [Fe(CN)6]4– константы нестойкости первой и второй ступеней выражаются уравнениями:
 ;
; 
На практике чаще пользуются величиной общей константы нестойкости K нест, которая характеризует суммарное равновесие вторичной диссоциации. Например, для иона [Fe(CN)6]4–
[Fe(CN)6]4– ↔ 6CN– + Fe2+, 
Общая K нест равна произведению констант нестойкости всех ступеней:
K нест = K нест, 1 · K нест, 2 · K нест, 3 ·... · K нест, n .
Иногда вместо K нест пользуются обратной величиной – константой устойчивости K уст:
K нест = 1/ K уст.
Если комплексы имеют одинаковое число лигандов, то их устойчивость можно определить по общей константе нестойкости: чем меньше K нест, тем более устойчив комплексный ион.
Сопоставление K нест комплексов для реагента и для продукта (при постоянном значении координационного числа) позволяет установить направление смещения равновесия реакции обмена лигандами в растворе. Например, для процесса
K2[PtCl4] + 4KI ↔ K2[PtI4] + 4KCl,
сравнив K нест ионов [PtCl4]2– и [PtI4]2–, которые равны 1 × 10-16 и 1 × 10-31 соответственно, видно, что комплексный ион-продукт намного устойчивее комплекса-реагента. Следовательно, равновесие такого процесса сильно сдвинуто вправо, то есть данная реакция протекает в прямом направлении.
Порядок выполнения работы
Приборы и реактивы: штатив с пробирками; 0,5 М растворы: гидроксида аммония, сульфата меди (II), хлорида меди (II), сульфата никеля (II), хлорида никеля (II), трихлорида железа, сульфата железа (II), родонида аммония (или калия), нитрата ртути (II), йодида калия, хлорида кобальта (II), железоаммонийных квасцов, гидроксида калия, хлорида бария, сульфида аммония, оксалата аммония, гексацианоферрата (II) калия, гексацианоферрата (III) калия.
Х о д р а б о т ы
Получение катионных комплексных соединений
Опыт 1. Налить в пробирку 8–10 капель раствора сульфата или хлорида меди (II) и добавить по каплям раствор гидроксида аммония до образования зеленовато-голубого осадка основной соли (CuOH)2SO4 или CuOHCl. При последующем добавлении раствора аммиака наблюдать растворение осадка и получение окрашенного раствора комплексной соли [Cu(NH3)4]SO4 или [Cu(NH3)4]Cl2.
Опыт 2. Внести в пробирку 8–10 капель раствора сульфата или хлорида никеля (II) и добавить по каплям раствор аммиака. Обратить внимание на происходящие изменения, связанные с первоначальным образованием осадка основной соли NiOHCl или (NiOH)2SO4 с последующим растворением полученного осадка в избытке аммиака и образованием окрашенного раствора комплексной соли [Ni(NH3)4]Cl2 или [Ni(NH3)4]SO4.
Получение анионных комплексных соединений
Опыт 3. Внести в пробирку 10 капель раствора хлорида железа (III) и прибавить по каплям раствор роданида аммония или роданида калия. Что наблюдаете? К полученному раствору роданида железа (III) прилить раствор фторида натрия или аммония. Наблюдать исчезновение окраски раствора вследствие образования комплексного соединения: гексафтороферрата (III) натрия или аммония.
Опыт 4. Внести в пробирку 6–8 капель нитрата ртути (II) и добавить по каплям раствор йодида калия до образования осадка
йодида ртути (II) и последующего его растворения в избытке раствора йодида калия.
Различие между простыми и комплексными ионами
Опыт 5. Налить в пробирку 8–10 капель раствора хлорида железа (III) и прибавить по каплям раствор роданида аммония или роданида калия до появления кроваво-красного окрашивания раствора, свидетельствующего о наличии в растворе ионов Fe3+. В другую пробирку внести раствор K3[Fe(CN)6] и прибавить к нему несколько капель раствора роданида калия (или аммония). Образуется ли при этом раствор темно-красного цвета, свидетельствующий о присутствии в растворе иона Fe3+?
Разрушение комплексных ионов при разбавлении растворов
Опыт 6. Налить в пробирку 10–12 капель раствора хлорида кобальта (II) и прибавить несколько капель концентрированного раствора роданида калия (или аммония). Наблюдать появление окрашенного раствора вследствие образования комплексного соединения K2[Со(CNS)4]. Полученный раствор разбавить водой до появления первоначальной розовой окраски, характерной для ионов Со2+.
Диссоциация двойных солей
Опыт 7. В три пробирки внести по 10–12 капель раствора железоаммонийных квасцов NH4Fe(SO4)2. В первую пробирку прилить несколько капель раствора роданида калия (или аммония). Окрашивание раствора в темно-красный цвет указывает на присутствие в растворе ионов Fe3+. Во вторую пробирку добавить избыток раствора гидроксида калия или натрия, содержимое пробирок нагреть. Выделение аммиака свидетельствует о наличии в первоначальном растворе ионов NH  . В третью пробирку прибавить несколько капель раствора хлорида бария. Образование белого осадка свидетельствует о присутствии в исходном растворе ионов SO
. В третью пробирку прибавить несколько капель раствора хлорида бария. Образование белого осадка свидетельствует о присутствии в исходном растворе ионов SO  .
.
Разрушение комплексного иона осаждением
комплексообразователя
Опыт 8. В две пробирки внести по несколько капель сульфата меди. В первую пробирку добавить такой же объем раствора оксалата аммония, а во вторую – сульфида аммония. Отметить цвет появившихся в пробирках осадков. Пробирки с осадками сохранить в качестве контрольных образцов.
В двух других пробирках получить комплексное соединение меди: прибавить к 6–8 каплям раствора сульфата меди (II) раствор аммиака до растворения образовавшегося вначале осадка основной соли меди. Далее в одну из пробирок с комплексной солью прилить раствор оксалата аммония, а в другую – раствор сульфида аммония. В каком случае выпадает осадок? Полученный осадок сравнить с осадками в контрольных пробирках.
Комплексные соединения в реакциях обмена
Опыт 9. В пробирку внести несколько капель раствора гексацианоферрата (II) калия, затем добавить несколько капель раствора хлорида железа (III). Наблюдать образование осадка комплексной соли железа (III) (берлинской лазури). Эта реакция является качественной для иона Fe3+.
Налить в пробирку несколько капель раствора гексацианоферрата (III) калия и добавить несколько капель раствора сульфата железа (II). Наблюдать образование осадка комплексной соли железа (II) (турнбулевой сини). Эта реакция является качественной для иона Fe2+.
Обработка экспериментальных данных
Опыт 1. Написать уравнения реакций в молекулярном и ионно-молекулярном виде. Указать цвет осадков и растворов. Назвать полученные соединения.
Опыт 2. Составить уравнения реакций в молекулярном и ионно-молекулярном виде. Описать цвета осадков и растворов. Назвать полученные соединения.
Опыт 3. Написать уравнения реакций в молекулярной и ионно-молекулярной форме, указать цвета полученных соединений.
Опыт 4. Составить уравнения реакций в молекулярном и ионно-молекулярном виде. Указать цвета осадка и раствора. Назвать продукты реакций. Указать, к какому типу относится полученное комплексное соединение.
Опыт 5. Написать уравнение реакции взаимодействия раствора хлорида железа (III) с роданидом аммония. Составить уравнение диссоциации комплексного соединения и выражение константы нестойкости комплексного иона. Сделать вывод о различии между простыми и комплексными ионами.
Опыт 6. Написать уравнение реакции получения комплекса. Назвать полученный комплекс, определить, к какому классу его можно отнести. Составить уравнение диссоциации комплексного соединения и выражение константы нестойкости комплексного иона. Как влияет концентрация раствора на устойчивость комплексного соединения?
Опыт 7. Составить в молекулярной и ионно-молекулярной форме реакции взаимодействия двойной соли с растворами: роданида аммония, гидроксида калия (или натрия), хлорида бария. Написать уравнение диссоциации двойной соли. Сделать вывод о различии между комплексными и двойными солями.
Опыт 8. Записать реакцию образования аммиачного комплекса меди (II). Составить уравнение реакции взаимодействия комплексной соли с сульфидом аммония. Что происходит с комплексным ионом в каждом случае? Объяснить, почему не выпал осадок в случае прибавления оксалата аммония. При объяснении воспользоваться значениями произведения растворимости образующихся осадков (см. прил. 2). Константу нестойкости иона [Co(NH3)6]2+ принять равной  .
.
Опыт 9. Записать уравнения реакций в молекулярной и ионно-молекулярной форме. Назвать полученные комплексные соединения.
Контрольные задания
Вариант 1
1. Назвать комплексные соли: [Pd(H2O)(NH3)2Cl]Cl, Ba[Cr(NH3)2(SCN)4]2, [Cr(H2O)4PO4]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
2. Написать координационные формулы комплексных соединений: а) тетрабромоплатинат (II) калия; б) диамминтрихлоронитро-
платины; в) сульфат пентаамминбромокобальта (III). В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
3. Вычислить концентрацию ионов Ag+ в 0,1 М растворе [Ag(NH3)2]NO3, содержащем в избытке 1 моль/л NH3. Константа нестойкости иона [Ag(NH3)2]+ равна 9,3 ∙ 10–8.
Вариант 2
1. Написать координационные формулы комплексных соединений: а) дицианоаргентат калия; б) тетраамминфосфатохрома;
в) нитрат диакватетраамминникеля (II). В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
2. Назвать комплексные соли: Na3[Co(CN)6], [Со(NH3)5Br]SO4, [Cr(NH3)4PO4]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
3. Константа нестойкости иона [Ag(СN)2]– составляет 1,1 ∙ 10–21. Вычислить концентрацию ионов серебра в 0,05 М растворе K[Ag(СN)2], содержащем 0,01 моль/л KСN.
Вариант 3
1. Назвать комплексные соли: [Сu(NH3)4](NO3)2, [Pt(NH3)2Cl4], (NH4)2[Pt (OH)2Cl4]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
2. Написать координационные формулы комплексных соединений: а) дигидроксотетрахлороплатинат (IV) аммония; б) триамминтрихлороиридия; в) нитрат пентаамминроданокобальта (III). В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
3. Вычислить концентрацию ионов кадмия в 0,1 М растворе K2[Сd(CN)4], содержащем 6,5 г/л KСN. Константа нестойкости иона [Сd(CN)4]2– равна 1,4 ∙ 10–17.
Вариант 4
1. Написать координационные формулы комплексных соединений: а) хлорид гексаамминникеля (II); б) гексанитрокобальтат (III) калия; в) диамминдихлороплатины. В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
2. Назвать комплексные соли: K3[Fe(CN)5NH3], [Со(NO2)2Cl(NH3)3], [Аg(NH3)2]Cl. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
3. Вычислить массу ионов серебра в 0,5 л 0,1 М раствора Na3[Ag(S2O3)2], содержащего 0,1 моль/л тиосульфата натрия Na2S2O3. Константа нестойкости иона [Ag(S2O3)2]3– равна 1,1 ∙ 10–13.
Вариант 5
1. Назвать комплексные соли: [Co(H2O)(NH3)4CN]Br2, K4[Fe(CN)6], [Cu(NH3)2(SCN)2]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
2. Написать координационные формулы комплексных соединений: а) диамминтерароданохромат (III) бария; б) триамминтригидроксокобальта; в) иодид пентаамминакваиридия (III). В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
3. Выпадет ли осадок AgBr при прибавлении к 1 л 0,1 М раствора [Ag(NH3)2]NO3 1∙10–5 моль KBr? ПР(AgBr) = 6 ∙ 10–13. Константа нестойкости иона [Ag(NH3)2]+ равна 9,3 ∙ 10–8.
Вариант 6
1. Написать координационные формулы комплексных соединений: а) гексацианохромат (III) натрия; б) триамминтрихлорокобальта; в) бромид триамминбромоплатины (II). В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
2. Назвать комплексные соли: [Fe(Н2О)6]SО4, K[Ag(CN)2], [Сr(H2O)3F3]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
3. Сколько граммов NaCl необходимо добавить к 1 л 0,08 М раствора [Ag(NH3)2]NO3, чтобы выпал осадок AgCl. Константа нестойкости иона [Ag(NH3)2]+ равна 9,3 ∙ 10-8, а произведение растворимости хлорида серебра ПР(AgСl) = 1,8 ∙ 10-10.
Вариант 7
1. Назвать комплексные соли: [Co(NH3)5SO4]NO3, K2[Cu(CN)4], [Pt(NH3)2Cl2]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
2. Написать координационные формулы комплексных соединений: а) триамминсульфитоплатины; б) нитрат тетраамминдихлорородия (III); в) моноамминпентацианоферрат (II) натрия. В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
3. Константа нестойкости иона [Zn(СN)4]2– составляет 2,0 ∙ 10–17. Вычислить концентрацию ионов цинка в 0,01 М растворе K2[Zn(СN)4], содержащем 0,01 моль/л KСN.
Вариант 8
1. Написать координационные формулы комплексных соединений: а) сульфат тетраамминкарбонатохрома (III); б) гексацианоферрат (III) калия; в) диамминтетрахлороплатины. В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
2. Назвать комплексные соли: [Pt(NH3)3Cl]Cl, Na[PdI4], [Cr(H2O)2(C2O4)2]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
3. Выпадет ли осадок AgI при прибавлении к 1 л 0,1 М раствора [Ag(NH3)2]NO3 1 ∙ 10–6 моль KI? ПР(AgI) = 1,1 ∙ 10–16. Константа нестойкости иона [Ag(NH3)2]+ равна 9,3 ∙ 10–8.
Вариант 9
1. Назвать комплексные соли: [Pd(NH3)3Cl]Cl, Na3[Co(CN)6], [Rh(NH3)3(NO2)3]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
2. Написать координационные формулы комплексных соединений: а) пентаамминфосфатокобальта; б) бромид гексаамминосмия (III); в) гексацианоферрат (II) калия. В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
3. Константы нестойкости ионов [Ag(NH3)2]+ и [Ag(СN)2]– равны 9,3 ∙ 10–8 и 1,1 ∙ 10–21 соответственно. Вычислить массу ионов серебра в 0,5 л 0,1 М растворов.
Вариант 10
1. Написать координационные формулы комплексных соединений: а) трифторогидроксобериллат магния; б) бромид гексаамминкобальта (III); в) диамминтетраиодоплатина. В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
2. Назвать комплексные соли: [Co(NH3)5Cl]Cl2, K2[Co(NH3)2(NO2)4], [Cr(H2O)4Cl2]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
3. При какой концентрации ионов S2– начнет выпадать осадок CdS из 0,05 М раствора К2[Cd(СN)4], который содержит 0,1 моль КСN в 1 л раствора? ПР(CdS) = 7,9 ∙ 10–27, константа нестойкости иона [Cd (СN)4]2– равна 1,4 ∙ 10–17.
Вариант 11
1. Назвать комплексные соли: К2[Pd(NО2)Cl3], [Fe(H2O)6]Cl3, [Rh(NH3)3(CN)3]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
2. Написать координационные формулы комплексных соединений: а) гексаиодоплатинат (IV) калия; б) триоксалатоалюминат аммония; в) тетрахлороцинкат натрия. В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
3. При какой концентрации ионов Cl– начнет выпадать осадок AgCl из 0,1 М раствора [Ag(NH3)2]NO3, содержащего 1 моль NH3 в 1 л раствора? ПР(AgСl) = 1,8 ∙ 10–10. Константа нестойкости иона [Ag(NH3)2]+ равна 9,3 ∙ 10–8.
Вариант 12
1. Написать координационные формулы комплексных соединений: а) сульфат бромопентаамминхрома (III); б) хлорид дихлороакватриамминкобальта (III); в) тетрацианоаурат (III) натрия. В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
2. Назвать комплексные соли: [Ti(H2O)5Br2]Br, Na4[Fe(CN)6], K2[Pt(C2O4)Cl2]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
3. Вычислить концентрацию ионов Нg2+ в 0,01 М растворе K2[НgСl4], содержащем 0,1 моль/л КCl. Константа нестойкости иона [HgCl4]2– равна 8,5 ∙ 10–16.
Вариант 13
1. Назвать комплексные соли: (NH4)5[Ir(SО3)2Cl4], [Co(NH3)3Cl3], K3[AlF3]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
2. Написать координационные формулы комплексных соединений: а) пентакарбонилжелезо (0); б) тетратиоцианокобальтат (II) водорода; в) нитрат дибромотетраамминхрома (III). В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
3. Вычислить концентрацию ионов Сu2+ в 0,001 М растворе Na2[Cu(CN)4], содержащем 0,01 моль/л КCN. Константа нестойкости иона [Cu(CN)4]2– равна 5,0 ∙ 10–28.
Вариант 14
1. Написать координационные формулы комплексных соединений: а) пентахлороакваиридат (III) калия; б) бромид хлородиакватриамминкобальта (III); в) дихлороамминкарбонилплатина (II). В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
2. Назвать комплексные соли: [Cr(NH3)4CO3]Cl, Na3[Ag(S2O3)2], [Sn(H2O)2Cl2]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
3. Выпадет ли осадок СuS при прибавлении к 1 л 0,001 М раствора K2[Cu(CN)4] 1∙10–5 моль K2S? ПР(CuS) = 6,0 ∙ 10–36. Константа нестойкости иона [Сu(CN)4]2– равна 5,0 ∙ 10–28.
Вариант 15
1. Назвать комплексные соли: Na[Cr(NH3)2(SCN)2], [Co(H2O)5NH3](NO3)3, [Pt(NH3)4Cl2]. В каждом комплексе указать степень окисления комплексообразователя. Написать уравнения первичной и вторичной диссоциации этих веществ в водных растворах.
2. Написать координационные формулы комплексных соединений: а) трихлоротриамминиридий (III); б) хлоридгексаамминкобальта (III); в) гексафтороалюминат натрия. В каждом комплексе указать степень окисления комплексообразователя и записать выражение для константы нестойкости.
3. Константа нестойкости иона [Zn(NH3)4]2+ составляет 3,5 ∙ 10–10. Вычислить массу и концентрацию ионов цинка в 2 л 0,1 М раствора [Zn(NH3)4]Cl2, который содержит 1 моль NH3 в 1 л раствора.
Работа 5
ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДЫ
Цель работы: получить общие представления о жесткости воды и методах ее определения. Экспериментально определить жесткость анализируемой воды и классифицировать ее по величине жесткости.






