| Формула соли | Температура, ºC | K г | Значение рН | |
| расчетное | экспериментальное | |||
|
| Т начальная | |||
| 70 | ||||
| 80 | ||||
Опыт 6. Смещение равновесия при изменении концентрации раствора.
1. Получить (по указанию преподавателя) навеску одной из солей (m 2): карбоната натрия, хлорида алюминия, фосфата натрия, сульфата цинка, хлорида аммония.
2. Растворить навеску соли в мерной колбе вместимостью 100 см3 (раствор № 1).
3. Рассчитать молярную концентрацию раствора № 1 по формуле
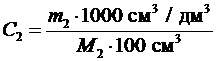 ,
,
где M 2 – молярная масса растворенной соли, г/моль. Данные внести в табл. 6.
4. Разбавить раствор № 1 в 10 раз (раствор № 2).
5. Разбавить раствор № 1 в 100 раз (раствор № 3).
6. Измерить рН растворов № 1, 2 и 3. Данные занести в табл. 6.
Таблица 6
Экспериментальные и расчетные данные
| Формула соли | Номер раствора | Концентрация соли, моль/дм3 | Значение рН | K г | |
| расчетное | экспериментальное | ||||
|
| 1 |
| |||
| 2 | |||||
| 3 | |||||
Обработка экспериментальных данных
Часть 1. Определение среды растворов различных солей
Опыт 1. Ответить на поставленные вопросы. Написать уравнения диссоциации данных солей, указать среду растворов. Какой вид гидролиза происходит в каждом случае?
Опыт 2. Ответить на поставленные вопросы. Составить ионные и молекулярные уравнения реакций гидролиза для данных солей, указать рН среды.
Опыт 3. Составить ионные и молекулярные уравнения реакций гидролиза для данных солей. Указать среду растворов.
Опыт 4. Ответить на поставленные вопросы. Составить ионное и молекулярное уравнения реакции, учитывая, что гидролиз протекает необратимо.
Часть 2. Смещение гидролитических равновесий
Опыт 5. Смещение равновесие под действием температуры
1.Исходя из концентрации раствора, вычислить значение константы гидролиза K г по формуле (5) при трех температурах. Значение константы диссоциации уксусной кислоты принять равным  , а значение K в дано в прил. 3.
, а значение K в дано в прил. 3.
2. По уравнению (6) рассчитать рН раствора при данных температурах и сравнить его с опытными значениями рН.
3. Расчетные данные занести в табл. 5.
4. Составить ионное и молекулярное уравнения реакции гидролиза соли.
5. Заполнить метрологическую карту средств измерения (см. прил. 1) и сформулировать выводы.
Опыт 6. Смещение равновесия при изменении концентрации раствора
1. Исходя из типа гидролиза, которому подвергается соль, вычислить значение константы гидролиза K г, используя формулу (5) или (7). Значение константы диссоциации слабого электролита дано в прил. 4.
2. Рассчитать рН растворов №1, 2 и 3, используя формулу (6) или (7).
3. Составить ионное и молекулярное уравнение реакции гидролиза соли.
4. Заполнить метрологическую карту средств измерения (см. прил. 1) и сформулировать выводы.
Контрольные задания
Вариант 1
1. Написать молекулярные и молекулярно-ионные уравнения гидролиза солей: нитрата аммония, хлорида хрома (III).
2. Вычислить степень гидролиза по первой ступени и рН среды в 0,1 М растворе гидросульфида натрия.
3. Объяснить, почему при нагревании раствора гидрокарбоната натрия реакция среды из слабощелочной переходит в сильнощелочную.
Вариант 2
1. Написать уравнения гидролиза и указать рН среды для солей: карбоната франция, сульфита магния.
2. Рассчитать константу и степень гидролиза по первой ступени в 0,5 М растворе фосфата натрия.
3. Объяснить подробно, почему равновесие гидролиза смещается вправо при разбавлении.
Вариант 3
1. Написать уравнения гидролиза в сокращенном ионном виде и указать рН среды для солей: нитрита калия, сульфида свинца (II).
2. Определить степень гидролиза и рН среды в 0,01 н растворе ацетата калия.
3. Какая соль железа гидролизуется сильнее: FeCl2 или FeCl3. Почему?
Вариант 4
1. Написать молекулярно-ионные формы уравнений гидролиза и указать рН среды для солей сульфата кобальта (II), хлорида алюминия.
2. Вычислить константу и степень гидролиза ацетата натрия в 0,01 М растворе.
3. Реакция среды водного раствора хлорида магния нейтральна. О чем это говорит?
Вариант 5
1. Написать уравнения гидролиза и указать рН среды для растворов: сульфида натрия, гидросульфида калия.
2. Рассчитать степень гидролиза по первой ступени и рН в 0,1 М растворе гидросульфида натрия.
3. При смешивании растворов трихлорида хрома и карбоната натрия образуется осадок. Написать соответствующие уравнения, указать, что выпадает в осадок.
Вариант 6
1. Составить уравнения гидролиза солей и указать рН среды сульфида лития, карбоната калия.
2. Определить степень гидролиза и рН в 0,005 н растворе цианида калия.
3. В какую сторону сместится гидролитическое равновесие при смешивании растворов карбоната натрия и сульфата аммония?
Вариант 7
1. Написать уравнения гидролиза и укажите рН среды для солей хлорида кобальта (II) и нитрита натрия.
2. Вычислить константу и степень гидролиза по первой ступени для 0,2 М раствора карбоната натрия.
3. При смешивании растворов сульфата алюминия и сульфида калия в осадок выпадает гидроксид алюминия. Указать причину этого и составить соответствующие молекулярные и молекулярно-ионные уравнения.
Вариант 8
1. Написать уравнения гидролиза в сокращенном ионном виде и указать рН среды для солей ацетата кальция и карбоната натрия.
2. Вычислить рН среды для 0,02 М раствора ацетата калия.
3. Почему раствор гидрокарбоната натрия имеет слабощелочную среду, а раствор гидросульфата натрия – слабокислую среду?
Вариант 9
1. Написать уравнения гидролиза в сокращенном ионном виде и указать рН среды для солей хлорида меди (II), нитрата свинца (II).
2. Вычислить константу и степень гидролиза 0,05 М раствора формиата натрия.
3. Зависит ли рН раствора гидролизующейся соли от ее концентрации? Ответ пояснить.
Вариант 10
1. Написать молекулярные и молекулярно-ионные уравнения гидролиза солей нитрата хрома (III), хлорида аммония.
2. Вычислить константу и степень гидролиза цианида калия в 0,1 М растворе.
3. Можно ли сместить вправо равновесие реакций гидролиза увеличением концентрации соли.
Вариант 11
1. Написать уравнения гидролиза в сокращенном ионном виде и указать рН среды для солей сульфита лития, гидрокарбоната калия.
2. Вычислить константу гидролиза и степень гидролиза для 0,02 М раствора ацетата лития.
3. От чего зависит рН среды при растворении различных солей в воде.
Вариант 12
1. Написать уравнения гидролиза и указать рН среды для солей сульфита франция, хлорида железа (III).
2. Определить рН в 0,02 н раствора соды, полагая, что гидролиз идет только по первой ступени.
3. Почему раствор соли NaH2PO4 имеет кислую среду, а раствор соли KHS – щелочную?
Вариант 13
1. Написать уравнения гидролиза и указать рН среды для солей сульфата алюминия, сульфата натрия.
2. Константа диссоциации хлорноватистой кислоты равна 3 · 10-8. Определить константу и степень гидролиза 0,01 н раствора гипохлорита натрия.
3. Какими способами можно сместить равновесие данной реакции гидролиза вправо?
СО  + Н2О = НСО
+ Н2О = НСО  + ОН– .
+ ОН– .
Вариант 14
1. Написать уравнения гидролиза и указать рН среды для солей карбоната рубидия, нитрата аммония.
2. Определить рН и степень гидролиза раствора гипохлорита натрия с концентрацией 0,001 н.
3. Почему водный раствор AlCl3 имеет кислотную реакцию, хотя это вещество не содержит атомов водорода?
Вариант 15
1. Написать уравнения гидролиза и указать рН среды для солей цианида аммония, сульфата железа (III).
2. Определить степень гидролиза и рН 0,05 М раствора цианида калия.
3. Разбавленные растворы иодида лития и фторида цезия нейтральны. По мере повышения концентрации раствор иодида лития показывает кислотную реакцию, а раствор фторида цезия – щелочную. Почему?
Работа 4
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Цель работы: формирование теоретических представлений и практических навыков о свойствах и методах получения комплексных соединений.






