Жесткость – это один из технологических показателей, принятых для характеристики состава и качества природных вод. Она представляет собой совокупность свойств воды, обусловленных присутствием в ней:
– катионов Са2+, Mg2+ и Fe2+;
– анионов HCO  , SO
, SO 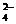 , NO
, NO  , Сl–, РО
, Сl–, РО 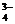 и др.
и др.
Количественно жесткость может быть выражена числом граммов катионов кальция и магния, содержащихся в 1 дм3 воды. Однако чаще пользуются специальными единицами жесткости – миллимолями (ммоль) или миллиэквивалентами (мэкв).
1 мэкв ионов Са2+ или Mg2+ равен одной тысячной мольной массы их эквивалентов, содержащейся в 1 дм3 раствора. То есть 1 мэкв жесткости соответствует содержанию 20,04 мг/дм3 ионов Са2+ или 12,16 мг/дм3 ионов Mg2+.
По значению жесткости природную воду делят на:
l) очень мягкую – жесткость менее 1,5 мэкв/дм3 (например, дождевая вода);
2) мягкую – жесткость лежит в пределах от 1,5 мэкв/дм3 до 3,0 мэкв/дм3;
3) средней жесткости – значение жесткости равно 3,0 ÷ 6,0 мэкв/дм3;
4) жесткую – жесткость равна 6,0 ÷ 9,0 мэкв/дм3;
5) очень жесткую – жесткость более 9 мэкв/дм3 (например, морская вода).
Жесткая вода образует накипь на стенках нагреваемых сосудов, что существенно ухудшает их теплотехнические характеристики. Катионы Са2+ и Mg2+ под действием анионов жирных кислот мыла (например, стеарат натрия С17Н35СООNа) образуют малорастворимые соли, мешающие моющему действию мыла и увеличивающие его расход. При этом протекают следующие реакции:
2 С17Н35СОО– + Са2+ = (С17Н35СОО)2Са;
2 С17Н35СОО– + Mg2+ =(C17H35COO)2Mg.
Жесткая вода непригодна для производства бумаги, для крашения тканей, приготовления пищи, напитков и т.д. Питьевая вода должна иметь жесткость не выше 7 мэкв/дм3; особенно нежелательно присутствие катионов магния, которые придают воде горький вкус.
Различают временную (иначе карбонатную)жесткость Жвр , обусловленную наличием в воде гидрокарбоната кальция Са(НСО3)2 и гидрокарбоната магния Mg(HCO3)2, и постоянную (иначе некарбонатную) жесткость Жпост , связанную с наличием в воде сульфатов и хлоридов кальция и магния (CaSO4, СаС12, MgSO4, MgCl2). Сумма временной и постоянной жесткостей составляет общую жесткость воды Жобщ.
Анализ воды на жесткость обычно предполагает определение временной, общей и постоянной жесткости.
Определение временной жесткости
Вода, содержащая ионы HCO  , СO
, СO 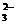 , Mg2+ и Ca2+, имеет щелочную реакцию, следовательно, мерой жесткости может служить щелочность воды. Поэтому определение временной жесткости можно провести методом прямого кислотно-основного титрования. В этом случае воду титруют стандартизированным раствором соляной кислоты в присутствии индикатора метилового оранжевого. При этом протекает следующий комплекс реакций:
, Mg2+ и Ca2+, имеет щелочную реакцию, следовательно, мерой жесткости может служить щелочность воды. Поэтому определение временной жесткости можно провести методом прямого кислотно-основного титрования. В этом случае воду титруют стандартизированным раствором соляной кислоты в присутствии индикатора метилового оранжевого. При этом протекает следующий комплекс реакций:
HCO  + Н+ = Н2О + СО2 ↑;
+ Н+ = Н2О + СО2 ↑;
Са(НСО3)2 + 2НС1 = СаСl2 + 2СО2 ↑ + 2Н2О;
Mg(HCO3)2 + 2HCl = MgCl2 + 2СО2 ↑ + 2Н2О.
Определение общей жесткости методом комплексонометрии
Метод основан на способности комплексного соединения этилендиаминтетраацетат (ЭДТА) натрия, которое также называют трилоном Б или комплексоном III, взаимодействовать с ионами Са2+, Mg2+, Fe2+ и т.д. с образованием комплексного соединения вида
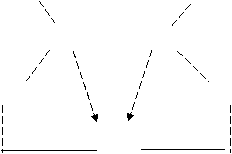 HOOCH2C CH2COOH
HOOCH2C CH2COOH
N-CH2- CH2-N
OOCH2C CH2COO
Ca
При определении общей жесткости исследуемый образец воды титруют раствором трилона Б в присутствии индикатора эриохром черный Т, который окрашивает раствор в малиновый цвет. В точке эквивалентности происходит разрушение комплекса с индикатором и образование комплекса с трилоном Б, в результате чего окраска раствора изменяется на сине-голубую. Постоянную жесткость определяют по разности между общей и временной жесткостью.
Методы устранения жесткости
Использование природной воды в технике требует ее предварительной очистки, в том числе умягчения (снижения жесткости до определенной нормы).
Временная жесткость устраняется простым кипячением, так как при нагревании происходит разложение гидрокарбонатов кальция и магния
|
Са(НСО3)2 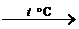 СаСО3 + Н2О + СО2 ,
СаСО3 + Н2О + СО2 ,
|
Mg(HCO3)2 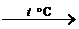 Mg(OH)2 + 2CO2.
Mg(OH)2 + 2CO2.
С ионами Fe2+ реакция происходит сложнее из-за того, что FeCO3 представляет собой неустойчивое в воде вещество, переходящее в результате гидролиза и последующего окисления на воздухе в Fe(OH)3. Чем больше в воде железа, тем более бурым цветом обладает накипь.
Устранить временную жесткость можно также действием гидроксида кальция или соды:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О,
Са(НСО3)2 + Na2CO3 = CaCO3 + 2NaHCO3.
Постоянную жесткость устраняют, добавляя к воде соду, при этом протекает следующий процесс:
CaSO4 + Na2CO3 = СаСО3 + Na2SO4.
Таким образом, сода устраняет и временную, и постоянную жесткость, а Са(ОН)2 – только временную.
В промышленности для умягчения воды пользуются цеолитами, в частности, алюмосиликатом натрия. При пропускании воды через его слой происходит обмен катионов Са2+ и Mg2+ на катионы Na+
2NaAlSi2O6, тв + Са2+ = Ca(AlSi2O6)2, тв + 2Na+.
Для той же цели пользуются ионообменными фильтрами на основе различных полимеров, в частности, полистирола RSO3H и RSO3Na:
2RSO3Na тв + Са2+ = (RSO3)2Ca тв + 2Na+.
Порядок выполнения работы
Приборы и реактивы: бюретка вместимостью 25 см3, колбы конические вместимостью 250 см3, мерная колба вместимостью 100 см3, мерный цилиндр вместимостью 25 см3, стаканы химические вместимостью 50 см3, капельница, резиновая груша, бумага фильтровальная; 0,1 М растворы титрантов: хлороводородной кислоты и трилона Б; аммиачно-буферный раствор (рН = 9÷10), анализируемая вода, раствор метилового оранжевого, дистиллированная вода.
Х о д р а б о т ы
Часть 1. Определение временной жесткости воды
1. Раствор хлороводородной кислоты (иначе титранта) с молярной концентрацией эквивалента С э (НCl) = 0,1 моль/дм3 перелить в химический стакан и заполнить им бюретку до нулевой отметки по нижнему уровню жидкости.
2. С помощью мерной колбы отобрать 100 см3 анализируемой воды и перенести в коническую колбу для титрования.
3. Из капельницы к отобранному раствору добавить 3 капли индикатора метилового оранжевого. Содержимое колбы перемешать.
4. Полученный анализируемый раствор оттитровать из бюретки раствором титранта до точки эквивалентности, то есть до изменения окраски раствора с оранжево-желтой на оранжево-красную.
5. Записать объем титранта, израсходованный на титрование, по бюретке в табл. 7.
6. Повторить титрование дважды.
Таблица 7






