Гидролизом соли называют процессвзаимодействия ионов соли с молекулами воды, который сопровождается изменением рН раствора. Гидролиз протекает только тогда, когда при взаимодействии ионов соли и воды образуются малодиссоциированные вещества. Известны следующие виды гидролиза солей.
Гидролиз по аниону
В этом случае гидролизуются соли сильного основания и слабой кислоты, при этом реакция среды становится щелочной (рН > 7).
Например:
СН3СООK ® СН3СОО – + K+;
K+ + HOH®реакция практически не идет;
СН3СОО – + HOH Û СН3СООН + ОН –,рН > 7.
Молекулярное уравнение гидролиза имеет вид
СН3СООK + HOH Û СН3СООН + KОН.
Если анион многозарядный, то гидролиз протекает ступенчато.
Например:
Na2S + HOH Û NaHS + NaOH;
I ступень гидролиза: S2– + HOH Û HS – + OH –;
II ступень гидролиза: HS – + HOH Û H2S + OH –.
Накапливающиеся в растворе ионы ОН –препятствуют протеканию II ступени гидролиза, поэтому практически гидролиз идет только по I ступени.
Гидролиз по катиону
В этом случае гидролизуются соли слабого основания и сильной кислоты, при этом реакция среды становится кислой (рН < 7).
Например:
NH4Cl ® NH4+ + Cl – ;
Cl – + HOH ® реакция практически не идет;
NH4+ + HOH Û NH4OH + H+, рН < 7.
Молекулярное уравнение гидролиза
NH4Cl + HOH Û NH4OH + HCl.
Гидролиз по катиону и аниону одновременно
Такому виду гидролиза подвергаются соли слабого основания и слабой кислоты. В реакции участвуют и катион, и анион соли. Реакция среды определяется относительной силой образующихся слабой кислоты и слабого основания. При этом возможны три случая:
– если константа диссоциации кислоты K кислоты больше константы диссоциации основания K осн, то преобладает гидролиз по катиону и рН < 7;
– если K кислоты < K осн , то преобладает гидролиз по аниону и рН > 7;
– если K кислоты» K осн , то рН» 7.
Необратимый полный гидролиз
Если кислота и основание, образующие соль, являются не только слабыми электролитами, но и малорастворимы в воде или неустойчивы и разлагаются с образованием газообразных продуктов, то гидролиз, как правило, протекает практически необратимо.
Например:
Al2S3 + 6HOH ® 2Al(OH)3¯ + 3H2S ;
2Al3+ + 3S2– + 6HOH ® 2Al(OH)3¯ + 3H2S .
Количественными характеристиками глубины протекания гидролиза являются степень гидролиза h и константа гидролиза K г.
Степень гидролиза h показывает,какая часть соли находится в гидролизованном состоянии и выражается в долях единицы или в процентах
h = С г/ С 2,
где С г – концентрация гидролизованной части соли, моль/дм3; С 2– общая концентрация растворенной соли, моль/дм3.
Расчет константы гидролиза K г, степени гидролиза h и рН раствора следует вести по формулам:
1) при гидролизе по аниону
K г = 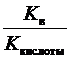 ; h =
; h = 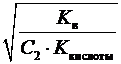 =
=  , (5)
, (5)
где K кислоты – константа диссоциации слабой кислоты; K в – ионное произведение воды.
рН = 14 + lg 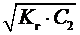 ; (6)
; (6)
2) при гидролизе по катиону
K г =  ; h =
; h = 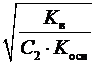 =
=  ; рН = –lg
; рН = –lg 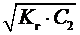 , (7)
, (7)
где K осн – константа диссоциации слабого основания;
3) при гидролизе по катиону и аниону одновременно:
K г = 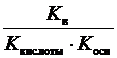 ; h =
; h =  ; рН = –lg
; рН = –lg 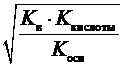 . (8)
. (8)
Гидролиз – это частный случай реакций ионного обмена, поэтому на равновесие этого процесса оказывают влияние все факторы, от которых зависят ионные равновесия. Таким образом, смещение гидролитических равновесий может происходить в следующих случаях:
– при добавлении в равновесную смесь одного из продуктов гидролиза (кислоты при гидролизе по катиону или основания при гидролизе по аниону), тогда в соответствии с принципом Ле Шателье равновесие смещается в обратном направлении, то есть в сторону «подавления» гидролиза соли;
– при уменьшении концентрации соли в растворе (при разбавлении системы) равновесие гидролиза смещается в сторону образования продуктов;
– при нагревании растворов солей гидролиз усиливается.
Порядок выполнения работы
Приборы и реактивы: иономер, стеклянный и хлорсеребряный электроды, магнитная мешалка, стакан химический вместимостью 100 см3, электрическая плитка, термометр, мерные колбы вместимостью 100 см3, штатив с пробирками, пипетка Мора на 10 см3, дистиллированная вода, навески солей: Na2CO3, AlCl3, Na3PO4, ZnSO4, NH4Cl; 5 %-ные растворы солей: KCl, Na2SO4, Na2CO3, Na3PO4, Al2(SO4)3, ZnSO4, Cr2(SO4)3; 0,1 M раствор CH3COONa; индикаторы: растворы фенолфталеина и лакмуса.
Х о д р а б о т ы
Часть 1. Определение среды растворов различных солей
Опыт 1. Налить в две пробирки по 1 см3 растворов солей: хлорида калия и сульфата натрия, а в третью пробирку – дистиллированной воды. В каждую пробирку добавить по 2 капли лакмуса. Как изменился цвет индикатора? Указать среду каждого раствора. Подвергаются ли данные соли гидролизу?
Опыт 2. Налить в две пробирки по 1 см3 растворов карбоната натрия и фосфата натрия, а в третью пробирку – дистиллированной воды. В каждую пробирку добавить по 2 капли фенолфталеина. Оценить окраску и определить среду в каждом растворе. Подвергаются ли данные соли гидролизу?
Опыт 3. Налить в две пробирки по 1 см3 растворов сульфата алюминия и сульфата цинка, а в третью пробирку – дистиллированной воды. В каждую пробирку добавить по 2 капли лакмуса. Отметить, как изменился цвет индикатора, и определить среду в растворах. Подвергаются ли данные соли гидролизу?
Опыт 4. Полный необратимый гидролиз. В пробирку поместить 1 см3 раствора сульфата хрома (III) и прибавить по каплям раствор карбоната натрия до образования осадка малорастворимого соединения. Отметить цвет осадка. Почему при взаимодействии растворов этих солей гидролиз протекает практически необратимо?
Часть 2. Смещение гидролитических равновесий
Опыт 5. Смещение равновесия под действием температуры.
В химический стакан налить 100 см3 0,1 М раствора ацетата натрия. В раствор поместить магнитную мешалку и электроды. Через 1–2 минуты измерить начальную температуру раствора. Измерить значение рН раствора, данные занести в табл. 5. Раствор подогреть до температуры 70 ºC и снова измерить рН раствора. Данные внести в табл. 5. Нагреть раствор еще на 10 ºC, измерить рН и записать значения в табл. 5.
Таблица 5






