Растворимостью называют способность вещества образовывать раствор с данным растворителем, а также количественную характеристику этой способности. Качественно растворимость характеризуется понятиями «хорошо растворимо», «мало растворимо», «нерастворимо».
Количественной мерой растворимости является масса вещества в граммах, которая способна раствориться в 100 г растворителя при данной температуре с образованием насыщенного раствора. Раствор называется насыщенным, если в нем находится предельное при данных условиях количество растворенного вещества. Если в растворе содержится больше растворенного вещества, чем это определяется растворимостью, раствор называется пересыщенным, а если меньше – ненасыщенным.
Электролитами называют вещества, которые в растворе или расплаве полностью или частично распадаются на ионы.Для любого труднорастворимого электролита (Kt) х (Аn) у между его осадком и насыщенным раствором устанавливается равновесие вида
(Kt) х (Аn) у Û x × Kt z + + y × Аn z –.
Осадок Насыщенный раствор
Константа равновесия процесса диссоциации мало растворимого вещества в его насыщенном растворе называется произведением растворимости ПР. По закону действия масс выражение для произведения растворимости примет вид
ПР =  (g + ·[Kt z + ]) x × (g– ·[Аn z – ]) y, (3)
(g + ·[Kt z + ]) x × (g– ·[Аn z – ]) y, (3)
где а +, а – – активности катиона и аниона; g + , g– – коэффициенты активностей катиона и аниона; [Kt z + ], [Аn z – ] – равновесные молярные концентрации ионов, моль/дм3.
Поскольку насыщенный раствор труднорастворимого вещества содержит небольшие количества ионов, то есть является достаточно разбавленным, то при расчете ПР активности ионов можно заменить равновесными концентрациями. Тогда уравнение (3) примет вид
ПР = [ Kt z + ] x × [Аn z – ] y. (4)
Например, для насыщенного раствора хлорида свинца будет справедливо выражение
ПР(PbCl2) = [ Pb2+] × [Cl – ] 2.
В общем случае, как и любая константа равновесия, произведение растворимости зависит от температуры и природы электролита и растворителя.
При определенной температуре ПР электролита есть величина постоянная. Численные значения произведения растворимости некоторых труднорастворимых электролитов при Т = 25 оС приведены в прил. 2.
По значению ПР судят о растворимости электролита: из двух однотипных соединений большей растворимостью обладает то, произведение растворимости которого больше.
Смещение ионных гетерогенных равновесий происходит в соответствии с принципом Ле Шателье, а именно изменение концентрации одноименных ионов вызывает изменение растворимости электролита. Из этой закономерности вытекает следующее:
а) выпадение осадка. Осадок малорастворимого электролита выпадает из пересыщенного раствора. Осадок образуется, если произведение реальных концентраций его ионов в растворе (ПРрасч), определенное по уравнению (4), больше табличного произведения растворимости (ПРтабл). Выпадение осадка продолжается до тех пор, пока раствор не станет насыщенным, то есть ПРрасч =
= ПРтабл;
б) растворение осадка. Осадок малорастворимого электролита будет растворяться в том случае, если раствор над ним станет ненасыщенным, то есть когда ПРрасч < ПРтабл. Этого можно достигнуть разведением раствора, а также удалением или связыванием одного из одноименных ионов в более прочное соединение;
в) полнота осаждения ионов. На практике часто необходимо удалять ионы из раствора путем перевода их в осадок. Для достижения наиболее полного осаждения малорастворимого электролита из его насыщенного раствора следует увеличить в растворе концентрацию каких-либо ионов, входящих в состав этого электролита. При добавлении одноименного иона растворимость данной соли уменьшается. Это значит, что растворимость хлорида серебра, к примеру, в чистой воде выше, чем в водном растворе хлорида натрия;
г) порядок осаждения ионов. Если к раствору, содержащему смесь ионов, осаждаемых одним и тем же ионом-осадителем, добавлять данный ион, то образование осадков малорастворимых электролитов происходит ступенчато: первым осаждается тот электролит, для достижения значения произведения растворимости которого требуется меньшая концентрация добавляемого иона-осадителя.
Например, если к раствору, содержащему смесь ионов Cl–, Br – и I – добавлять катион-осадитель Ag+, то в первую очередь будет осаждаться йодид серебра, так как его произведение растворимости минимально, а хлорид-ион перейдет в осадок в последнюю очередь (см. прил. 2);
д) солевой эффект. Растворимость солей зависит и от добавления электролитов, не имеющих общих с ними ионов. Растворимость возрастает с увеличением ионной силы раствора. Причина этого явления, называемого солевым эффектом, вызвана понижением коэффициентов активности ионов, входящих в состав труднорастворимой соли из-за роста сил межионного взаимодействия.
Порядок выполнения работы
Приборы и реактивы: центрифуга, конические пробирки, стеклянные палочки, пипетки, сероводородная вода, 2 н растворы электролитов: HNO3, HCl, CH3COOH, NaOH, NH4Cl; 1 н растворы электролитов: AgNO3, (NH4)2S; 0,5 н растворы электролитов: NaCl, Na2SO4, Na2CO3, CaCl2, KI, CuSO4, FeSO4, Pb(NO3)2, K2CrO4, (NH4)2C2O4.
Х о д р а б о т ы
Изучение условий выпадения осадка
Опыт 1. В две пробирки внести по 2–3 капли раствора сульфата двухвалентного железа. В одну из них добавить такой же объем сероводородной воды, в другую – раствор сульфида аммония. Что происходит в обоих случаях?
Дробное осаждение
Опыт 2. В одну пробирку внести 2 капли раствора хлорида натрия, в другую – столько же раствора йодида калия. В каждую пробирку добавить по 4 капли раствора нитрата серебра. Описать наблюдаемые явления.
В третью пробирку внести 2 капли раствора хлорида натрия,
2 капли раствора йодида калия, 5 капель воды и 1 каплю азотной кислоты. Раствор перемешать стеклянной палочкой и добавить в него 4 капли раствора нитрата серебра. Снова перемешать раствор и отцентрифугировать осадок. Отметить цвет выпавшего осадка. Отобрать пипеткой жидкость над осадком и перенести ее в чистую пробирку. Пробирку с осадком (пробирку № 1) сохранить.
К полученному раствору опять добавить 4 капли раствора нитрата серебра. Выпавший осадок отделить на центрифуге, отобрать пипеткой жидкую фазу и перенести ее в чистую пробирку, а пробирку с оставшимся осадком (пробирку № 2) сохранить.
К полученному раствору снова прибавить 4 капли нитрата серебра и продолжить осаждение. Операции получения осадка, центрифугирования и отделения жидкой фазы повторять до тех пор, пока не получится чисто-белый осадок.
Зависимость полноты удаления иона от ПР электролита
Опыт 3. Осаждение солей кальция. В пробирку внести 4 капли раствора хлорида кальция, затем добавить 6 капель раствора сульфата натрия. Раствору дать постоять 2–3 мин для более полного выпадения осадка сульфата кальция. Смесь отцентрифугировать. Пипеткой отобрать жидкую фазу и перенести ее в две чистые пробирки по 3 капли в каждую. В одну из них добавить 2 капли раствора сульфата натрия, чтобы убедится в полноте осаждения кальция по отношению к этому реактиву, а в другую внести 3–4 капли раствора оксалата аммония. Какое вещество выпадает в осадок?
Опыт 4. Осаждение ионов свинца. В пробирку внести 4 капли раствора нитрата свинца и 6 капель раствора хлорида натрия. Отцентрифугировать осадок. Отобрать пипеткой жидкую фазу и перенести ее в две пробирки по 2–3 капли в каждую. В одну из пробирок добавить 2–3 капли раствора хлорида натрия, в другую – такой же объем раствора йодида калия. Что происходит в обоих случаях?
Р астворение осадков в результате химического взаимодействия
Опыт 5. В две пробирки внести по 3 капли раствора нитрата серебра. В одну из них добавить 3 капли раствора карбоната натрия, в другую – такой же объем хлорида натрия. К обоим осадкам прибавить по 4–5 капель раствора азотной кислоты. Какой из осадков растворяется?
Влияние концентрации иона-растворителя на растворение осадков
Опыт 6. В двух пробирках получить осадок оксалата кальция, внеся в каждую по 2 капли растворов соли кальция и оксалата аммония. Добавить в одну пробирку несколько капель раствора соляной кислоты до полного растворения осадка, а другую – раствор уксусной кислоты. Отметить практическую нерастворимость оксалата кальция в последнем случае.
Влияние ПР электролита на его химическое
взаимодействие
Опыт 7. В одну пробирку внести 2 капли раствора сульфата двухвалентного железа, в другую – 2 капли раствора сульфата меди (II). В каждую пробирку добавить по 2 капли раствора сульфида аммония. К осадкам сульфидов добавить по 5–7 капель раствора соляной кислоты. Какой из сульфидов растворяется?
Получение малорастворимых соединений
из других малорастворимых веществ
Опыт 8. Получение сульфида свинца из сульфата свинца. В пробирку внести 2 капли раствора нитрата свинца (II) и прибавить туда же 3 капли раствора сульфата натрия. Какого цвета осадок образовался? Осадок отцентрифугировать. Отобрать пипеткой жидкую фазу. К осадку добавить 3-4 капли сульфида аммония и перемешать осадок стеклянной палочкой. Как изменился цвет осадка? Какое вещество образовалось?
Опыт 9. Получение хромата свинца из сульфата свинца. Внести впробирку 2 капли раствора нитрата свинца (II) и добавить к нему 3 капли раствора сульфата натрия. Полученный осадок отцентрифугировать. Пипеткой отобрать жидкую фазу. К осадку добавить 3–4 капли раствора хромата калия и перемешать осадок стеклянной палочкой. Как изменился цвет осадка? Какое вещество образовалось?
Обработка экспериментальных данных
Опыт 1. В каком случае выпадает осадок? Написать ионное уравнение реакции. Объяснить выпадение осадка сульфида железа (II) в одном случае и его отсутствие в другом.
Опыт 2. Составить ионные уравнения реакций. Сравнить цвета осадков в порядке последовательности их получения. Описать и объяснить все наблюдаемые явления.
Какие ионы осаждаются ионами серебра в первую очередь: ионы хлора или йода? Объяснить последовательность выпадения из растворов осадков хлорида серебра и йодида серебра, учитывая значение произведений растворимости этих веществ (см. прил. 2).
Опыт 3. Написать ионные уравнения проведенных реакций. Объяснить, почему раствор после удаления из него ионов кальция в виде сульфата дает осадок при добавлении оксалат-ионов. Какой осадитель более полно удалит ионы кальция из раствора: сульфат натрия или оксалат аммония? Ответ пояснить.
Опыт 4. Какая соль выпадает в осадок? Составить ионные уравнения реакций образования полученных солей свинца (II). На основании опыта сравнить значения произведений растворимости этих солей. Проверить свое заключение по табличным данным (см. прил. 2).
Опыт 5. Написать ионные уравнения реакций образования осадков карбоната и хлорида серебра. Составить ионное уравнение реакции растворения одного из осадков в азотной кислоте. Объяснить, почему первый осадок растворяется, а второй осадок не растворяется при взаимодействии с кислотой. Объяснить, при каком условии происходит растворение второго осадка.
Опыт 6. Составить ионное уравнение реакции образования оксалата кальция. Объяснить, почему осадок оксалата кальция растворяется в соляной кислоте и практически не растворяется в уксусной кислоте.
Опыт 7. Написать ионные уравнения реакций получения сульфидов железа (II) и меди (II). Почему один из полученных сульфидов переходит в раствор при взаимодействии с соляной кислотой, а другой не переходит? Составить ионное уравнение соответствующей реакции.
Опыт 8. Написать уравнения реакций получения сульфида свинца (II) и взаимодействия сульфида свинца с сульфидом аммония в молекулярной и ионной формах. Описать все наблюдаемые явления. Объяснить переход одного осадка в другой.
Опыт 9. Написать уравнения реакций получения сульфата свинца (II) и взаимодействия сульфата свинца с хроматом калия в молекулярной и ионной формах. Описать все наблюдаемые явления. Объяснить переход одного осадка в другой.
Контрольные задания
Вариант 1
1. Вычислить равновесную концентрацию ионов F– в моль/л и в г/л в насыщенном растворе PbF2 при 25 оС.
2. Растворимость гидроксида магния при температуре 18 °С равна 1,7 × 10–4 моль/л. Вычислить произведение растворимости Мg(ОН)2.
3. Образуется ли осадок бромида серебра при смешивании равных объемов 0,1 М раствора AgNO3 и 0,01 н раствора NaBr?
Вариант 2
1. Определить произведение растворимости карбоната бария, если растворимость данной соли при 25 оС составляет 1,65 × 10–2 г/л.
2. Произведение растворимости иодида свинца (II) при 20 оС равно 8 × 10–9. Вычислить растворимость соли в моль/л и в г/л.
3. Образуется ли осадок хромата бария при смешивании равных объемов 0,04 н раствора ВаСl2 и 0,01 М раствора K2CrO4?
Вариант 3
1. Найти равновесную концентрацию ионов Ag+ в моль/л и в г/л в насыщенном растворе Ag2SO4 при 25 °С.
2. Растворимость карбоната кальция при температуре 35 оС равна 6,9 × 10–5 моль/л. Вычислить произведение растворимости данной соли.
3. Образуется ли осадок хлорида свинца (II) при смешивании равных объемов 0,1 н раствора Pb(NO3)2 и 0,4 н раствора NaCl?
Вариант 4
1. Вычислить растворимость фосфата кальция в моль/л и в г/л, если произведение растворимости Са3(РО4)2 равно 1 × 10–25.
2. Рассчитать произведение растворимости йодида свинца (II), если растворимость соли при температуре 25 оС равна 6,08 г/л.
3. Образуется ли осадок сульфата серебра при смешивании равных объемов 0,02 М раствора AgNO3 и 1 н раствора серной кислоты?
Вариант 5
1. Одинаковы ли концентрации насыщенных растворов, выраженные в г/дм3, для солей Ag2SO4 и PbCl2? Значения ПР приведены в прил. 2.
2. В 500 мл воды при 18 оС растворяется 0,0166 г Аg2CrO4. Вычислить произведение растворимости соли.
3. К 50 мл 0,001 н раствора НСl добавили 450 мл 0,0001 н раствора нитрата серебра. Выпадет ли осадок хлорида серебра в такой системе?
Вариант 6
1. Найти массу серебра, находящегося в виде ионов, в 1 дм3 насыщенного раствора АgBr. Значение произведения растворимости соли дано в прил. 2.
2. Для растворения 1,16 г РbI2 потребовалось 2 л воды. Вычислить произведение растворимости соли.
3. Образуется ли осадок сульфата кальция при смешивании равных объемов 0,02 н растворов хлорида кальция и сульфата натрия? ПР(CаSO4) дано в прил. 2.
Вариант 7
1. Вычислить объем воды, необходимый для растворения при
25 оС 1 г ВаSO4. Произведение растворимости соли равно 1,1 × 10–10.
2. Чему равно произведение растворимости АgCN, если растворимость соли при 25 оС составляет 1,1 × 10–6 моль/л?
3. Образуется ли осадок при смешивании равных объемов 0,02 М раствора MnSO4 и 0,02 н раствора (NH4)2S? Значение ПР(MnS) дано в прил. 2.
Вариант 8
1. В каком объеме насыщенного раствора Аg2S содержится 1 мг растворенной соли? Произведение растворимости соли равно
6 × 10–50.
2. При некоторой температуре в 6 дм3 насыщенного раствора PbSO4 содержится 0,186 г свинца в виде ионов. Вычислить произведение растворимости соли в данных условиях.
3. Образуется ли осадок хромата бария при смешивании равных объемов 0,02 н раствора ВаСl2 и 0,002 н раствора K2CrO4? Значение ПР(BaCrO4) дано в прил. 2.
Вариант 9
1. Во сколько раз растворимость Fe(OH)2, выраженная в моль/л, больше растворимости Fe(OH)3 при 25 оС? Произведения растворимости гидроксидов даны в прил. 2.
2. В 1 л насыщенного при комнатной температуре раствора AgIO3 содержится 0,044 г соли. Вычислить произведение растворимости соли в указанных условиях.
3. Образуется ли осадок бромида серебра при смешивании равных объемов 0,02 н раствора AgNO3 и 0,2 н раствора КBr? Значение ПР(AgBr) дано в прил. 2.
Вариант 10
1. В каком объеме раствора содержится 0,1 г SrSO4 и 0,56 г ионов Sr2+, если ПР(SrSO4) = 3,2 × 10–7?
2. Рассчитать произведение растворимости Pb3(PO4)2, если растворимость соли при 25 оС составляет 1,2 × 10–7 г на 100 мл воды.
3. Образуется ли осадок при смешивании равных объемов 0,01 н раствора AgNO3 и 0,005 М раствора K2Cr2O7? Произведение растворимости Ag2Cr2O7 равно 2,0 × 10–7.
Вариант 11
1. Вычислить растворимость сульфата бария в моль/дм3 и в г/л. Значение произведения растворимости ВаSО4 дано в прил. 2.
2. В 50 мл насыщенного раствора Ag2CO3 содержится 6,3 × 10–6 г ионов СО 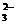 . Рассчитать произведение растворимости Ag2CO3.
. Рассчитать произведение растворимости Ag2CO3.
3. Образуется ли осадок сульфата серебра при смешивании равных объемов 0,08 н раствора AgNO3 и 0,2 н раствора серной кислоты? Значение ПР(Ag2SO4) дано в прил. 2.
Вариант 12
1. Одинаковы ли растворимости, выраженные в моль/л и в г/л, для солей AgSСN и Ag2CrO4? Значения ПР(AgSСN) и ПР(Ag2CrO4) даны в прил. 2.
2. В 100 см3 насыщенного раствора PbI2 содержится 0,0268 г свинца в виде ионов. Рассчитать произведение растворимости PbI2.
3. Оценить минимальную концентрацию NaCl в моль/дм3, при которой прибавление к такому раствору равного объема 0,001 н раствора AgNO3 вызывало бы появление осадка. Значение ПР(AgСl) дано в прил. 2.
Вариант 13
1. Вычислить растворимость AgI в г/л, если произведение растворимости AgI равно 8,3 × 10–17.
2. Насыщенный раствор BaCrO4 содержит 3,0 × 10–6 моль соли в 200 мл раствора. Рассчитать произведение растворимости BaCrO4.
3.Образуется ли осадок хлорида свинца (II) при смешивании равных объемов 0,1 М раствора Pb(NO3)2 и 1,0 М раствора КCl? Зачение ПР(PbCl2) дано в прил. 2.
Вариант 14
1. Произведение растворимости Ag3AsO4 составляет 1,0 × 10–22. В каком объеме насыщенного раствора содержится 6,4 мг растворенной соли?
2. В 500 мл насыщенного раствора Ag2СrO4 содержится 0,008 г ионов серебра. Вычислить произведение растворимости Ag2СrO4.
3. Образуется ли осадок хромата бария при смешивании 100 мл 0,02 н раствора ВаСl2 и 200 мл 0,002 н раствора K2CrO4? ПР(BaCrO4) дано в прил. 2.
Вариант 15
1. Произведение растворимости Ag3PO4 равно 1,3 × 10–20. Вычислить растворимость соли в моль/л и в г/л. В каком объеме насыщенного раствора соли содержится 0,003 г ионов Аg+?
2. Растворимость Fe(OH)2 при 25 оС равна 1,9 × 10–10 моль/л. Рассчитать произведение растворимости гидроксида.
3. Образуется ли осадок хлорида свинца (II) при смешивании 300 мл 0,1 н раствора Pb(NO3)2 и 100 мл 0,4 н раствора NaCl? Значение ПР(PbCl2) дано в прил. 2.
Работа 3
ГИДРОЛИЗ СОЛЕЙ
Цель работы: получить общие представления о гидролизе солей; познакомиться с различными случаями гидролиза; изучить факторы, влияющие на сдвиг гидролитических равновесий.






