| V (Т), см3 | 0 | |||||||||
| рН |
Обработка экспериментальных данных
Часть 1. Определение состава анализируемого раствора методом прямого титрования
1. Найти средний объем титранта 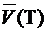 , см3, израсходованный на титрование, по формуле
, см3, израсходованный на титрование, по формуле
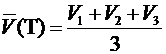 ,
,
где V 1, V 2 и V 3 – объем титранта в см3, определенный в первом, втором и третьем опытах соответственно.
2. Экспериментальную молярную концентрацию эквивалента анализируемого раствора С э(А)эксп, моль/дм3, определить, исходя из уравнения (1), по формуле
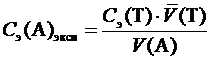 .
.
3. Вычислить относительную погрешность определения концентрации по методу прямого титрования по формуле
П =  . (2)
. (2)
5. Результаты расчетов занести в табл. 2.
6. Заполнить метрологическую карту средств измерения (см. прил. 1) и сформулировать выводы.
Часть 2. Определение состава анализируемого раствора методом потенциометрического титрования.
1. По данным табл. 4 на масштабно-координатной бумаге построить интегральную кривую титрования, откладывая по оси ординат значения рН, а по оси абсцисс – значения объема титранта V (Т) в см3.
2. На графике провести прямую линию (иначе линию нейтральности), параллельную оси абсцисс, при значении рН = 7 до пересечения с кривой титрования. Точка пересечения кривой титрования с линией нейтральности называется точкой нейтральности.
3. На графике провести вторую прямую линию, параллельную оси ординат, через точку нейтральности. Данная линия называется линией эквивалентности.
4. Точка пересечения линии нейтральности с линией эквивалентности – точка эквивалентности. По графику в точке эквивалентности определить объем раствора титранта V (Т) в см3. Данные занести в табл. 3.
5. Экспериментальную молярную концентрацию эквивалента анализируемого раствора С э(А)эксп, моль/дм3, определить, исходя из уравнения (1), по формуле
 .
.
6. Вычислить относительную погрешность определения концентрации методом прямого титрования по формуле (2).
7. Результаты расчетов занести в табл. 3.
8. Заполнить метрологическую карту средств измерения (см. прил. 1) и сформулировать выводы.
Контрольные задания
Вариант 1
1. Сколько литров раствора НCl c эквивалентной концентрацией 0,5 моль/дм3 потребуется для реакции с 5 л раствора NaOH, эквивалентная концентрация которого равна 1,3 моль/дм3.
2. Найти массовое процентное содержание нитрата серебра в растворе, если эквивалентная концентрация такого раствора равна 0,64 моль/дм3. Плотность раствора принять равной 1,088 г/см3.
3. Вычислить молярную концентрацию сульфата калия, в 0,02 л которого содержится 2,74 г растворенного вещества.
Вариант 2
1. На нейтрализацию 1 л раствора, содержащего 25 г Н2SO4, требуется 250 см3 раствора щелочи. Вычислить эквивалентную концентрацию раствора щелочи.
2. Рассчитать молярную и эквивалентную концентрации 49 %-ного раствора фосфорной кислоты, плотность которого равна
1,33 г/см3.
3. К 100 г 25 %-ного раствора прилили 50 г воды. Вычислить процентную концентрацию полученного раствора.
Вариант 3
1. Для нейтрализации 30 мл раствора щелочи с концентрацией 0,15 моль/дм3 потребовалось 12 мл раствора кислоты. Определить концентрацию кислоты.
2. Вычислить молярную и эквивалентную концентрации 96 %-ного раствора серной кислоты (ρ = 1,84 г/см3).
3. Какая масса хлорида бария содержится в 0,025 л раствора с эквивалентной концентрацией 0,25 моль/л.
Вариант 4
1. На нейтрализацию 100 мл раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислить эквивалентную концентрацию раствора кислоты.
2. Определить молярную и эквивалентную концентрации 50 %-ного раствора серной кислоты (ρ = 1,40 г/см3).
3. К 250 г 15 %-ного раствора добавили 100 г воды и 3 г соли. Рассчитать процентную концентрацию полученного раствора.
Вариант 5
1. На нейтрализацию 30 см3 раствора щелочи с эквивалентной концентрацией 0,16 моль/дм3 требуется 217 см3 раствора H2SO4. Вычислить эквивалентную концентрацию раствора H2SO4.
2. Рассчитать молярную и эквивалентную концентрации 10 %-ного раствора хлорида бария (ρ = 1,012 г/см3).
3. В 500 мл раствора содержится 45 г сульфата алюминия. Определить молярную и эквивалентную концентрации раствора.
Вариант 6
1. Какой объем кислоты с эквивалентной концентрацией 0,3 моль/дм3 требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3?
2. Вычислить процентное содержание вещества, растворенного в растворе соляной кислоты с молярной концентрацией 7,98 моль/дм3, плотность которого равна 1,13 г/см3.
3. В 200 мл раствора содержится 9,8 г серной кислоты. Определить молярную и нормальную концентрации этого раствора.
Вариант 7
1. Какой объем раствора кислоты с эквивалентной концентрацией 0,15 моль/дм3 требуется для нейтрализации раствора, содержащего 0,25 г КОН в 60 см3?
2. Вычислить процентную концентрацию 15 н раствора аммиака, плотность которого 0,898 г/см3.
3. Сколько граммов нитрита натрия потребуется для приготовления 300 мл 2 н раствора?
Вариант 8
1. Для нейтрализации 40 см3 раствора HNO3 потребовалось добавить 12 см3 раствора КОН с эквивалентной концентрацией
0,25 моль/дм3. Определить эквивалентную концентрацию раствора HNO3.
2. Вычислить молярную концентрацию 16 %-ного раствора гидроксида натрия (ρ = 1,175 г/мл).
3. В 700 мл раствора содержится 10,6 г карбоната натрия. Определить молярность и нормальность данного раствора.
Вариант 9
1. На нейтрализацию 25 см3 раствора кислоты израсходовали
50 см3 раствора КОН с эквивалентной концентрацией 0,45 моль/дм3. Определить эквивалентную концентрацию кислоты.
2. В 250 мл раствора серной кислоты содержится 98 г серной кислоты. Вычислить нормальность и молярность этого раствора.
3. К 400 г 10 %-ного раствора добавили 100 г воды и 5 г соли. Рассчитать процентную концентрацию полученного раствора.
Вариант 10
1. Какой объем H3PO4 с эквивалентной концентрацией 2 моль/дм3 понадобится для того, чтобы нейтрализовать 35 см3 раствора NaOH с эквивалентной концентрацией 0,4 моль/дм3.
2. Сколько миллилитров 8 н раствора гидроксида натрия можно приготовить из 1 л 42 %-ного раствора гидроксида натрия, плотность которого 1,45 г/см3?
3. Определить процентную концентрацию раствора хлорида натрия, если в 400 г воды растворено 15 г хлорида натрия.
Вариант 11
1. Какой объем раствора H2SO4 c эквивалентной концентрацией 0,21 моль/дм3 потребуется для реакции с 0,55 л раствора KOH, эквивалентная концентрация которого равна 0,3 моль/дм3.
2. Вычислить молярную и эквивалентную концентрации 20 %-ного раствора хлорида кальция, плотность которого равна 1,178 г/см3.
3. Сколько граммов соли и воды содержится в 800 г 12 %-ного раствора нитрата натрия?
Вариант 12
1. Сколько миллилитров NaOН с молярной концентрацией 0,15 моль/дм3 необходимо для взаимодействия со 170 мл раствора HCl с эквивалентной концентрацией 4 моль/дм3.
2. Вычислить молярную и эквивалентную концентрации 16 %-ного раствора хлорида алюминия (ρ = 1,149 г/см3).
3. Сколько граммов вещества следует взять для приготовления
2 л 0,6 М раствора карбоната калия.
Вариант 13
1. Для нейтрализации 25 см3 раствора Н2SO4 с эквивалентной концентрацией 0,6 моль/дм3 потребовалось 14 см3 раствора NaOH. Определить эквивалентную концентрацию раствора NaOH.
2. Вычислить молярную и эквивалентную концентрации раствора серной кислоты с массовой долей 30 % (ρ = 1,219 г/см3).
3. К 100 г 25 %-ного раствора соли прибавили 200 г воды. Определить процентную концентрацию полученного раствора.
Вариант 14
1. Сколько литров раствора НNO3 c эквивалентной концентрацией 0,1 моль/дм3 потребуется для реакции с 0,5 л раствора NaOH c эквивалентной концентрацией раствора 0,3 моль/дм3.
2. Вычислить процентную концентрацию 15 н раствора гидроксида аммония (ρ = 0,898 г/см3).
3. Какая масса хлорида калия содержится в 0,4 л его 0,3 М раствора.
Вариант 15
1. Для нейтрализации 60 см3 раствора Н2SO4 потребовалось 29 см3 раствора NaOH с эквивалентной концентрацией 0,6 моль/дм3. Определить эквивалентную концентрацию раствора кислоты.
2. К 0,5 л раствора серной кислоты (ω = 98 %, ρ = 1837 кг/м3) прибавлено 3 л воды. Какова массовая доля H2SO4 в полученном растворе?
3. Сколько граммов растворенного вещества содержит 1 л 0,2 н раствора сульфата магния?
Работа 2






