Кислоты аскорбиновой 0,05 г
Сахара 0,2 г
Органолептический контроль: белый кристаллический порошок без запаха, однородного смешения.
Физический контроль: отклонение по массе 0,3±10%; 0,3±0,03г
Определение подлинности:
1) Пиридоксин г/х
а) 0,1г порошка растворяют 1-2мл воды и прибавляют 2-3 капли раствора железа хлорида (III). Появляется красное окрашивание.

б) на гидрохлорид
К 0,1 г порошка растворяют 1-2мл воды, прибавляют по 3-5 капель HNO3 разв. и раствора AgNO3. Наблюдается выпадение белого творожистого осадка, растворимого в растворе аммиака.
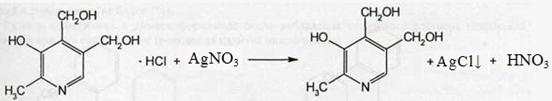
2) Аскорбиновая кислота.
К 0,01г порошка прибавляют 3-5 капель воды и 2-3 капли раствора AgNO3. Выделяется металлическое серебро в виде серого осадка.

3) Сахар
Промывают на фильтре 0,1г порошка 1-2мл воды. К фильтрату прибавляют 1-2мл разв.HCI, несколько кристаллов резорцина и кипятят 1 мин. Появляется красное окрашивание.

Количественное определение:
1) Пиридоксин г/х
Фотоколориметрия. Метод основан на измерении светопоглощения окрашенного соединения в видимой области спектра в соответствии с оптическим законом Бугера - Ламберта - Беера.
0,1г порошка растворяют в 10мл воды. К 2,5мл полученного раствора прибавляют 4,2мл воды и 3,3мл 1% раствора нитрата окисного железа. Через 35-40мин. Измеряют оптическую плотность (Д1) окрашенного раствора при длине волны около 400нм в кювете с толщиной слоя 5мм.
Раствор сравнения: смесь из 1мл 1% раствора нитрата окисного железа и 9мл воды.
Параллельно проводят реакцию с 1мл 0,05% стандартного раствора пиридоксина г/х (0,0005г) добавлением 1мл 0,5% аскорбиновой кислоты, 3,3мл 1% раствора нитрата окисного железа, 4,7воды и измеряют оптическую плотность (Д2).

2) Аскорбиновая кислота
В основе метода количественного определения аскорбиновой кислоты лежит окисление аскорбиновой кислоты йодом до дегидроаскорбиновой кислоты. Избыток йода окрашивает крахмал в синий цвет.

I20 + 2 e̅ → 2 I͞
Расчет молярной массы эквивалента:
УЧ = ½ I2; М.м. аскорбиновой кислоты = 176,13 г/моль;
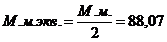 ;
;  =
= 
Т - титр титранта по определяемому веществу,
М - молярность титранта.
0,05г – 0,3г
Х – 0,05г Х = 0,0083г 
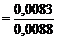 = 0,95 мл
= 0,95 мл
Методика: растворяют 0,05г порошка в 2мл воды и титруют 0,1 моль/л раствором йода до буро-синего окрашивания (индикатор крахмал).
Содержание аскорбиновой кислоты:
 г
г
Расчет абсолютной и относительной ошибок:
α = /0,3-0,05016/=0,00016 (абсолютная ошибка); d  (относительная ошибка)
(относительная ошибка)
Согласно приказу пр. 305 допустимые отклонения ±15%.
Заключение: Лекарственная форма приготовлена удовлетворительно.
Обязательные виды контроля: письменный, контроль при отпуске.
Выборочные: опросный.
Хранение: В сухом, защищенном от света месте, при температуре не выше 250С.
6.2.
Натрия бромида 2 г
Магния сульфата 5 г
Раствора глюкозы 20% 200 мл
Органолептический контроль: бесцветная, прозрачная жидкость без запаха, без механических включений.
Физический контроль: отклонение по массе 200±2%; 200мл±4мл
Определение подлинности:
1) натрия бромид
а) На натрий-ион. 1 мл раствора подкисляют HCl разв., прибавляют 0,5 мл раствора цинкуранил ацетата. Образуется желтый кристаллический осадок.
NaHCO3+Zn[(OH2)3(CH3COO)8]+CH3COOH+7H2O→NaZn[(OH2)3(CH3COO)9]• 9H2O↓+Н2О +СО2↑
б) На бромид-ион. К 0,5 мл ЛФ прибавляют 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется светло-желтый творожистый осадок.
NaBr+AgNO3→AgBr↓светло-желт.+NaNO3
2) магния сульфат
а) На магний-ион. К 0,5 мл ЛФ прибавляют по 5-6 капель раствора аммония хлорида, натрия фосфата и 3-4 капли раствора аммиака. Образуется белый кристаллический осадок, растворимый в разведенной кислоте уксусной.
MgSO4+ Na2HPO4+ NH4OH → MgNH4PO4↓ + Na2SO4+ H2O
б) На сульфат-ион. К 0,5 мл ЛФ прибавляют 5-6 капель раствора бария хлорида. Образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
MgSO4+BaCl2→BaSO4↓ +MgCl2
3) глюкоза. К 0,5 мл лекарственной формы прибавляют 1 мл реактива Фелинга и нагревают до кипения. Образуется кирпично-красный осадок.

Количественное определение:
1. Натрия бромид.Аргентометрия, метод Мора. Метод основан на способности натрия бромида реагировать с серебра нитратом с образованием серебра хлорида.
Методика: К 0,5 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0,1 моль/л р-ром серебра нитрата до оранжево-желтого цвета.
NaBr+AgNO3→AgBr↓бел.+NaNO3
В точке эквивалентности:
2 AgNO3+K2CrO4→Ag2CrO4↓Кирп. красн+ 2KNO3
М.м. = 102,9 г/моль
Mмэкв. =102,9*1 = 102,9

Vтфактич. = 0,5 мл

Расчет отклонения:
а =2 – 2,058 = -0,058;
σ = 
по Пр. №305 допустимо +/- 5%.
1. Магния сульфат. Трилонометрия. Метод основан на образовании устойчивого комплекса Трилона Б с ионами Mg2+.
Методика: К 0,5 мл ЛФ прибавляют 1 мл аммиачного буферного раствора, 1 каплю раствора кислотного хром черного специального и титруют 0,1 моль/л раствором Трилона Б до синего окрашивания.
С индикатором:

С трилоном Б:

В точке эквивалентности:

Расчеты:
M.м. магния сульфата = 123,1 г/моль
М.м.экв.=М.м.=123,4


Vфактич. = 1 мл

Расчет отклонения:
а =5– 4,936 = 0,064;
σ = 
Согласно приказу пр. 305 допустимые отклонения ±4%.
3)Глюкоза.Определение проводят рефрактометрически.
Содержание глюкозы в граммах (X) вычисляют по формуле:



а =20– 20,02 = 0,02;
σ = 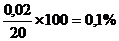
Согласно приказу пр. 305 допустимые отклонения ±3%.
Заключение: Лекарственная форма приготовлена удовлетворительно.
Обязательные виды контроля: письменный, контроль при отпуске.
Выборочные: опросный.
Хранение: В сухом, защищенном от света месте, при температуре не выше 250С.
6.11.
Натрия салицилата






