Воды очищенной до 100 мл
Органолептический контроль: бесцветная, прозрачная жидкость без запаха, без механических включений.
Физический контроль: отклонение по массе 100±3%; 100мл±3мл
Определение подлинности:
1) на натрий
1 мл раствора подкисляют HCl разв., прибавляют 0,5 мл раствора цинкуранил ацетата. Образуется желтый кристаллический осадок.
NaHCO3+Zn[(OH2)3(CH3COO)8]+CH3COOH+7H2O→NaZn[(OH2)3(CH3COO)9]• 9H2O↓+Н2О +СО2↑
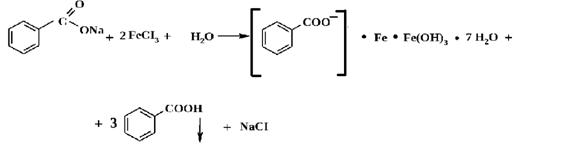
2) на салицилат-ион и бензоат-ион
Салицилат- и бензоат-ионы при совместном присутствии можно определить и на импрегнированной фильтровальной бумаге. На фильтровальную бумагу наносят каплю раствора железа (III) хлорида, после чего в центр полученного пятна помещают каплю анализируемого раствора. Образуется пятно розовато-желтого цвета (бензоат-ион), окаймленное кольцом фиолетового цвета (салицилат-ион).

Количественное определение
1)Сумма натрия бензоата и натрия салицилата.
Метод ацидиметрии за счет основных свойств препаратов.
Методика: 1 мл лекарственной формы помещают в колбу с притертой пробкой, прибавляют 3-4 капли смешанного индикатора, 4-5 мл эфира и титруют 0,1 М раствором соляной кислоты при энергичном взбалтывании до сиреневого окрашивания водного слоя (V1).


М.м. натрия салицилата = 160,14 г/моль
М.м. экв. натрия салицилата = М.м. = 160,14
 =
= 
М.м. натрия бензоата = 144, 11 г/моль
М.м. экв. натрия бензоата = М.м. = 144,11
 =
= 

Vфакт = 0,13 мл

2) Натрия салицилат.
Метод броматометрии за счет окислительно-восстановительных свойств.
Методика: 1 мл лекарственной формы помещают в колбу с притертой пробкой, прибавляют 5 мл воды, 20 мл 0,1 М раствора бромата калия, 1 г бромида калия и 10 мл разведенной серной кислоты. Колбу закрывают пробкой и оставляют на 15 мин. После этого к смеси прибавляют 10 мл 10% раствора иодида калия, оставляют на 5 минут и выделившийся йод титруют 0,1 М раствором титсульфата натрия (индикатор– крахмал).


 =
= 
Молярная масса эквивалента равна 1/6 молярной массы. Следовательно, объем 0,1 моль/л раствор калия бромата будет в этом случае в 6 раз больше, чем объем 0,1 моль/л раствора кислоты хлороводородной, прореагировавшей с натрия салицилатом, в первом титровании.
Поэтому расчет содержания натрия салицилата по разности проводят по формуле:

Vфакт = 3 мл

Хг натрия-бензоата= Х сумма – Хг натрия салицилата = 0,198-0,1=0,098г
а =0,1– 0,098 = 0,002;
σ = 
Согласно приказу пр. 305 допустимые отклонения ±15%.
Заключение: Лекарственная форма приготовлена удовлетворительно.
Обязательные виды контроля: письменный, контроль при отпуске.
Выборочные: опросный.
Хранение: В сухом, защищенном от света месте, при температуре не выше 250С.
7.9.
Раствор магния сульфата 20%
Органолептический контроль: бесцветная, прозрачная жидкость без запаха, без механических включений.
Подлинность:
а) На магний-ион. К 0,5 мл ЛФ прибавляют по 5-6 капель раствора аммония хлорида, натрия фосфата и 3-4 капли раствора аммиака. Образуется белый кристаллический осадок, растворимый в разведенной кислоте уксусной.
MgSO4+ Na2HPO4+ NH4OH → MgNH4PO4↓ + Na2SO4+ H2O
б) На сульфат-ион. К 0,5 мл ЛФ прибавляют 5-6 капель раствора бария хлорида. Образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
MgSO4+BaCl2→BaSO4↓ +MgCl2
Количественное определение:
1. Магния сульфат. Трилонометрия. Метод основан на образовании устойчивого комплекса Трилона Б с ионами Mg2+.
Методика: К 0,5 мл ЛФ прибавляют 1 мл аммиачного буферного раствора, 1 каплю раствора кислотного хром черного специального и титруют 0,05 моль/л раствором Трилона Б до синего окрашивания.
С индикатором:

С трилоном Б:

В точке эквивалентности:

Расчеты:
f = 1
M.м. магния сульфата = 246,48 г/моль; М.м.экв = М.м.*f = 246,48

Vфактич. = 1,6

Расчет отклонения:
Dабс =20 – 19,72 = 0,28;
σ = 
Согласно пр. №305 допустимые отклонения +/- 2%.
Заключение: Лекарственная форма приготовлена удовлетворительно.
Обязательные виды контроля: письменный, контроль при отпуске.
Выборочные: опросный.
Хранение: В сухом, защищенном от света месте, при температуре не выше 250С.






