1. Как изменится значение порога коагуляции, если для коагуляции 2·10-5 м3 золя АgI вместо КNОз взяты Са(NО3)2 и А1(NOз)з. Концентрация объем электролитов, пошедших на коагуляцию золя указаны ниже. Каков знак заряда частиц?
| Электролит | КNОз | Са(NО3)2 | А1(NOз)з |
| С, кмоль/м3 | 1,0 | 0,1 | 0,01 |
| V.10-6, м3 | 3,0 | 1,0 | 0,4 |
2. Чтобы вызвать коагуляцию гидрозоля Fе(ОН)з к 1×10-5 м3 золя добавлено в первом случае 1,05×10-6 м3 1N раствора КС1, во втором - 6,2×10-6 м3 0,01N раствора Nа2SO4 и в третьем - 9,1×10-6 м3 0,001N раствора Nа2SO4. Определите знак заряда частиц золя и вычислите порог коагуляции каждого электролита в кг×экв/м3.
3. При коагуляции полистирольного латекса получены следующие значения порога коагуляции:
| Электролит | NаС1 | СаС12 | АlCl3 |
| Ск, моль/л | 0.47 | 7.10-3 | 6.10-4 |
Проверьте применимость правила значности к данной системе.
4. Порог быстрой коагуляции положительно заряженного золя АgI под действием NаNОз равен 9,3 моль/м3. С помощью правила Шульце-Гарди рассчитайте значения порога коагуляции этого золя для КзРО4,К2Cr2О7, К2S04.
5. Порог быстрой коагуляции отрицательно заряженного золя AgI под действием NаNOз равен 11,23 моль/м3. С помощью правила Дерягина-Ландау рассчитайте значения порога коагуляции этого золя для К2SO4, СаCl2 и АlCl3.
6. При исследовании коагуляции полихлоропренового латекса получены следующие значения порога коагуляции:
| Электролит | NаСl | СаС12 |
| Ск, моль/л | 0,25 | 1,08.10-2 |
Рассчитайте значения порога коагуляции для А1С13, исходя из соотношения Шульце-Гарди.
7. Порог коагуляции бутадиен-стирольного латекса, вызванного СаСl2, равен 2×10-2 моль/л. Используя правила Шульце-Гарди и Дерягина-Ландау, рассчитайте значения порога коагуляции для следующих электролитов:NаС1,ВаС12, Аl(NO3)3.
8. Каким из приведенных электролитов: NH4Cl или (NH4)2SO4 экономичнее коагулировать золь гидроксида алюминия, стабилизированного хлоридом алюминия? Рассчитайте значения порога коагуляции по NH4Cl, если на коагуляцию частиц из 30 м3 этого золя расходуется 0,33 м3 20 %-го раствора NH4Cl (плотность 1060 кг/м3).
9. В пробе сточных вод объемом 5,0.10-2 м3 после добавления к ней 2,3.10-3 26 %-го раствора NaCl (плотность 1200 кг/м3) появляются хлопья. Определите значения порога коагуляции рассматриваемого золя по отношению к NаCl.
10. Определите значения времени половинной коагуляции, используя экспериментальные данные для коагуляции золя золота раствором NаСl. Применима ли к данному случаю теория Смолуховcкого?
Время коагуляции  , ч , ч
| 0 | 0,5 | 1 | 2 | 3 | 5 | 9 |
| ν .10-14, м-3 | 4,35 | 4,01 | З,74 | 3,32 | 3,29 | 3,33 | 3,35 |
11. Происходит ли быстрая коагуляция водной суспензии глины, если общее число частиц в системе изменяется во времени следующим образом:
Время коагуляции 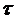 , с , с
| 0 | 90 | 210 | 330 | 450 | 570 | 1260 |
| ν .10-14,м-3 | 50 | 10,4 | 5,8 | 4,9 | 4,1 | 2,9 | 1,0 |
12. Происходит ли быстрая коагуляция водной суспензии каолина, если общее число частиц в системе изменяется во времени следующим образом:
Время коагуляции 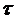 , с , с
| 0 | 90 | 150 | 210 | 270 | 330 | 390 |
| ν .10-14,м-3 | 5,0 | 3,91 | 3,55 | 3,29 | 2,80 | 2,69 | 2,56 |
13. Происходит ли быстрая коагуляция гидрозоля золота, если общее число частиц в системе n изменяется во времени следующим образом:
Время коагуляции  , с , с
| 0 | 30 | 60 | 120 | 240 | 480 |
| ν .10-14,м-3 | 20,1 | 14,8 | 10,9 | 8,24 | 4,90 | 3,02 |
14. Происходит ли быстрая коагуляция гидрозоля золота, если общее число частиц в системе n изменяется во времени следующим образом:
Время коагуляции 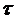 , с , с
| 0 | 60 | 120 | 240 | 420 | 600 |
| ν .10-14,м-3 | 5,09 | 4,18 | 3,66 | 2,89 | 2,32 | 1,96 |
15. Происходит ли быстрая коагуляция гидрозоля золота, если общее число частиц в системе n изменяется во времени следующим образом:
 , с , с
| 0 | 60 | 120 | 240 | 420 | 600 | 900 | 1320 |
| ν .10-14,м-3 | 2,7 | 2,35 | 2,26 | 2,01 | 1,70 | 1,46 | 1,37 | 1,2 |
16. Рассчитайте время половинной коагуляции и константу константу скорости быстрой коагуляции лиофобной дисперсной системы в воде, если за 7 с число частиц в 1 м3 изменилось с 3,22 ×1016 до 2,42 ×1016.Вязкость среды 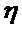 = 1·10-3 Па·с, температура 293 К. Сравните значение константы скорости быстрой коагуляции, рассчитанной теоретически с экспериментальной величиной.
= 1·10-3 Па·с, температура 293 К. Сравните значение константы скорости быстрой коагуляции, рассчитанной теоретически с экспериментальной величиной.
17. Во сколько раз уменьшится общее число частиц дыма оксида цинка  0, равное 1×1016 м3, через 10 с и 50 с после начала коагуляции? Константа скорости коагуляции К = 3×10-16 м3/с.
0, равное 1×1016 м3, через 10 с и 50 с после начала коагуляции? Константа скорости коагуляции К = 3×10-16 м3/с.
18. Рассчитайте и постройте в координатах 1/  =f(
=f(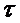 ) кривые изменения общего числа частиц золя золота при его коагуляции в интервалах времени 5, 10, 20, 40, 60 с. Первоначальное число частиц в I м3 = 2,0×1015, время половинной коагуляции = 200 с.
) кривые изменения общего числа частиц золя золота при его коагуляции в интервалах времени 5, 10, 20, 40, 60 с. Первоначальное число частиц в I м3 = 2,0×1015, время половинной коагуляции = 200 с.
19. Рассчитайте время половинной коагуляции аэрозоля с дисперсностью 0,25 нм и концентрацией 1,5×1015 кг/м3, если константа скорости быстрой коагуляции равна 5,8×10-18 м3/с. Плотность частиц аэрозоля равна 2200 кг/м3.
20. Во сколько раз уменьшится число частиц  дыма мартеновских печей через I, 10 и 100 с после начала коагуляции? Средний радиус частиц 2×10-8 м; концентрация 1×103 кг/м3. Плотность 2,2×103 кг/м3; константа Смолуховского K = 3×10-16 м3/с.
дыма мартеновских печей через I, 10 и 100 с после начала коагуляции? Средний радиус частиц 2×10-8 м; концентрация 1×103 кг/м3. Плотность 2,2×103 кг/м3; константа Смолуховского K = 3×10-16 м3/с.
21. Первоначальное число частиц в 10-6 м3 золя n0 составляет 5×108,время половинной коагуляции 335 с. Определите общее число частиц через 100, 200, 350 и 400 с после начала коагуляции. Постройте график  1/
1/ 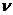 =f(
=f( ).
).
22. Рассчитайте и постройте графическую зависимость притяжения сферических частиц полистирола, находящихся в водной среде, от расстояния между поверхностями частиц, равного 2, 4, 8, 10, 15, 20 нм. Радиус частиц равен 40 нм; константа Гамакера А = 5×10-21 Дж.
23. Рассчитайте и постройте графическую зависимость энергии притяжения двух плоскопараллельных пластин в водной среде от расстояния между ними, равного 5, 10, 25, 50, 75, 100 нм. Константу молекулярных сил Гамакера примите равной 2×10-20 Дж.
24. Рассчитайте и постройте потенциальную кривую взаимодействия сферических частиц полистирольного латекса радиусом 100 нм в водном растворе NаС1, если потенциал  = 30 мВ; константа Гамакера Å =1,1×10-20 Дж; параметр
= 30 мВ; константа Гамакера Å =1,1×10-20 Дж; параметр 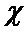 = 0,7×108 м-1, температура 293 К. Значение суммарной энергии взаимодействия частиц определите при расстояниях между их поверхностями h=2, 5, 10, 20, 40, 60 нм.
= 0,7×108 м-1, температура 293 К. Значение суммарной энергии взаимодействия частиц определите при расстояниях между их поверхностями h=2, 5, 10, 20, 40, 60 нм.
25. Рассчитайте и постройте потенциальную кривую взаимодействия плоскопараллельных пластин большой толщины в водном растворе одновалентного электролита по следующим данным: потенциал диффузного слоя  = 20 мВ;
= 20 мВ;  = 0,57×107 м-1; константа Гамакера Å =1,25×10-20 Дж; диэлектрическая проницаемость среды 80,1. Значение энергии взаимодействия рассчитайте для расстояния между поверхностями пластин 5, 10, 20, 30 и 50 нм при 293 К.
= 0,57×107 м-1; константа Гамакера Å =1,25×10-20 Дж; диэлектрическая проницаемость среды 80,1. Значение энергии взаимодействия рассчитайте для расстояния между поверхностями пластин 5, 10, 20, 30 и 50 нм при 293 К.
26. Рассчитайте и постройте графическую зависимость энергии электростатического отталкивания двух плоcкопараллельных пластин в водном растворе КCl при расстояниях между поверхностями, изменяющимися от 5 до 200 нм. Потенциал диффузионного слоя 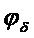 = 3×10-2В;
= 3×10-2В;  = 5,7×106 м-1; температура раствора равна 293 К; диэлектрическая проницаемость среды e=80,1.
= 5,7×106 м-1; температура раствора равна 293 К; диэлектрическая проницаемость среды e=80,1.
27. Рассчитайте и постройте графическую зависимость энергии электростатического отталкивания сферических частиц в водном растворе КС1 по следующим данным: потенциал  = 0,02 В; температура 300 К; концентрация электролита с=2×103 моль/л; диэлектрическая проницаемость среды e=77,8. Расстояние между частицами изменяется от 5 до 150 нм.
= 0,02 В; температура 300 К; концентрация электролита с=2×103 моль/л; диэлектрическая проницаемость среды e=77,8. Расстояние между частицами изменяется от 5 до 150 нм.
28. Рассчитайте и постройте графическую зависимость энергии межмолекулярного притяжения сферических частиц полиметилметакрилата, находящегося в водной среде, от расстояния между частицами 2, 5, 10, 15, 20 нм. Радиус частиц равен 70 нм; константа Гамакера Å =0,72×10-20 Дж.
29–39. При достаточно медленном введении концентрированного раствора вещества В в разбавленный раствор вещества А возможно образование гидрозоля вещества С. Напишите формулу мицеллы и укажите знак электрического заряда коллоидной частицы золя. Для какого из перечисленных электролитов порог коагуляции является наименьшим?
| № | А | В | С | Электролиты |
| 29 | MgCl2 | NaOH | Mg(ОН)2 | K2SO4; ZnCl2; AlCl3 |
| 30 | (NH4)2S | AgNO3 | Ag2S | BaCl2; K3PO4; Na2SO4 |
| 31 | СaCl2 | H2SO4 | CaSO4 | (NH4)2SO4; ZnCl2; FeCl3 |
| 32 | Pb(NO3)2 | HCl | РbCl2 | NaJ; LiCl; CsNO3 |
| 33 | CrCl3 | NH4OH | Cr(OH)3 | Na2SO4; ThCl4; K3PO4 |
| 34 | K2CrO4 | AgNO3 | Ag2CrO4 | KJ; CaCl2; NaBr |
| 35 | Н2О | FeCl3 | Fe(OH)3 | Na2SO4; Al(NO3)3; СаCl2 |
| 36 | K2MoO4 | Pb(NO3)3 | PbMoO4 | KCl; NaJ; CsNO3 |
| 37 | AgNO3 | Na2HPO4 | Ag2HPO4 | BaCl2; K3PO4; Th(NO3)4 |
| 38 | Na2S | NiSO4 | NiS | (NH4)2SO4; AlCl3; Na3PO4 |
| 39 | NaF | SrCl2 | SrF2 | ZnCl2; Na2SO4; Al(NO3)3 |






