Кафедра химии
Курсовая работа
На тему: «Физико – химические методы анализа фенола»
Выполнил:
студент группы 1401
Таблдиев С.М.
Проверила: Сафиуллина Т. Р.
г. Нижнекамск 2016
Содержание
Введение........................................................................................................... 3
1. Физические свойства.................................................................................... 5
2. Способы получения..................................................................................... 8
3. Химические свойства................................................................................. 11
4. Применение................................................................................................ 14
5. Физико-химические методы анализа........................................................ 16
5.1 Фотоколориметрическое определение массовой доли фенола в сточных водах 16
5.2 Методика выполнения измерений массовой концентрации фенола в воде методом газожидкостной хроматографии.................................................................. 20
Заключение.................................................................................................... 24
Библиографический список........................................................................... 25
Введение
Физико-химические методы анализа. Традиционными метода анализа считаются химические методы. В классических методах химического анализа в качестве определяемого свойства веществ используются или масса осадка (гравиметрический метод), или объем реактива, израсходованный на реакцию (титриметрический анализ). Однако химические методы анализа не в состоянии удовлетворить многообразные запросы практики, особенно возросшие как результат научно-технического прогресса и развития новых отраслей науки, техники и народного хозяйства в целом
Сроки выполнения анализов химическими (весовыми) методами, как правило, исчисляются часами, в то время как современное производство и лабораторная диагностика требует выполнения анализов в течение минут. Методы объемного анализа не всегда применимы и не всегда могут удовлетворить производство в отношении быстроты.
В связи с этим первостепенное значение приобретают физико-химические методы, которые позволяют сократить сроки выполнения анализа, не понижая точности, а в ряде случаев даже повышая ее.
Данные методы основаны на использовании физико-химических свойств анализируемых компонентов.
Оптические методы анализа. Методы, основанные на использовании оптических свойств анализируемых веществ. К ним относятся:
Фотометрические методы анализа, включающие: колориметрию и спектрофотометрию, которые могут быть определены как методы анализа, основанные на измерении количества света, поглощенного цветным раствором; турбидиметрию — метод анализа, основанный на измерении количества света, поглощенного белой суспензией; нефелометрию — метод анализа, основанный на измерении количества света, рассеянного частицами суспензии.
По технике выполнения фотометрические методы разделяются на субъективные и объективные (или фотоэлектрические). В первом случае оценка интенсивности света производится глазом, во втором — с помощью фотоэлемента.
Рефрактометрический метод анализа, основанный на измерении коэфициента преломления света веществом.
Поляриметрический метод анализа, в котором изучается вращение плоскости поляризации.
Спектроскопический метод анализа, основанный на изучении спектров исследуемого вещества.
Электрохимические методы анализа. К этой группе относятся методы, использующие электрохимические свойства исследуемых веществ, а именно:
Метод анализа электролизом, при котором исследуется выделение вещества на электроде под действием электрического тока.
Потенциометрический метод, основанный на изучении потенциалов, возникающих между раствором и погруженным в него электродом.
Кондуктометрический метод, исследующий электропроводность раствора.
Полярографический метод, основанный на изучении поляризации электродов.
Помимо указанных, имеются и другие методы анализа: термоэлектрический, люминесцентный и др. [1, стр. 8]
Физические свойства
Фенол (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов.
Фенол представляет собой бесцветные игольчатые кристаллы. Обладает специфическим запахом (таким, как запах гуаши, так как в состав гуаши входит фенол). При хранении кристаллы становятся розоватыми, потом фиолетовыми из-за окисления, приводящего к образованию окрашенных веществ. В холодной воде фенол растворяется очень плохо (8 г в 100 мл при 15 оС), но при нагревании граница раздела между жидким фенолом и водой постепенно исчезает, раствор становиться прозрачным. Умеренно растворим, в растворах щелочей, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Фенол вызывает денатурацию белка, поэтому обладает антисептическими свойствами. При попадании на кожу может вызвать ожоги. На коже появляются белые пятна, которые позже темнеют. При попадании в организм вызывает тяжелые отравления. Физические свойства фенола приведены в таблице 1 [2, стр. 11]..
Таблица 1. Физические свойства фенола.
| Молекулярная формула | C6H6O |
| Относительная молекулярная масса | 94,11 а. е. м. |
| Температура плавления | 40.5-41 °C |
| Температура кипения | 181.7 °C |
| Температура вспышки | 79 (в закрытом тигле), 85 (в открытом) °C |
| Плотность | 1,07 г/см3 |
| Молярная теплоёмкость | 2,35 Дж/(моль·К) |
| Стандартная энтальпия образования | −162,944 кДж/моль |
В зависимости от технологии производства и назначения фенол выпускают трех марок: А, Б и В. Синтетический фенол должен удовлетворять требованиям ГОСТ 23519-93. Технические характеристики фенола согласно ГОСТ 23519-93 приведены в таблице 2 [3, стр. 3].
Таблица 2. Технические характеристики фенола согласно ГОСТ 23519-93
| Наименование показателя | Значение | ||
| Марка А | Марка Б | Марка В | |
| Внешний вид | Белое кристаллическое вещество | Белое кристаллическое в-во. Допускается розоватый или желтоватый оттенок | |
| Температура кристаллизации, °С, не ниже | 40,7 | 40,6 | 40,4 |
| Массовая доля нелетучего остатка, %, не более | 0,001 | 0,008 | 0,01 |
| Оптическая плотность водного раствора фенола (8,3 г марки А, 8,0 г марки Б, 5,0 г марки В в 100 см3 воды) при 20 °С, не более | 0,03 | 0,03 | 0,03 |
| Оптическая плотность сульфированного фенола, не более | 0,05 | Не нормируют | |
| Цветность расплава фенола по платиново-кобальтовой шкале, единицы Хазена: | |||
| у изготовителя, не более | Не нормируют | ||
| у потребителя: | |||
| при транспортировании по трубопроводу и в цистернах из нержавеющей стали, не более | То же | ||
| при транспортировании в цистернах из углеродистой стали и оцинкованных, не более | >> | ||
| Массовая доля воды, %, не более | 0,03 | Не нормируют | |
| Массовая доля суммы органических примесей, %, не более | 0,01 | Не нормируют | |
| в том числе оксида мезитила, %, не более | 0,0015 | 0,004 | Не нормируют |
| суммы -метилстирола и изопропилбензола (кумола), %, не более | Не нормируют | 0,01 | То же |
Строение молекулы фенола.
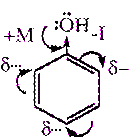
Бензольное ядро и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга. Фенильная группа (С6Н5-) оттягивает на себя неподеленную электронную пару от атома кислорода в ОН-группе. В результате на атоме Н этой группы увеличивается частичный положительный заряд (обозначен значком δ+), полярность связи О–Н возрастает, и связь разрывается легче, что проявляется в увеличении кислотных свойств этой группы. Таким образом, в сравнении со спиртами, фенолы представляют собой более сильные кислоты. Частичный отрицательный заряд (обозначен через δ–), переходя на фенильную группу, сосредотачивается в положениях орто- и пара- (по отношению к ОН-группе). Эти реакционные точки могут атаковаться реагентами, тяготеющими к электроотрицательным центрам, так называемыми электрофильными («любящими электроны») реагентами. [4, стр. 367].
Способы получения
История фенола насчитывает уже более 160 лет. Впервые он был выделен из каменноугольной смолы в 1834 г., откуда и получил свое название - карболовая (угольная) кислота. Быстрый рост потребления фенола поставил вопрос об искусственных способах его получения, создание которых является одной из самых ярких страниц в истории органической химии. Синтетические методы синтеза фенола различаются природой используемого сырья, химизмом и экономичностью процесса. Они могут быть подразделены на:
- сульфонатный, состоящий в щелочном плавлении бензолсульфокислоты (1);
- хлорные, заключающиеся в щелочном или воднопаровом гидролизе хлорбензола (2);
- окислительные, основанные на окислении до фенола бензола, толуола и циклогексана (3, 4, 5, 6, 7).
Из синтетических методов производства фенола промышленное значение имеют следующие:
- каталитическое окисление толуола (4) - прямое окисление бензола в среде уксусной кислоты (7)
- окислительное хлорирование бензола (3)
- кумольный метод совместного производства фенола и ацетона через изопропилбензол (6);
- из бензола через циклогексан (5).
На рисунке 1 показана взаимосвязь различных методов производства фенола

Рис. 1. Методы производства фенола
Метод синтеза, по которому в наши дни получают большую часть производимого в мире фенола – кумольный процесс – открытый группой советских химиков во главе с профессором П. Г. Сергеевым в 1942 году. Метод основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной серной кислотой. В 1949 году в г. Дзержинске Горьковской области был введен в действие первый в мире кумольный завод. До этого гидроперекиси считались малостабильными промежуточными продуктами окисления углеводородов. Даже в лабораторной практике их почти не использовали. На Западе кумольный метод был разработан в конце 40-х годов и отчасти известен как процесс Хока, по имени немецкого ученого, позднее независимо открывшего кумольный путь синтеза фенола. В ромышленном масштабе этот метод стал впервые использоваться в США в начале 50-х годов. С этого времени на многие десятилетия кумольный процесс становится образцом химических технологий во всем мире.
Несмотря на прекрасно отлаженную технологию и длительный опыт эксплуатации, кумольный метод имеет ряд недостатков. Прежде всего это наличие взрывоопасного промежуточного соединения (гидропероксид кумола), а также многостадийность метода, что требует повышенных капитальных затрат и делает труднодостижимым высокий выход фенола в расчете на исходный бензол. Так, при выходе полезного продукта 95% на каждой из трех стадий итоговый выход составит лишь 86%. Приблизительно такой выход фенола и дает кумольный метод в настоящее время. Но самый важный и принципиально неустранимый недостаток кумольного метода связан с тем, что в качестве побочного продукта образуется ацетон. Это обстоятельство, которое первоначально рассматривалось как сильная сторона метода, становится все более серьезной проблемой, поскольку ацетон не находит эквивалентного рынка сбыта. В 90-х годах эта проблема стала особенно ощутимой после создания новых способов синтеза метилметакрилата путем окисления углеводородов С4, что резко сократило потребность в ацетоне. Об остроте ситуации говорит тот факт, что в Японии разработана технология, предусматривающая рецикл ацетона. С этой целью к традиционной кумольной схеме добавляются еще две стадии, гидрирование ацетона в изопропиловый спирт и дегидратация последнего в пропилен. Образующийся пропилен снова возвращают на стадию алкилирования бензола. В 1992 году фирма «Mitsui» запустила крупное производство фенола (200 тыс. т/год), основанное на этой пятистадийной кумольной технологии.
Предлагаются также другие сходные модификации кумольного метода, которые позволили бы смягчить проблему ацетона. Однако все они приводят к значительному усложнению технологии и не могут рассматриваться как перспективное решение проблемы. Поэтому исследования, ориентированные на поиск новых путей синтеза фенола, которые основывались бы на прямом окислении бензола, в последнее десятилетие приобрели особенно интенсивный характер. Работы ведутся главным образом в следующих направлениях: окисление молекулярным кислородом, окисление моноатомными донорами кислорода и сопряженное окисление. [2, стр.89; 5, стр. 567].
Химические свойства
Химические свойства фенола обусловлены взаимным влиянием гидроксильной группы и бензольного ядра.
Отличия от ароматических углеводородов:
Фенол легко окисляется кислородом воздуха, приобретая фиолетовую окраску.
Фенол без нагревания и без катализаторов энергично вступает в реакции замещения атомов водорода бензольного ядра. При этом почти всегда образуются тризамещенные производные.
К таким реакциям относятся галоидирование, сульфирование, нитрование, а также реакции конденсации и окисления.


Для получения монозамещенных фенола нужно специально подбирать условия. Так, пара-нитрофенол (с небольшим количеством орто-нитрофенола) получается при действии разбавленной азотной кислоты на фенол (в отсутствии серной кислоты).

Сульфирование фенола приводит к образованию орто - или пара - фенолсульфокислоты:

Реакции по гидроксильной группе
1. Фенол, как и спирты, взаимодействует с активными металлами.
2. Фенол, в отличие от спиртов, взаимодействует со щелочами.
Фенол обладает кислыми свойствами и при действии едких щелочей образует феноляты. В водных растворах феноляты сильно гидролизованы, и даже слабая угольная кислота выделяет свободные фенолы из щелочных растворов. Безводный фенолят натрия при насыщении двуокисью углерода и нагревании до 125° почти с теоретическим выходом дает натриевую соль салициловой кислоты, при подкислении которой получается свободная салициловая кислота:
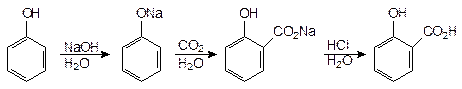
В присутствии мелко раздробленного никеля фенол присоединяет водород, давая циклогексанол, который служит исходным материалом в производстве адипиновой кислоты, гексаметилендиамина и капролактама.
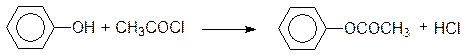
Фенол вступает в реакции ацилирования. Для получения сложного эфира фенола используют хлорангидриды и ангидриды кислот:
Фенол вступает в реакции поликонденсации с образованием фенол-формальдегидных смол:
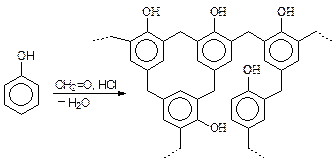
Фенолы могут конденсироваться со спиртами, альдегидами, кислотами, ангидридами, хлорангидридами и при этом всегда реагируют водороды, находящиеся в орто- и пара- положениях.
При конденсации фенола с альдегидами в кислой среде получаются соединения типа диоксидиарилметана. Способ получения подобных продуктов известен под названием реакции Байера.
В парисутствии серной кислоты или хлорида цинка фенол конденсируется с фталевым ангидридом с образованием фенолфталеина:

[2, стр. 23; 4, стр. 367].
Применение
Фенол был впервые обнаружен в каменноугольной смоле Ф. Рунге в 1834 г. и неправильно назван карболовой кислотой. Состав фенола установил в 1842 г. О. Лоран.
Новый продукт быстро нашел применение в производстве некоторых важных красителей (азокрасителей), в кожевенной промышленности (для дубления кож), а также в фармацевтической промышленности (для изготовления фенацетина и ряда производных салициловой кислоты). В связи с этим были разработаны промышленные методы выделения фенола из каменноугольной смолы, что позволило организовать его производство в больших масштабах.
В конце XIX столетия вследствие бурного развития анилино-красочной промышленности и использования фенола в производстве бризантного взрывчатого вещества — тринитрофенола (называемого также пикриновой кислотой или мелинитом) потребность в нем настолько возросла, что единственный в то время источник получения фенола — каменноугольная смола — едва ее покрывал. Однако уже вскоре после открытия метода получения бакелита — феноло-формальдегидного пластика, нашедшего широкое применение в промышленности пластических масс, ресурсы коксохимического фенола оказались совершенно недостаточными. Это и послужило толчком к оргаганизации производства синтетического фенола.
Начиная с первой мировой войны масштабы потребления фенола непрерывно увеличивались, опережая рост его производства из каменноугольной смолы; это еще более стимулировало разработку и внедрение в промышленность методов синтеза фенола.
Основным потребителем фенола до второй мировой войны было производство феноло-альдегидных полимеров, используемых для получения пластических масс. В 50-х годах в ряде стран появился новый крупный, потребитель фенола — производство синтетических полиамидов и на их основе производство синтетических волокон и пластмасс, таких, как капрон и найлон.
В настоящее время мировое производство фенола достигло очень высокого уровня и продолжает расширяться. Фенол является одним из важнейших многотоннажных продуктов органического синтеза.
Фенол используется также в производстве 2,4-дихлорфеноксуксусной кислоты (2,4-Д-кислоты) и других гербицидов, эпоксидных и поликарбонатных полимеров на основе дифенилолпропана, алкилфенолов (применяемых в производстве пленкообразующих для лаков), салициловой кислоты, дезинфицирующих средств и фармацевтических препаратов.
Большое количество фенола потребляется в нефтеперерабатывающей промышленности для селективной очистки масел.
Фенол используется в производстве фенольных пластиков, синтетических волокон, для получения фенол-формальдегидных и фурфурол-формальдегидных смол, пластических масс типа «фенолит», эпоксидных смол, промежуточных продуктов — гексаметилендиамина, адипиновой кислоты и капролактама, идущих для изготовления искусственного волокна. А также для синтеза красителей, моющих средств, гербицидов, инсектисидов, салициловой кислоты и некоторых медикаментов (аспирин, салол), специальных присадок к смазочным маслам и т. п. [2, стр. 63; 4, стр. 380].
Физико-химические методы анализа






