Основы классической теории электролитической диссоциации
Электролитическая диссоциация – - это распад электролита на ионы под действием полярных молекул растворителя.
Основные положения ТЭД сформулированы в 1887г. Сванте Аррениусом.
1. Электролиты при растворении в воде диссоциируют на положительные и отрицательные ионы. Ионы - это заряженные частицы. Наличие заряда существенно меняет их свойства. Например – хлор агрессивен, ядовитый газ, в то время как С1- - анион хлора не ядовит. Натрий разлагает воду, в то время как Na+ - катион этой способностью не обладает.
2. Под действием электрического тока положительно заряженные ионы двигаются к катоду и называются катионами, а отрицательные - к аноду и называются анионы.
3. Диссоциация процесс обратимый
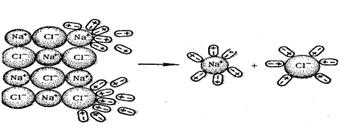
КА 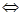 К+ + А-
К+ + А-
Структура растворяющегося вещества влияет на диссоциацию. Наиболее типичны 2 случая:
1) диссоциация растворяющихся солей, т.е. кристаллов с ионной структурой (для NаCl ионная кристаллическая решетка к.ч.=6).
2) диссоциация при растворении кислот, т.е. веществ, состоящих их полярных молекул.
I.При попадании кристалла соли, например NaC1, в воду, расположенные на его поверхности ионы притягивают к себе полярные молекулы воды, возникает (ион- дипольное взаимодействие).
К ионам Na+ молекулы воды притягиваются своими отрицательными полюсами, а к хлорид - ионам - положительными. Молекулы воды испытывают толчки со стороны других молекул.
Ионы отделяются от кристалла и переходят в раствор. Основным условием диссоциации является полярность растворителя (NaC1 в неполярном растворителе диссоциировать не будет, например в бензоле ( =о).
=о).
2. Несколько иначе протекает диссоциация полярных молекул. Молекулы воды, притянувшиеся к концам полярной молекулы за счет диполь- дипольного взаимодействия поляризуют молекулу, что приводит к распаду полярной молекулы на ионы.
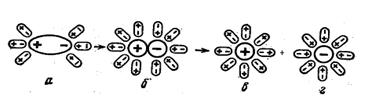
Как и в случае кристалла эти ионы гидратируются, т.е. при растворении происходит химическое взаимодействие растворенного вещества с растворителем - водой, которое приводит к образованию гидратов, а затем диссоциации их на ионы. Эти ионы связаны с молекулами воды, т.е. гидратированы. Взаимодействие между частицами растворенного вещества и растворителя называется сольватацией, когда же растворителем является вода - гидратацией. Гидратация ионов (в общем случае сольватация) основная причина диссоциации.
NaCl + n H2O Û Na+(H2O )x + С1- H2O (n-x)
Обычно степень гидратации, т.е. количество молекул растворителя, окружающих каждый ион очень велико. Однако ион водорода Н+ образует гидрат постоянного состава, включающий одну молекулу воды Н+(Н2О).
Изображают его формулой Н3О+ и называют ионом - гидроксония. Новая ковалентная связь образуется по донорно-акцепторному механизму за счет свободной электронной пары кислорода и является насыщенной. Но т.к. вопрос о количестве молекул воды, окружающих протон водорода спорный, то лучше писать Н+(водн.), так и в случае других гидратированных ионов. Но для простоты(водн.) не пишут, по помнят.
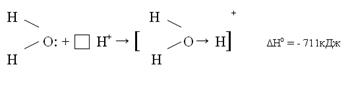
молекула воды – донор → направление стрелки
протон – акцептор от донора к акцептору
Велика роль воды как растворителя. Такие процессы, как гидролиз, электролиз, процессы получения кислот, связывание и схватывание цемента и гипса, варка, выщелачивание, кристаллизация и очистка веществ не могут идти без воды. От достаточного поступления воды в организм человека и животного зависят циркуляция крови, переваривание пищи, удаление распадающихся клеток, регулирование температуры тела и кислотно-основного обмена. Наш организм может существовать без пищи несколько недель, но и одной недели человек не проживет без воды.
Количественной характеристикой электролитической диссоциации является степень диссоциации a – это отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (N):
a = 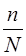

По степени диссоциации в не очень разбавленных растворах электролиты подразделяются на сильные, слабые и средней силы.
a >30% - сильные электролиты
3% < a <30% - средней силы
a < 3% - слабые для децинормального (0,1н) раствора
Сильные электролиты (a > 30%) – это почти все соли,
многие неорганические кислоты НNO3, H2SO4, НMnO4, НС1О4, НС1О3, НС1, НВr, HJ, основания щелочных и щелочно - земельных металлов LiOH и т.д.…(I A и II A групп):
Слабые (a < 3%) - Н2S, HCN, H2SiO3, H3BO3, Н2СО3; гидроксиды d- элементов Сu(OH)2, Cr(OH)3), а также NH4OH, Ве(ОН)2, вода, НNO2, немногие соли Fe(CNS)3, HgCl2, Hg(CN2), CdI2, СdCl2, Pb(CH3COO)2, ZnCl2, ZnI2.






