Отношения параметров газа р, Т и V, характеризующих его состояние, к их критическим значениям, называются приведенными.
Под приведенной температурой понимается отношение абсолютной температуры газа к его критической температуре: Тпр = Т/Ткр.
Приведенным давлением называется отношение абсолютного давления газа к его абсолютному критическому давлению:
pпр = pабс/pкр.
Если параметры газа выразить в безразмерных приведенных величинах, можно установить, что для газов существует так называемое общее уравнение состояния, лишенное величин, характеризующих данный газ:
f (pпр, Тпр, Vпр) = 0
Состояние, отвечающее этому условию, называется законом соответственных состояний, по которому два газа будут иметь один и тот же приведенный объем, если у них равны приведенные давление и температура.
Значение закона соответственных состояний заключается в том, что он позволяет с достаточной точностью определять коэффициенты сжимаемости газов и другие параметры по графикам для других газов, построенным в приведенных параметрах.
20. Дайте определение понятию «удельная электропроводность». Установите, как удельная электропроводность растворов сильных и слабых электролитов зависит от концентрации и разбавления? В чем причины такой зависимости? Ответ проиллюстрируйте.
Электрический ток есть упорядоченное перемещение заряженных частиц. Растворы электролитов обладают ионной проводимостью (являются т.н. проводниками второго рода), т.е. электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода).
В качестве количественной меры способности раствора электролита проводить электрический ток используют обычно удельную электропроводность κ (каппа) – величину, обратную удельному сопротивлению (т.е. величину, обратную сопротивлению столба раствора между электродами площадью 1 см2, находящимися на расстоянии 1 см):
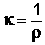 , Ом-1см-1
, Ом-1см-1
Величина удельной электропроводности электролита зависит от ряда факторов: природы электролита, температуры, концентрации раствора. Удельная электропроводность растворов электролитов (в отличие от электропроводности проводников первого рода) с увеличением температуры возрастает, что вызвано увеличением скорости движения ионов за счет понижения вязкости раствора и уменьшения сольватированности ионов. Зависимость удельной электропроводности от концентрации раствора представлена на рис. 3.9.

Рис. 3.9 Зависимость удельной электропроводности электролитов от концентрации
(1 – H2SO4, 2 – KOH, 3 – CH3COOH)
Как видно из рисунка, с увеличением концентрации удельная электропроводность растворов сначала возрастает, достигая некоторого максимального значения, затем начинает уменьшаться. Эта зависимость очень чётко выражена для сильных электролитов и значительно хуже для слабых. Наличие максимума на кривых объясняется тем, что в разбавленных растворах сильных электролитов скорость движения ионов мало зависит от концентрации, и κ сначала растет почти прямо пропорционально числу ионов; с ростом концентрации усиливается взаимодействие ионов, что уменьшает скорость их движения. Для слабых электролитов наличие максимума на кривой обусловлено тем, что с ростом концентрации уменьшается степень диссоциации, и при достижении определенной концентрации число ионов в растворе начинает увеличиваться медленнее, чем концентрация.
21. Дайте определение понятию «идеальный газ». Каким уравнением описывается состояние идеального газа? Проанализируйте, какие физические законы объединены в уравнении Менделеева-Клапейрона? Систематизируйте знания и объясните, чем отличаются реальные газы от идеальных газов?
Идеальный газ — математическая модель газа.
Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
- объём частицы газа равен нулю (то есть, диаметр молекулы
 пренебрежимо мал по сравнению со средним расстоянием между ними,
пренебрежимо мал по сравнению со средним расстоянием между ними,  );
); - импульс передается только при соударениях (то есть, силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях);
- суммарная энергия частиц газа постоянна (то есть, нет передачи энергии за счет передачи тепла или излучения)
В этом случае частицы газа движутся независимо друг от друга, давление газа на стенку равно сумме импульсов в единицу времени, переданной при столкновении частиц со стенкой, энергия — сумме энергий частиц газа. Свойства идеального газа описываются уравнением Менделеева — Клапейрона 
где  — давление, m — масса газа, М – молярная масса газа, R – универсальная газовая постоянная,
— давление, m — масса газа, М – молярная масса газа, R – универсальная газовая постоянная,  — абсолютная температура.
— абсолютная температура.
Законы идеального газа были в свое время открыты опытным путем. Так был установлен закон Бойля – Мариотта (1) pV = const,
из которого следует, что изменение объема газа V при постоянной температуре T сопровождается таким изменением его давления p, что их произведение остается постоянной величиной.
Если газ находится в условиях, когда постоянным сохраняется его давление, но меняется температура (такие условия можно осуществить, например, поместив газ в сосуд, закрытый подвижным поршнем), то выполняется закон Гей-Люссака
(2)  , т.е. при фиксированном давлении отношение объема газа к его температуре является постоянным.
, т.е. при фиксированном давлении отношение объема газа к его температуре является постоянным.
Оба указанных закона объединяются в универсальное уравнение Клапейрона – Менделеева, которое называется также уравнением состояния идеального газа
(3) pV = n RT.
Здесь n – число молей газа, R = 8,317 Дж/моль· K – универсальная газовая постоянная.
Идеальный газ — это упрощенная модель реальных газов. В этой модели не учитываются объем молекул и силы взаимодействия между ними. Между тем молекулы реальных газов занимают определенный объем и взаимодействуют между собой. При больших давлениях и низких температурах становится заметным влияние собственных объемов молекул и сил взаимодействия между ними. При этих условиях уравнение Клапейрона—Менделеева и законы Бойля—Мариотта, Гей-Люссака, Шарля непригодны для описания состояния реальных газов.
22. Дайте определение понятию «химическое равновесие». Используя в качестве примера гомогенный и гетерогенный процессы: N2+3H2 = 2NH3; С+СО2 = 2СО, выведите выражения для констант химического равновесия на основе закона действия масс. Спрогнозируйте значение величин констант химического равновесия для этих процессов.
Химическое равновесие — динамическое состояние химической системы, в которой обратимо протекает химическая реакция, причём скорости прямой и обратной реакции равны между собой.
Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Константа равновесия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс).
Выражение для константы равновесия элементарной обратимой реакции может быть выведено из кинетических представлений.
Рассмотрим процесс установления равновесия в системе, в которой в начальный момент времени присутствуют только исходные вещества.
аА+bВ = cC+dD
Скорость прямой реакции V1 в этот момент максимальна, а скорость обратной V2 равна нулю:
V1=k1 * ca (A) * cb (B) V2=k2 * cc(C) * cd(D)
По мере уменьшения концентрации исходных веществ растет концентрация продуктов реакции; соответственно, скорость прямой реакции уменьшается, скорость обратной реакции увеличивается. Очевидно, что через некоторое время скорости прямой и обратной реакции сравняются, после чего концентрации реагирующих веществ перестанут изменяться, т.е. установится химическое равновесие. Приняв, что V1 = V2, можно записать:
k1 * ca (A) * cb (B) = k2 * cc(C) * cd(D)

Для реакции (1) N2+3H2⇄2NH3 константа равновесия имеет вид:
Кс1=[NH3]2 / [N2]*[H2]3.
Для реакции (2) С+СО2 = 2СО константа равновесия имеет вид:
Кс2=[CO]2 / [CO2].
Концентрацию углерода С не учитываем, т.к. это вещество находится в твердом агрегатном состоянии.
Константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л.
Если К>1, то скорость прямой реакции больше, чем скорость обратной реакции.
23. Дайте определение понятиям «проводник первого рода» и «проводник второго рода». Сделайте заключение о различии между проводниками первого и второго рода? Приведите примеры таких проводников. Смоделируйте и укажите, какова зависимость электропроводности таких проводников от температуры?
Проводники — это тела, в которых имеются свободные носители заряда, то есть заряженные частицы, которые могут свободно перемещаться внутри этих тел.
Проводники бывают первого и второго рода. К проводникам первого рода относят те проводники, в которых имеется электронная проводимость (посредством движения электронов). К проводникам второго рода относят проводники с ионной проводимостью (электролиты).
Проводниками первого рода являются металлы. К проводникам второго рода относятся растворы: кислот, солей, щелочей и оснований. Эти жидкостные проводники называются электролитами.
Электропроводность проводников I рода не сопровождается химическими процессами, она обусловлена электронами. На электродах, выполненных из проводников I рода, происходит процесс переноса катиона металла в раствор или из раствора на поверхность металла.
К проводникам II рода относятся электролиты. В них прохождение тока связано с химическими процессами и обусловлено движением положительных и отрицательных ионов.
Среди наиболее распространённых твёрдых проводников известны металлы, полуметаллы, углерод (в виде угля и графита).
Пример проводящих жидкостей при нормальных условиях — ртуть, электролиты, при высоких температурах — расплавы металлов.
Некоторые вещества при нормальных условиях являющиеся изоляторами при внешних воздействиях могут переходить в проводящее состояние, а именно проводимость полупроводников может сильно варьироваться при изменении температуры, освещённости, легировании и т. п.
У проводников I рода проводимость с ростом температуры уменьшается.
У проводников II рода проводимость с ростом температуры увеличивается.
Эти зависимости можно представить графически в координатах
(электропроводность – температура): 1 – зависимость для проводников 1-го рода;
σ  2 – зависимость для проводников 2-го рода.
2 – зависимость для проводников 2-го рода.

 1
1
 Т
Т
25. Дайте определение понятию «мицелла». Установите формулы мицеллы, полученной сливанием равных объемов электролитов указанной ниже концентрации 0,01 н КI и 0,001 н AgNO3. Систематизируйте и приведите названия всех слоев мицеллы. В данной модели укажите место возникновения ξ-потенциала.
Мицеллой обычно называют коллоидную частицу; в действительности же она представляет собой сложный комплекс, состоящий из:
1) главной массы коллоидного вещества («ядра»);
2) ионов, адсорбированных поверхностью ядра и несущих отрицательный или положительный заряд (в зависимости от природы коллоидного вещества);
3) ионов «спутников», или «противоионов», несущих заряд, противоположный адсорбированным ионам.
Мицеллы — частицы в коллоидных системах, состоят из нерастворимого в данной среде ядра очень малого размера, окруженного стабилизирующей оболочкой адсорбированных ионов и молекул растворителя.
Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
AgNO3 + KI ––> AgI + KNO3
Коллоидная мицелла золя иодида серебра (см. рис.) образована микрокристаллом иодида серебра AgI, который способен к избирательной адсорбции из окружающей среды катионов Ag+ или иодид-ионов I-.
Если реакция проводится в избытке иодида калия, то кристалл будет адсорбировать иодид-ионы; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag+. В результате этого микрокристалл приобретает отрицательный либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы. Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя т.н. адсорбционный слой противоионов; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд:
{[AgI]m · nAg+ · (n-x)NO3–}x+ · x NO3–
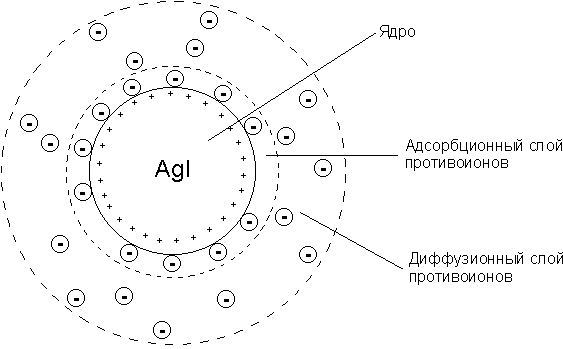
Рис. Строение коллоидной мицеллы
Задача:
 Дано: Решение:
Дано: Решение:
0,01 н раствор КI 1) Составим уравнение реакции
 0,001 н раствор AgNO3 AgNO3 + KI ––> AgI + KNO3
0,001 н раствор AgNO3 AgNO3 + KI ––> AgI + KNO3
формула мицеллы  -? 2) По уравнению реакции
-? 2) По уравнению реакции
n(AgNO3): n(KI) = 1: 1
3) Определим избыток – недостаток
КI  >
>  AgNO3
AgNO3
иодид калия КI находится в избытке.
4) Схематически мицелла золя иодида серебра, полученного в избытке иодида калия может быть изображена следующим образом:
{[AgI]m · nI– · (n-x)K+}x– · x K+
где агрегат – AgI, потенциалопределяющие ионы (ПОИ) – анионы I–, противоионы адсорбционного слоя – ионы (n-x)К+, противоионы диффузионного слоя x K+)
26. Дайте определение явлению «коагуляция». Обоснуйте, какие причины вызывают коагуляцию? Сформулируйте правило, отражающее влияние электролитов на процесс коагуляции. Спрогнозируйте, какой из электролитов обладает большей коагулирующей силой — NaCl или N  — для золя, полученного сливанием 0,01 н раствора AgNO3 и 0,001 н раствора NaCl.
— для золя, полученного сливанием 0,01 н раствора AgNO3 и 0,001 н раствора NaCl.
Коагуляция — это физико-химический процесс объединения (слипания) мелких частиц дисперсной фазы в более крупные под влиянием сил сцепления с образованием коагуляционных структур, которые при достижении определенной величины выпадают в осадок.
Коагуляция ведёт к выпадению из коллоидного раствора хлопьевидного осадка или к застудневанию.
Скорость коагуляции зависит от радиуса частиц, диффузии, температуры и растворимости.
Коагуляцию можно вызвать нагреванием, замораживанием, интенсивным перемешиванием и добавлением различных электролитов.
Наиболее легко достижима коагуляция под действием электролитов. Она подчиняется определенным правилам:
1) Минимальная концентрация электролита, вызывающая коагуляцию, называется порогом коагуляции.
2) Коагулирующее действие оказывает не весь электролит, а только ион, который имеет одинаковый заряд с зарядом противоионов мицеллы.
3) Коагулирующая способность иона зависит от его заряда. Чем выше заряд, тем больше его коагулирующая способность.
4) При одинаковой зарядности коагулирующая способность иона увеличивается с увеличением радиуса иона. Ионы органических соединений обладают более высокой коагулирующей способностью, чем ионы неорганических веществ.
 Дано: Решение:
Дано: Решение:
0,01 н раствор AgNO3 1) Составим уравнение, протекающей реакции
 0,001 н раствора NaCl AgNO3 + NaCl = AgCl + NaNO3
0,001 н раствора NaCl AgNO3 + NaCl = AgCl + NaNO3
 получен золь 2) по уравнению реакции
получен золь 2) по уравнению реакции
какой из электролитов n(AgNO3): n(NaCl) = 1: 1
обладает большей 3) Определим избыток – недостаток
коагулирующей силой AgNO3  >
>  NaCl
NaCl
NaCl или Na2SO4? Нитрат серебра AgNO3 находится в избытке.
5) Схематически мицелла золя хлорида серебра, полученного в избытке нитрата серебра может быть изображена следующим образом:
{[AgCl]m · nAg+ · (n-x) NO3-}x+ · x NO3-
где агрегат – AgCl, потенциалопределяющие ионы (ПОИ) – катионы Ag+, противоионы адсорбционного слоя – ионы (n-x) NO3-, противоионы диффузионного слоя - x NO3-)
6) Электролиты диссоциируют
NaCl à Na+ + Cl-
Na2SO4 à 2Na+ + SO42-
Коагулирующее действие оказывают либо катионы, либо анионы.
Одинаковый заряд с противоионами имеют анион Cl- и анион SO42-, значит они и оказывают коагулирующее действие. Но т.к. заряд аниона SO42- больше, то электролит Na2SO4 обладает большей коагулирующей силой.
28. Назовите термодинамические величины. Дайте определение термодинамической функции «энтропия»? Прокомментируйте ее статистическое толкование? Обоснуйте, как вычисляется изменение энтропии в равновесном изотермическом процессе? Спрогнозируйте изменение энтропии в данном процессе при стандартных условиях: N2+3H2=2NH3, если S°(N2)=191,49 Дж/К*моль, S°(Н 2)=130,52Дж/К*моль, S°(NН3)=192,7Дж/К*моль. Чем можно объяснить отрицательное значение 𝛥 S°?
Термодинамические величины - это физические величины, которые применяют при описании состояний и процессов в термодинамических системах.
Термодинамические величины: температура, давление, объём, энтропия, энтальпия, внутренняя энергия, работа, свободная энергия Гиббса.
Энтропия термодинамической системы при обратимом процессе определяется как отношение общего количества тепла Δ Q к величине абсолютной температуры T (то есть тепло, переданное системе, при постоянной температуре):
 .
.
Можно дать энтропии следующее статистическое толкование: энтропия является мерой неупорядоченности системы.
Количественная связь между энтропией S и термодинамической вероятностью W выражается формулой Больцмана:
 ; k-постоянная Больцмана (k = 1,38×10−23 Дж/К); W-термодинамическая вероятность (число возможных микросостояний (способов) с помощью которых можно представить данное макроскопическое состояние).
; k-постоянная Больцмана (k = 1,38×10−23 Дж/К); W-термодинамическая вероятность (число возможных микросостояний (способов) с помощью которых можно представить данное макроскопическое состояние).
С точки зрения термодинамики: с истема стремится самопроизвольно перейти в состояние с максимальной термодинамической вероятностью.
Значение изменения энтропии вычисляется с использованием одного из следствий закона Гесса: изменение энтропии реакции равно разности сумм энтропий продуктов реакции и исходных веществ.
Задача:
1) Составим уравнение реакции взаимодействия азота и водорода:
N2+3H2=2NH3
2) Вычислим изменение энтропии химической реакции по формуле
∆Sх.р. = ∑∆Sпродуктов - ∑∆Sисходных веществ
∆S(р-ции)=2*192,7-3*130,52-191,49=385,4-391,56-191,49=-197,65 Дж/моль*К
В этой реакции количество газообразных веществ уменьшается, соответственно энтропия системы понижается, т.к. уменьшается неупорядоченность системы.
30. На основании стандартных теплот образования и абсолютных стандартных энтропии соответствующих веществ вычислите ∆G°298 реакции, протекающей по уравнению CO2(г) + 4H2(г) = CH4(г) + 2H2O(ж). Вычислите изменение энтальпии и энтропии в реакции. Спрогнозируйте, возможна ли эта реакция при стандартных условиях?
Справочные данные:
∆Н°298, кДж/моль S°298,Дж/моль*К
CO2(г) -396,3 213,6
Н2(г) 0 130,6
CН4(г) -74,85 186,19
Н2О(ж) -285,84 70,1
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Обозначение стандартной энтальпии —∆Н 2980, где 0 указывает на равенство давления одной атмосфере, а 298 — температура.
Стандартную энтропию вещества обозначают символом SТ0 (р=101,3 кПа), ее можно определить при любом значении температуры, однако для удобства сравнения величин SТ0 для различных веществ их определяют обычно при стандартных термодинамических условиях (р=101,1кПа, Т=298 К) и обозначают S298О
(Дж/моль К).
Задача:
1. Вычислим, применяя следствия из закона Гесса, изменение энтальпии реакции:
∆Н0х.р. = ∑∆Н0продуктов - ∑∆Н0исх. веществ
∆Нх.р.= 2*∆Н° (Н2О) + ∆Н° (СН4) – (4*∆Н°(Н2) + ∆Н° (СО2))=
=2*(-285,84)+(-74,85) – (4*0 + (-396,3))=-571,68-74,85+396,3=-250,23 кДж
2. Вычислим, применяя следствия из закона Гесса, изменение энтропии реакции:
∆S0х.р. = ∑∆S0продуктов - ∑∆S0исх. веществ
ΔSх.р.= 2*S° (Н2О) +S° (СН4) – (4*S°(Н2) +S° (СО2))=
=2*70,1+186,19-(4*130,6+213,6)=-409,61 Дж/К= -0,40961 кДж/К
3. Для определения возможности протекания химической реакции необходимо вычислить изменение энергии Гиббса реакции по формуле: ∆G=∆Н-Т∆S,
т.к. условия стандартные, то температура Т=298 К
Δ G = -250,23 – 298*(-0,40961)=-128,17 кДж
4. Если Δ G < 0 реакция термодинамически возможна;
Δ G > 0 указывает на то, что реакция термодинамически невозможна.
В стандартных условиях данная реакция возможна, т.к. Δ G < 0.
31. Теплоты образования ∆H°298 оксида азота (II) и оксида азота (IV) соответственно равны +90,37 кДж и +33,85 кДж. Определите ∆S°298 и ∆G°298 для реакций получения NO и NO2 из простых веществ. Спрогнозируйте, можно ли получить эти оксиды при стандартных условиях? Какой из оксидов образуется при высокой температуре? Почему?
Справочные данные:
∆Н°298, кДж/моль S°298,Дж/моль*К
O2(г) 0 205,0
N2(г) 0 191,5
NO(г) 90,37 210,6
NO2(г) 33,50 240,45
1. Составим уравнения реакций получения оксида азота (II) и оксида азота (IV) из простых веществ:
N2+ O2 = 2NO (1)
N2+ 2O2=2NO2 (2)
2. Вычислим изменение энтропии для реакций (1) и (2), используя следствие из закона Гесса:
ΔSреакции 1= Σ iS°298 (продуктов реакции) – Σ jS°298 (исходных веществ) = 2*210,6 – (205 + 191,5) = 421,2 – 396,5 = 24,7 Дж/моль*К
ΔSреакции 2= Σ iS°298 (продуктов реакции) – Σ jS°298 (исходных веществ) = 2*240,45 – (2*205 + 191,5) = 480,9 – 601,5 = - 120,6 Дж/моль*К
3. Вычислим изменение энергии Гиббса для реакций (1) и (2) по формуле
∆G=∆Н-Т∆S, предварительно переведя значения ΔS из Дж в кДж:
24,7 Дж/моль*К = 0, 0247 кДж/моль*К
-120,6 Дж/моль*К= - 0,1206 кДж/моль*К
∆G(1)=90,37-298*0,0247=83,0094 кДж
∆G(2)=33,50-298*(-0,1206)=69,4388 кДж
4. При Δ G < 0 реакция термодинамически возможна;
Δ G > 0 указывает на то, что процесс термодинамически невозможен.
В стандартных условиях эти оксиды получить нельзя, т.к. при Т=298 К значения ∆G>0 для двух реакций.
Для 1-ой реакции ∆G может принять отрицательное значение при высоких температурах. Вычислим, при какой температуре можно получить данный оксид:
Δ G < 0, тогда ∆Н>Т/ ΔS, а Т>∆Н/ ΔS
Т1>90,37/0,0247>3658,7 К.
Для 2-ой реакции ∆G при любой температуре имеет положительное значение, т.к. изменение энтропии ΔS имеет отрицательное значение.
32. Дайте определение понятию «скорость химической реакции». Аргументируйте, какие факторы влияют на скорость реакции? Для реакции N2+3H2⇄2NH3 составьте выражения скорости прямой и обратной реакции через закон действующих масс. Как изменяется скорость реакции во времени? Как влияет температура на скорость реакции?
Скорость химической реакции — величина, которая показывает изменение количества вещества одного из реагирующих веществ за единицу времени в единице объема.
Факторы, влияющие на скорость реакции:
1) Скорость реакции зависит от природы реагирующих веществ. Металлы реагируют с соляной кислотой с различной скоростью: магний реагирует быстрее железа, а медь не реагирует вовсе.
2) Для веществ в растворенном состоянии и газов скорость реакции зависит от концентрации реагирующих веществ.
3) Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности реагирующих веществ. Чем сильнее измельчено твердое вещество, тем больше его поверхность.
4) При повышении температуры на каждые 10°С скорость большинства реакций увеличивается в 2–4 раза. Железо при обычной температуре реагирует с хлором очень медленно, при высокой же температуре протекает бурная реакция.
5) Скорость реакции зависит от присутствия некоторых веществ (катализаторов и ингибиторов).
Закон действующих масс формулируется так: скорость реакции прямопропорциональна произведению концентраций реагирующих веществ с учетом стехиометрических коэффициентов.
Тогда для реакции N2+3H2⇄2NH3 выражения скорости прямой и обратной реакции через закон действующих масс будут иметь вид:
Vпрямой=k1*c(N2)*c(H2)3
Vобратной=k2*c(NH3)2
На графиках а и б представлена зависимость скорости прямой и обратной реакций:

Вывод: скорость прямой реакции со временем уменьшается (график а), т.к. уменьшается концентрация реагирующих веществ, а скорость обратной реакции со временем увеличивается (график б), т.к. увеличивается концентрация продуктов реакции.
Известно правило Вант-Гоффа — правило, позволяющее оценить влияние температуры на скорость химической реакции в небольшом температурном интервале. Оно формулируется следующим образом: при повышении температуры на каждые 10 градусов скорость реакции увеличивается в два — четыре раза.
33. Дайте определение явлению «коагуляция». Обоснуйте, какие причины вызывают коагуляцию? Сформулируйте правило, отражающее влияние электролитов на процесс коагуляции. Спрогнозируйте, какой из электролитов обладает большей коагулирующей силой — СaCl2 или NаСl — для золя, полученного сливанием 0,001 н раствора AgNO3 и 0,01 н раствора NaCl.
Коагуляция — это физико-химический процесс объединения (слипания) мелких частиц дисперсной фазы в более крупные под влиянием сил сцепления с образованием коагуляционных структур, которые при достижении определенной величины выпадают в осадок.
Коагуляция ведёт к выпадению из коллоидного раствора хлопьевидного осадка или к застудневанию.
Скорость коагуляции зависит от радиуса частиц, диффузии, температуры и растворимости.
Коагуляцию можно вызвать нагреванием, замораживанием, интенсивным перемешиванием и добавлением различных электролитов.
Наиболее легко достижима коагуляция под действием электролитов. Она подчиняется определенным правила м:
5) Минимальная концентрация электролита, вызывающая коагуляцию, называется порогом коагуляции.
6) Коагулирующее действие оказывает не весь электролит, а только ион, который имеет одинаковый заряд с зарядом противоионов мицеллы.
7) Коагулирующая способность иона зависит от его заряда. Чем выше заряд, тем больше его коагулирующая способность.
8) При одинаковой зарядности коагулирующая способность иона увеличивается с увеличением радиуса иона. Ионы органических соединений обладают более высокой коагулирующей способностью, чем ионы неорганических веществ.
 Дано: Решение:
Дано: Решение:
0,01 н раствор NaCl 1) Составим уравнение, протекающей реакции
 0,001 н раствора AgNO3 AgNO3 + NaCl = AgCl + NaNO3
0,001 н раствора AgNO3 AgNO3 + NaCl = AgCl + NaNO3
 получен золь 2) по уравнению реакции
получен золь 2) по уравнению реакции
какой из электролитов n(AgNO3): n(NaCl) = 1: 1
обладает большей 3) Определим избыток – недостаток
коагулирующей силой NaCl  >
>  AgNO3
AgNO3
NaCl или CaCl2 Хлорид натрия NaCl находится в избытке.
7) Схематически мицелла золя хлорида серебра, полученного в избытке хлорида натрия может быть изображена следующим образом:
{[AgCl]m · n Cl- · (n-x) Na+}x- · x Na+
где агрегат – AgCl, потенциалопределяющие ионы (ПОИ) – анионы Cl-, противоионы адсорбционного слоя – ионы (n-x) Na+, противоионы диффузионного слоя - x Na+)
8) Электролиты диссоциируют
NaCl à Na+ + Cl-
CaCl2 à Ca2+ + 2Cl-
Коагулирующее действие оказывают либо катионы, либо анионы.
Одинаковый заряд с противоионами имеют катионы Na+ и Ca2+, значит они и оказывают коагулирующее действие. Но т.к. заряд катиона Ca2+ больше, то электролит CaCl2 обладает большей коагулирующей силой.
34. Дайте определение понятию «раствор». Опишите, в чем заключается отличие растворов и химических соединений? Преобразуя имеющиеся данные, рассчитайте процентную, молярную и моляльную концентрации раствора, полученного смешением 9,8 г Н2SO4 и 1000 г Н2O (плотность раствора примите равной 1, М(Н2SO4)=98 г/моль, М(Н2O)=18 г/моль). Спрогнозируйте возможные виды взаимодействия между компонентами в данном растворе.
Раство́р — гомогенная (однородная) смесь переменного состава, образованная двумя или более компонентами, один из которых называется растворителем, а другой растворимым веществом.
Отличие растворов от химических соединений состоит в том что, состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов приближает их к механическим смесям, но от последних они резко отличаются своей однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
 Задача:
Задача:
Дано:
m(Н2SO4)=9,8 г
 m(H2O)=1000 г
m(H2O)=1000 г
W(Н2SO4)-?
СМ(Н2SO4)-?
сm(Н2SO4)-?
Решение:
1. Вычислим массу раствора: m(раствора) = m(H2O)+m(вещ-ва),
m(раствора) =1000+9,8=1009,8 г
2. Вычислим массовую долю соли: W(Н2SO4)= m(вещ-ва)/ m(раствора)*100% W(NaCl)=(9,8/1009,8)*100%=0,97%
3. Вычислим химическое количество кислоты: n(Н2SO4)=m(Н2SO4)/M(Н2SO4),
М(Н2SO4)=2+32+16*4=98г/моль
n(NaCl)=9,8/98=0,1 моль
4. Вычислим молярную концентрацию кислоты в растворе: СМ=n/Vp;
Vp=m(раствора) /ρ, Vp =1009,8/1=1009,8мл=1,0098л;
СМ(Н2SO4)= 0,1/1,0098= 0,099 моль/л
5. Вычислим моляльность раствора: сm(Н2SO4)=n (Н2SO4)/m(растворителя, кг),
сm(NaCl)=0,1моль/1кг=0,1моль/кг.
Ответ: W(Н2SO4)=0,99%;СМ(Н2SO4)=0,168 моль/л; сm(Н2SO4)=0,1моль/кг.
В общем случае при растворении происходит изменение свойств и растворителя, и растворенного вещества, что обусловлено взаимодействием частиц между собой по различным типам взаимодействия: Ван-дер-Ваальсового (во всех случаях), ион-дипольного (в растворах электролитов в полярных растворителях), специфических взаимодействий (образование водородных или донорно-акцепторных связей).
Для данного вещества будет возможно Ван-дер-Ваальсовое и ион-дипольное взаимодействие.
35. Дайте определение понятию «цепная реакция». Назовите основные стадии цепных реакций и охарактеризуйте каждую из них. Составьте уравнения реакций пиролиза этана, протекающего по цепному механизму. Спрогнозируйте основные продукты пиролиза этана.
В ряде случаев в химических реакциях в качестве промежуточных продуктов выступают свободные атомы и радикалы, которые имеют свободные валентности и потому обладают высокой реакционной способностью. Эти частицы вступают в реакции, в результате которых вновь возникают свободные атомы и радикалы. Такая последовательность периодически повторяющихся реакций с участием активных частиц (свободных атомов и радикалов) называется цепной реакцией.
Хотя процесс образования свободных атомов или радикалов требует большой энергии активации, но их высокая реакционная способность и возникновение новых активных частиц при реакциях с насыщенными молекулами приводят к тому, что скорость цепных реакций оказывается обычно значительно выше скорости нецепных реакций.
Примеров цепных реакций можно привести множество: взаимодействие водорода и углеводородов с хлором и бромом, термическое разложение озона, крекинг углеводородов, реакции полимеризации и поликонденсации, ядерные реакции.
Любая цепная реакция трёхстадийна.
На первой стадии образуются исходные активные центры (свободные атомы и радикалы), т.е. происходит зарождение цепи. Как правило, эта стадия инициируется квантом света, либо неустойчивыми соединениями типа пероксидов а также парами легколетучих металлов (натрий, ртуть и др.) и многими неорганическими соединениями.
Эти активные центры взаимодействуют со стабильными молекулами с образованием одной или нескольких активных частиц. Вторая стадия имеет название стадии развития или продолжения цепи. На этой стадии могут происходить:
1. Взаимодействие атома или свободного радикала с молекулой реагента с образованием новых свободных радикалов;
2. Взаимодействие атома или свободного радикала с молекулой реагента с образованием нового радикала и продукта реакции;
3. Мономолекулярный распад свободного радикала с образованием нового радикала и продукта;
4. Взаимодействие свободных радикалов с образованием нового радикала и продукта.
Наконец, две активные частицы могут рекомбинировать (соединиться) в
стабильную молекулу, в результате чего цепь обрывается, третья стадия –
Стадия обрыва цепи.
Составим уравнения реакций пиролиза этана:
1 стадия – зарождение цепи
СН3—СН3 à •CH3 + •CH3
СН3—СН3 à •H + •CH2—CH3
2 стадия – развитие цепи
СН3—СН3 + •CH3 à•CH2—CH3 + СН4
СН3—СН3 + •H à •CH2—CH3 + Н2
СН3—СН3 + •H à СН4 + •CH3
3 стадия – обрыв цепи
•CH3 + •CH3 à СН3—СН3
•CH3 + •H à СН4
•CH2—CH3 + •CH3 à СН3— CH2—CH3
Продуктами пиролиза этана являются метан, водород, пропан и др.






