Если водородный электрод является анодом, то на нем протекает реакция окисления:
Н20 – 2е = 2Н+.
Если водородный электрод является катодом, то на нем протекает реакция восстановления:
2Н+ + 2е = Н20.
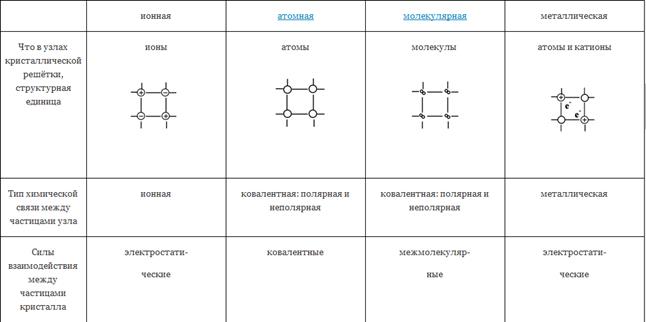
15. Дайте характеристику твердому агрегатному состоянию вещества, с точки зрения энергии и расстояния между частицами. На какие группы делят кристаллические вещества по внутреннему строению? Охарактеризуйте понятие «кристаллическая решетка». Как тип кристаллической решетки влияет на физические свойства вещества?
В зависимости от внешних условий (температуры и давления) каждое вещество может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Эти состояния называются агрегатными состояниями. Для некоторых веществ характерно только два или даже одно агрегатное состояние. Например, нафталин, йод при нагревании в обычных условиях из твердого состояния переходят в газообразное состояние, минуя жидкое. Такие вещества, как белки, крахмал, каучуки, имеющие огромные макромолекулы, не могут существовать в газообразном состоянии.
Твердые тела в отличие от жидкостей и газов сохраняют свою форму. Силы притяжения между частицами, составляющими твердое тело, настолько велики, что они не могут двигаться свободно относительно друг друга, а только колеблются около какого-то среднего положения. Частицы твердого вещества обладают большим значением потенциальной энергии, и невысоким значением кинетической энергии.
Все твердые тела делят на кристаллические и аморфные. В кристаллических телах частицы расположены в определенном характерном для каждого вещества порядке и этот порядок распространяется на весь объем. Во всем объеме аморфного тела порядка в расположении частиц нет. В этом отношении аморфные тела можно рассматривать как жидкости с аномально большой вязкостью.
Кристаллическая форма – наиболее устойчивая, вещества постепенно переходят из аморфного состояния в кристаллическое. В обычных условиях этот процесс идет очень медленно, повышение температуры может его ускорить. Например, сахар может быть в кристаллическом (сахар-песок, кусковой сахар) и в аморфном (карамелизованный) состояниях. Со временем карамель может кристаллизоваться, что нежелательно в кондитерском производстве.
Порядок в пространственном расположении частиц и кристаллических тел – кристаллическая решетка – определяет внешние признаки кристаллического состояния. К ним относятся: 1) определенная и резко выраженная температура плавления; 2) определенная геометрическая форма одиночных кристаллов; 3) анизотропия.

16. Дайте характеристику жидкому агрегатному состоянию вещества, с точки зрения энергии и расстояния между частицами. От чего зависят свойства жидкостей? Какие физические свойства характеризуют жидкое состояние вещества? Дайте им характеристику и объясните, от каких факторов они зависят.
В зависимости от внешних условий (температуры и давления) каждое вещество может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Эти состояния называются агрегатными состояниями. Для некоторых веществ характерно только два или даже одно агрегатное состояние. Например, нафталин, йод при нагревании в обычных условиях из твердого состояния переходят в газообразное состояние, минуя жидкое. Такие вещества, как белки, крахмал, каучуки, имеющие огромные макромолекулы, не могут существовать в газообразном состоянии.
В отличие от газов между молекулами жидкости действуют достаточно большие силы взаимного притяжения, что определяет своеобразный характер молекулярного движения. Тепловое движение молекулы жидкости включает колебательное и поступательное движения. Каждая молекула в течение какого-то времени колеблется около определенной точки равновесия, затем перемещается и снова занимает новое равновесное положение. Это определяет ее текучесть. Силы межмолекулярного притяжения не дают молекулам при их движении далеко отходить друг от друга. Суммарный эффект притяжения молекул можно представить как внутреннее давление жидкостей, которое достигает очень больших значений. Этим и объясняются постоянство объема и практическая не сжимаемость жидкостей, хотя они легко принимают любую форму.
Свойства жидкостей зависят также от объема молекул, формы и полярности их. Если молекулы жидкости полярны, то происходит объединение (ассоциация) двух и более молекул в сложный комплекс. Такие жидкости называют ассоциированными жидкостями. Ассоциированные жидкости (вода, ацетон, спирты) имеют более высокие температуры кипения, обладают меньшей летучестью, более высокой диэлектрической проницаемостью. Например, этиловый спирт и диметиловый эфир имеют одинаковую молекулярную формулу (С2Н6О). Спирт является ассоциированной жидкостью и кипит при более высокой температуре, чем диметиловый эфир, который относится к неассоциированным жидкостям.
Жидкое состояние характеризуют такие физические свойства, как плотность, вязкость, поверхностное натяжение.
Вязкость η (Па·с) – свойство оказывать сопротивление перемещению одной части жидкости относительно другой. В практической жизни человек сталкивается с большим множеством жидких систем, вязкость которых различна, – вода, молоко, растительные масла, сметана, мед, соки, патока и т. д.
Вязкость жидкостей обусловлена межмолекулярным воздействием, ограничивающим подвижность молекул. Она зависит от природы жидкости, температуры, давления.
Для измерения вязкости служат приборы, называемые вискозиметрами. Выбор вискозиметра и метода определения вязкости зависит от состояния исследуемой системы и ее концентрации.
17. Дайте характеристику газообразному агрегатному состоянию вещества, с точки зрения энергии и расстояния между частицами. Какие свойства характерны для газов? Что такое «идеальный газ»? При каких условиях реальные газы похожи на идеальные? Какими уравнениями описываются идеальный и реальные газы?
В зависимости от внешних условий (температуры и давления) каждое вещество может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Эти состояния называются агрегатными состояниями. Для некоторых веществ характерно только два или даже одно агрегатное состояние. Например, нафталин, йод при нагревании в обычных условиях из твердого состояния переходят в газообразное состояние, минуя жидкое. Такие вещества, как белки, крахмал, каучуки, имеющие огромные макромолекулы, не могут существовать в газообразном состоянии.
Для газов характерны, следующие свойства:
- равномерное заполнение всего предоставленного объема;
- малая плотность по сравнению с жидкими и твердыми веществами и большая скорость диффузии;
- сравнительно легкая сжимаемость.
Эти свойства определяются силами межмолекулярного притяжения и расстоянием между молекулами.
В газе молекулы находятся на очень большом расстоянии друг от друга, силы притяжения между ними ничтожно малы. При низких давлениях расстояния между молекулами газа настолько велики, что по сравнению с ними размером молекул, а, следовательно, объемом молекул в общем объеме газа можно пренебречь. При больших расстояниях между молекулами практически отсутствуют силы притяжения между ними. Газ в таком состоянии называется идеальным. При нормальных условиях Т=273К (00С) и p=101,325 кПа реальные газы независимо от природы можно считать идеальными и применять к ним уравнение состояния идеального газа (уравнение Клайперона-Менделеева):
PV = n RT, (1)
где
Р – давление газа,
V – объем газа,
n – количество вещества,
R – универсальная газовая постоянная (в единицах СИ R =8,314 Дж/моль*К),
Т – абсолютная температура.
Реальные газы при высоких давлениях и низких температурах не подчиняются уравнению состояния идеального газа, так как в этих условиях начинают проявляться силы взаимодействия между молекулами и уже нельзя пренебрегать собственным объемом молекул по сравнению с объемом тела. Для математического описания поведения реальных газов используют уравнение Ван-дер-Ваальса:
(р + n2 a/V2) (V - nb) = nRT, (2)
где
а и b – постоянные,
a/V2 – поправка на взаимное притяжение,
b – поправка на собственный объем молекул,
n – число молей газа.
Для одного моля газа уравнение Ван-дер-Ваальса имеет вид:
(p + a/V)(V - b) = R T.
18. Дайте определение понятиям «критическое давление», «критическая температура», «критическое состояние». Чему равна плотность газа в критическом состоянии? Какие параметры называются приведенными? Сформулируйте закон соответственных состояний.






