Окисно-відновна реакція може відбуватися хімічним шляхом - коли електрони від відновника безпосередньо переходять до окисника. Енергія хімічної реакції в цьому процесі перетворюється на теплову.
Якщо окисно-відновні процеси просторово відокремити, що відбувається у гальванічних елементах, перехід електронів від відновника до окисника спричинює виникнення електричного струму та перетворення хімічної енергії в електричну.
Незалежно від того, за яким шляхом, хімічним або електрохімічним, проходить реакція, енергетичні зміни у системі однакові. З курсу термодинаміки відомо, що
-D G = А макс = nEF,
де n - кількість електронів у сумарній електродній реакції; Е - ЕРС гальванічного елементу, В; F - число Фарадея (кількість електрики, яку переносить один еквівалент електронів); F = e NА , Кл /моль.
З другого боку зміна енергії Гіббса повʼязана з константою хімічної рівноваги рівнянням D G = - RT . ln K. В цьому випадку K - константа рівноваги відповідної ОВ реакції. Виходячи з цих рівнянь Нернст довів формулу для розрахунку потенціалів електродів.
j = j0 - 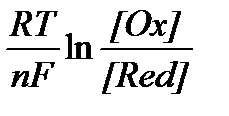 (1)
(1)
2,3 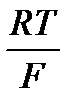 = 0,059(2,3 - основа натурального логарифму), тому для температури 298 К рівняння можна спростити
= 0,059(2,3 - основа натурального логарифму), тому для температури 298 К рівняння можна спростити
j = j0 - 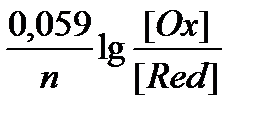 (2)
(2)
Типи електродів
Електроди, які застосовують у електрохімії залежно від типу оборотності, числа і агрегатного стану фаз, поділяють на кілька груп.
Електроди першого роду. До них відносяться метал-іонні електроди. Найбільш поширені метал-іонні електроди. Наприклад, цинковий (Zn2+|Zn), мідний (Cu2+|Cu), залізний (Fe 2+|Fe ) електроди, у яких метал занурено у розчин власних іонів.Загальна електродна реакція має вигляд:
Ме - n ē ® Ме n +
Рівняння Нернста для них має вигляд:
j(Ме n +|Me) = j0(Me n +|Me) + 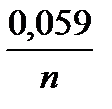 lg [Me n +].
lg [Me n +].
Потенціал цих електродів залежить тільки від концентрації катіонів у електроліті, тому що концентрація самого металу практично не змінюється і є сталою.
Зазначимо, що в ортопедичній стоматології для виготовлення зубних протезів використовують близько двадцяти металів. Якщо у ротовій порожнині знаходяться протези, виготовлені з різних металів, то при змочуванні їх ротовою рідиною утворюється гальванічний елемент. Електричний струм, який виникає під час його роботи, призводить до появи патологічних станів, які називають гальванозом.
Для нього характерні такі симптоми, як металевий присмак, відчуття кислоти, зіпсуття смаку, зміна слиновиділення та ін. Тривале користування такими зубними протезами може призвести до появи алергічних захворювань, уражень печінки, шлунково-кишкового тракту, гінгівіту тощо, тому заcтосування різних металів та сплавів для виготовлення зубних протезів недопустиме.
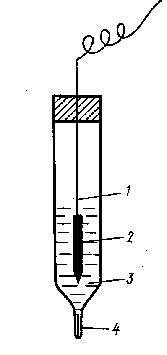 Електроди другого роду. Вони складаються з металу, покритого нерозчинним осадом його сполуки (солі або гідроксиду) і зануреного у розчин, який містить такі ж аніони, як і осад. До них належать, наприклад, каломельний електрод і хлор-срібний електрод.
Електроди другого роду. Вони складаються з металу, покритого нерозчинним осадом його сполуки (солі або гідроксиду) і зануреного у розчин, який містить такі ж аніони, як і осад. До них належать, наприклад, каломельний електрод і хлор-срібний електрод.
Хлор-срібний електрод складається з срібного дротика 1, покритого шаром хлориду срібла 2, який занурено у розчин хлориду калію 3. Електролітичний контакт з зовнішнім розчином відбувається крізь гніт з азбесту 4. Схема хлор-срібного електрода така: Ag,AgCl|KCl. Він оборотний відносно катіону Ag+ і аніону Сl- згідно з реакціями:
Ag+ + ē ® Ag0 та AgCl + ē ® Ag0 + Cl-. Його потенціал залежить від концентрації КСl: j (1 н. КСl) = +0,237 В; j(0,1 н. КСl) = +0,29 В.
У загальному вигляді в таких електродах встановлюється рівновага
МеА (осад) ® Меn+ + A‒ n (розч) ® Ме0 + A‒ n + n ē.
Концентрація катіонів залежить від KS малорозчиненої речовини:
[ Меn+] = 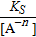
Потенціал цих електродів визначається за формулою:
j = j0 + 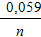 lg[ А‒ n ], j(Ag,AgCl|KCl) = j0 (Ag,AgCl|KCl) + 0,059lgCl‒.
lg[ А‒ n ], j(Ag,AgCl|KCl) = j0 (Ag,AgCl|KCl) + 0,059lgCl‒.
Електроди другого роду використовують як електроди порівняння, замість не дуже зручного водневого електроду. Вони відрізняються простотою виготовлення і сталим значенням потенціалу.
Газові електроди. Прикладом газового електроду є водневий електрод. До них відносяться також кисневий (Pt,O2|OH-) та хлорний (Pt,Cl2|2Cl-) електроди.
Потенціал газових електродів залежить від концентрацій окисної та відновної форм речовини. Наприклад, при Р (Н2) = 101,3 кПа потенціал водневого електроду розраховується за формулою
j = −0,059 рН.
Окисно-відновні електроди. До окисно-відновних електродів (або редокс-електродів), належать напівелементи, які складаються з інертного металу (платина, золото) або графіту, зануреного у розчин, в якому містяться окиснена та відновна форма однієї і тієї ж речовини. Наприклад:
Pt,Fe3+|Fe2+; Fe3+ + ē ® Fe2+
Атоми платини не беруть участь у електродному процесі, а є тільки переносниками електронів. Величина електродного потенціалу залежить від концентрацій окисної та відновної форм речовини
j = j0 + 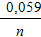 lg
lg 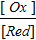 ;
;
j(Fe) = j0(Fe) + 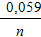 lg
lg 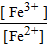 .
.
Cтандартні окисно-відновні потенціали зведені у таблиці і також визначаються за водневою шкалою, тобто порівнюються зі стандартним водневим електродом. Вони характеризують здатність системи функцінувати в якості окисника або відновника. Чим позитивніше значення ОВ потенціалу, тим сильнішим окисником є система. Знак (−) означає, що самовільно відбувається процес відновлення, знак (+) − процес окиснення. Наприклад:
електрод електродний процес j, в самовільний процес
Pt,Cr3+ïCr2+ Cr3+ + 1ē «Cr2+ −0,41 Cr2+ −1ē ® Cr3+
Pt,Sn4+ïSn2+ Sn4+ + 2ē «Sn2+ +0,15 Sn4+ + 2ē ® Sn2+
Використання розрахунку ЕРС для окисно-відновних кіл дає можливість визначити напрямок окисно-відновної реакції незалежно від того, хімічним, або електрохімічним шляхом вона йде. Враховується, що відновна реакція відповідає анодному процесу, а окисна реакція − катодному. Тоді
. ЕРС = j кат − j ан = j окис − j від > 0.
Наприклад: Визначити, у якому напрямку буде відбуватися реакція
Sn2+ + Pb4+ ® Sn4+ + Pb2+
Знайдемо по таблиці значення стандартних потенціалів даних ОВР
Sn4+ +2ē ® Sn2+; j0 = 0,15 В − анод
Pb 4+ + 2ē ® Pb 2+; j0 = 1,69 В − катод
ЕРС = jкат − j ан = 1,69 − 0,15 = 1,54 (В), тобто реакція відбувається за прямим напрямком.
Застосування ОВП для характеристики біологічних систем
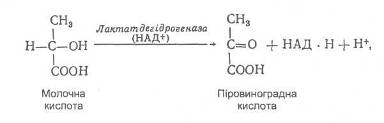
Біологічне окиснення є основним джерелом енергії в організмі. Цей процес має багатоступінчастий характер і може відбуватися шляхом перенесення електронів або протонів. Більшість біохімічних окисно-відновних реакцій відбувається за участю йонів Гідрогену, наприклад, окиснення молочної кислоти до піровиноградної:
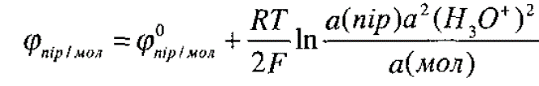
Окисно-відновний потенціал цієї системи залежить не тільки від співвідношення концентрацій піровиноградної (окиснена форма) та молочної (відновлена форма) кислот, але й від активності йонів Н+:
Величину окисно-відновних потенціалів у біохімії завжди наводять за ст.у. при рН = 7
j = −0,059 рН = ‒0,059∙7 = ‒ 0,41 В.
Від’ємне значення потенціалу напівреакції свідчить про відновні властивості системи, бо чим більше від’ємне значення редокс-потенціалу, тим сильнішою є здатність даної редокс-пари віддавати електрони, і навпаки. Наприклад, редокс-потенціал пари, яка складається з нікотинамідаденіндинуклеотиду ‒ НАД∙Н|НАД+ дорівнює ‒0,32 В, що свідчить про її високу здатність віддавати електрони, а редокс-потенціал пари 1/2О2| Н2О має додатну величину 0,816 В, тому кисень виявляє високу здатність до приєднання електронів.
Таблиця 1. Стандартні окисно-відновні потенціали деяких біологічних систем
| Система | j0, В | Система | j0, В |
| Н2|Н3О+ | ‒0,42 | ФАДН2|ФАД | ‒0,22 |
| Форміат|СО2 | ‒0,42 | Лактат|піруват | ‒0,185 |
| НАДФН|НАДФ+ | ‒0,032 | Гемоглобін | +0,17 |
| НАД∙Н|НАД+ | ‒0,32 | О2|Н2О | +0,816 |
Величина окисно-відновного біохімічного потенціалу дає змогу передбачити напрямок потоку електронів під час біологічного окиснення та розраховувати зміну енергії при перенесенні електронів від однієї редокспари до іншої.
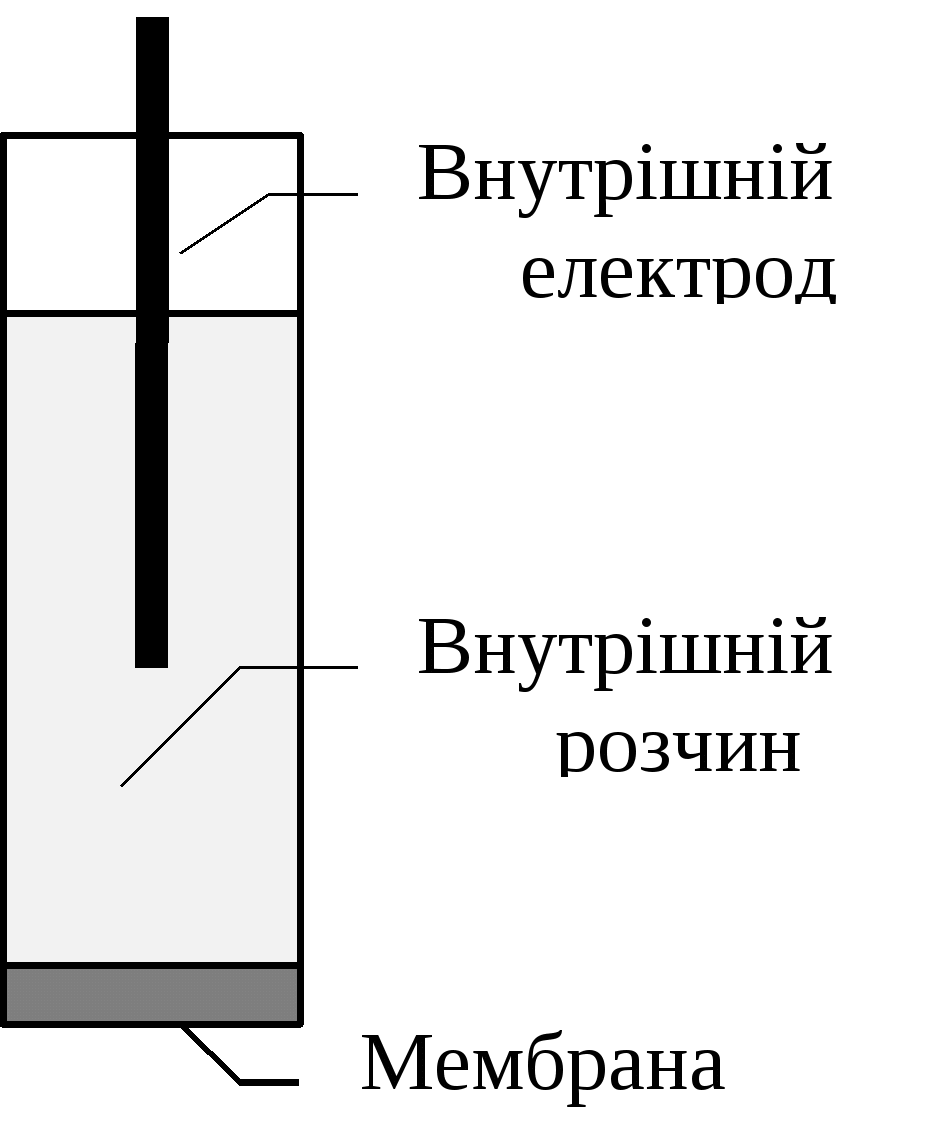
Йоноселективні електроди. Йоноселективними називаються електроди, потенціал яких залежить від концентрації (активністі) певного виду йонів (потенціалутворюючих іонів).Вони складаються з пластмасового або скляного корпусу, внутрішнього допоміжного інертного електроду, який занурено у розчин певної концентрації досліджених іонів і мембрани, розташованої на кінці корпусу, яка контактує з дослідженим розчином і розчином певної концентрації. Мембрана ‒ основна складова частина електроду. Такі електроди часто називають мембранними і класифікують за типом мембрани: скляні, кристалічні, рідкі та плівкові. Мембрани вміщують електродно-активні речовини, які забезпечують процес селективного обміну йонами між мембраною та розчином. При зануренні йоноселективного електрода у досліджуваний розчин виникає потенціал, величина якого залежить від активності потенціалутворюючих іонів.
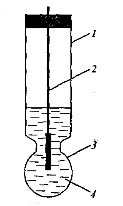 До цих електродів належить скляний електрод для вимірювання рН. Він складається з скляного корпусу 1, до якого припаяна куляста мембрана з електродного скла 3. У середину корпусу заливають розчин НСl з певною концентрацією 4 та занурюють допоміжний хлорсрібний електрод 2. Електродне скло мембрани є сплавом силікатів лужних та лужноземельних металів. Силікати, як солі слабкої кислоти у розчині гідролізуються, при цьому іони металів заміщуються на іони водню й на поверхні скла утворюється тонкий шар гелю кремнієвої кислоти товщиною 1–100 нм. В цьому шарі й відбуваються іонообмінні реакції з розчином, наприклад,
До цих електродів належить скляний електрод для вимірювання рН. Він складається з скляного корпусу 1, до якого припаяна куляста мембрана з електродного скла 3. У середину корпусу заливають розчин НСl з певною концентрацією 4 та занурюють допоміжний хлорсрібний електрод 2. Електродне скло мембрани є сплавом силікатів лужних та лужноземельних металів. Силікати, як солі слабкої кислоти у розчині гідролізуються, при цьому іони металів заміщуються на іони водню й на поверхні скла утворюється тонкий шар гелю кремнієвої кислоти товщиною 1–100 нм. В цьому шарі й відбуваються іонообмінні реакції з розчином, наприклад,
H+р-н + Na+скло ® H+скло + Na+р-н.
Потенціал скляного електрода зумовлений обміном іонів лужних металів в склі з іонами водню з розчину. Енергетичний стан їх різний, тому іони водню так розподіляються між склом і розчином, що поверхні цих фаз здобувають протилежні заряди, тобто між склом і розчином виникає різниця потенціалів, значення якої залежить від рН розчину ‒ j = j0 – 0,059 рН.
Таким чином, за допомогою цих електродів вимірюють рН розчинів. Скляні електроди випускаються серійно (ЭСЛ-ПГ-05, ЭСЛ-41М-04, ЭСЛ -63-07, ЭСЛ-43-07) й придатні для роботи в інтервалі рН від 0 до 14.
Крім скляних електродів, призначених для виміру рН, випускаються також скляні електроди для виміру активності лужних металів. Вітчизняна промисловість випускає скляні електроди для виміру активності іонів Na+(ЭCNа-51-07),K+ (ЭСК-91-07).
Стандартний потенціал скляних електродів залежить від сорту електродного скла і змінюється з часом, тому перед застосуванням їх калібрують за стандартними розчинами відповідних електролітів.Калібровку проводять з використанням наборів фіксаналів речовин з певним значенням рН. Скляний електрод з водневою функцією перед застосуванням вимочують протягом доби у дистильованій воді або слабкому розчині соляної кислоти; скляні електроди з металевою функцією – у відповідному розчині солі лужного металу.
При роботі з рН-метром не можна витирати скляну кульку, тому що при цьому руйнується гелева поверхня електрода.
Особливо великого значення набули йонселективні електроди у медицині та біології. За їх допомогою стало можливим спостерігати за зміною йонного складу біологічних рідин у динаміці, одержувати інформацію про зміну концентрації йонів Na+, Са2+, Сl‒ тощо як у внутрішньо-, так і в позаклітинному просторі.






