¬ процессе работы гальванического элемента и при электрохимической коррозии металлов могут происходить изменени€ величин электродных потенциалов. Ќапример, в элементе ¬ольта медный электрод насыщаетс€ водородом и образует Ђводородный электродї, потенциал которого ниже ( =0,00 ¬), чем потенциал меди (
=0,00 ¬), чем потенциал меди ( =+0,34 ¬). роме того, водород, скопившийс€ на поверхности медного электрода, затрудн€ет дальнейшее протекание катодного процесса (2Ќ+ + 2
=+0,34 ¬). роме того, водород, скопившийс€ на поверхности медного электрода, затрудн€ет дальнейшее протекание катодного процесса (2Ќ+ + 2 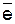
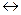 2Ќ2
2Ќ2 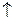 ). ¬ результате этого при работе такого гальванического элемента разность потенциалов уменьшаетс€ по сравнению с первоначальной. јналогичный процесс может происходить и при электрохимической коррозии металлов.
). ¬ результате этого при работе такого гальванического элемента разность потенциалов уменьшаетс€ по сравнению с первоначальной. јналогичный процесс может происходить и при электрохимической коррозии металлов.
явление уменьшени€ разности потенциалов между электродами гальванического или микрогальванического элемента при его работе называетс€ пол€ризацией. ≈сли это уменьшение происходит за счет затруднений в протекании катодной реакции (потенциал катода уменьшаетс€), то пол€ризаци€ называетс€ катодной. “акой вид пол€ризации наблюдаетс€ в элементе ¬ольта.
≈сли в пол€ризации повинен анодный процесс (потенциал анода увеличиваетс€, т.е. анод становитс€ менее активным, например, за счет образовани€ на нем оксидных и других защитных пленок), то говор€ об анодной пол€ризации.
“акой вид пол€ризации часто наблюдаетс€ при коррозии металлов. Ќапример, на многих металлах под действием окружающей среды образуютс€ оксидные и др. пленки, которые в дальнейшем преп€тствуют окислению металла.
ѕол€ризаци€ Ц вредное €вление дл€ гальванических элементов. ѕоэтому ее стараютс€ устранить или уменьшить. ѕроцесс уменьшени€ пол€ризации называют депол€ризацией, а вещества, которые уменьшают пол€ризацию Ц депол€ризаторами. Ќапример, дл€ устранени€ катодной пол€ризации примен€ютс€ сильные окислители, потенциал которых значительно выше, чем у водорода, такие как MnO2, KMnO4, K2Cr2O7 и др.
ƒл€ металлов €вление пол€ризации полезно, так как уменьшает разность потенциалов между катодными и анодными участками, что приводит к уменьшению потерь металла. ћногие способы защиты металлов от коррозии основаны на том, чтобы увеличить анодную или катодную пол€ризацию путем создани€ защитных пленок на поверхност€х металлов.
10.4.«ащита металлов от коррозии
ƒл€ защиты металлов от коррозии примен€ютс€ различные способы, которые условно можно разделить на три основные группы.
ћеханические способы. Ёти способы заключаютс€ в механическом нанесении на поверхность металла защитного сло€ (окраска, покрытие эмалью, лаком, нанесение полимерного покрыти€ и т.д.). ѕри этом сам металл никаких химических изменений не претерпевает.
Ќанесение защитных покрытий Ц самый распространенный метод борьбы с коррозией. «ащитные покрыти€ не только защищают издели€ от коррозии, но и придают поверхност€м р€д ценных физико-химических свойств (износостойкость, электрическую проводимость и др.). ќбщими требовани€ми дл€ всех видов защитных покрытий €вл€ютс€ высока€ адгезионна€ способность, целостность сло€ покрыти€ и стойкость в агрессивной среде.
’имические способы очень разнообразны. ним относитс€, например, обработка поверхности металла веществами, вступающими с ним в химическую реакцию и образующими на его поверхности пленку устойчивого химического соединени€, в формировании которой принимает участие сам защищаемый металл. числу таких способов относитс€ оксидирование, фосфатирование, сульфидирование и др.
|
|
|
—ущность различных методов оксидировани€ заключаетс€ в создании на поверхности металла пленки оксидов, котора€ обладает значительно большей коррозионной стойкостью, чем металл.
ƒл€ железа и его сплавов наиболее часто используетс€ щелочное оксидирование в растворе, содержащем NaOH, NaNO3, NaNO2 при температуре 135Е140o—. ќксидирование черных металлов называетс€ воронением.
Ќа анодных участках происходит процесс окислени€:
Fe 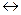 Fe2+ + 2
Fe2+ + 2 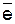 .
.
Ќа катодных участках происходит процесс восстановлени€:
2Ќ2ќ + ќ2 + 4 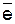
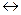 4ќЌ-.
4ќЌ-.
Ќа поверхности металла в результате работы микрогальванических элементов образуетс€ Fe(OH)2, который затем окисл€етс€ в Fe3O4. ќксидна€ пленка на малоуглеродистой стали имеет глубокий черный цвет, а на высокоуглеродистой стали Ц черный с сероватым оттенком.
Fe2+ + 2OH-  Fe(OH)2;
Fe(OH)2;
12Fe(OH)2 + NaNO3  4Fe3O4 + NaOH + 10H2O + NH3.
4Fe3O4 + NaOH + 10H2O + NH3.
ѕротивокоррозионные свойства поверхностной пленки оксидов невысоки, поэтому область применени€ этого метода ограничена. ќсновное назначение Ц декоративна€ отделка. ¬оронение используетс€ в том случае, когда необходимо сохранить исходные размеры, так как оксидна€ пленка составл€ет всего 1,0 Е1,5 микрона.
‘осфатирование Ц метод получени€ фосфатных пленок на издели€х из цветных и черных металлов. ƒл€ фосфатировани€ металлическое изделие погружают в растворы фосфорной кислоты и ее кислых солей (H3PO4+Mn(H2PO4)2) при температуре 96Е98 о—.
Ќа поверхности металла в результате работы микрогальванических элементов образуетс€ фосфатна€ пленка, котора€ имеют сложный химический состав и содержит малорастворимые гидраты двух − и трехзамещенных фосфатов марганца и железа: MnHPO4, Mn3(PO4)2, FeHPO4,Fe3(PO4)2 × n H2O.
Ќа анодных участках происходит процесс окислени€:
Fe 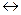 Fe2++ 2
Fe2++ 2 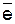 .
.
Ќа катодных участках происходит процесс восстановлени€ водорода:
2Ќ+ + 2 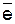
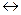 Ќ2
Ќ2 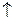 (рЌ<7).
(рЌ<7).
ѕри взаимодействии ионов Fe2+ с анионами ортофосфорной кислоты и ее кислых солей образуютс€ фосфатные пленки:
Fe2+ + H2PO-4  FeHPO4 + H+,
FeHPO4 + H+,
3Fe2+ + 2PO43-  Fe3(PO4)2.
Fe3(PO4)2.
ќбразующа€с€ фосфатна€ пленка химически св€зана с металлом и состоит из сросшихс€ между собой кристаллов, разделенных порами ультрамикроскопических размеров. ‘осфатные пленки обладают хорошей адгезией, имеют развитую шероховатую поверхность. ќни €вл€ютс€ хорошим грунтом дл€ нанесени€ лакокрасочных покрытий и пропитывающих смазок. ‘осфатные покрыти€ примен€ютс€ в основном дл€ защиты металлов от коррозии в закрытых помещени€х, а также как метод подготовки поверхности к последующей окраске или покрытию лаком. Ќедостатком фосфатных пленок €вл€ютс€ низка€ прочность и эластичность, высока€ хрупкость.
јнодирование Ц это процесс образовани€ оксидных пленок на поверхности металла и прежде всего алюмини€. ¬ обычных услови€х на поверхности алюмини€ присутствует тонка€ оксидна€ пленка оксидов Al2O3 или Al2O3 ∙ n H2O, котора€ не может защитить его от коррозии. ѕод воздействием окружающей среды алюминий покрываетс€ слоем продуктов коррозии. ѕроцесс искусственного образовани€ оксидных пленок осуществл€етс€ химическими и электрохимическими способами. ѕри электрохимическом оксидировании алюмини€ алюминиевое изделие играет роль анода электролизера. Ёлектролитом служит раствор серной, ортофосфорной, хромовой, борной или щавелевой кислот, катодом может быть металл, не взаимодействующий с раствором электролита, например нержавеюща€ сталь. Ќа катоде выдел€етс€ водород, на аноде происходит образование оксида алюмини€.
|
|
|
—уммарный процесс на аноде можно представить следующим уравнением:
2Al + 3H2O 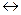 Al2O3 + 6H+ + 6
Al2O3 + 6H+ + 6 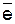 .
.
ћеханизм реакции имеет сложный характер. Ёлектродна€ реакци€ протекает в несколько стадий. Ќар€ду с образованием оксида происходит его частичное растворение в кислоте:
Al2O3 + 6H+ 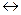 2Al3+ + 3H2O.
2Al3+ + 3H2O.
¬ результате пленка становитс€ пористой, через поры пленки проникают ионы и процесс роста пленки продолжаетс€. ѕолученна€ пленка Al2O3 весьма пориста, причем размеры пор очень малы. ¬следствие этого пленка может быть пропитана различными составами, повышающими коррозионную стойкость поверхности. ќксидна€ пленка на алюминии имеет высокую твердость, поэтому после анодировани€ и пропитки оксидного сло€ смазкой значительно повышаетс€ износостойкость деталей.
химической защите можно отнести также применение веществ, введение которых в коррозионно-агрессивную среду значительно снижает коррозию металлов. “акие вещества называют ингибиторами коррозии. ѕрименение ингибиторов основано на кинетических принципах (уменьшаетс€ скорость коррозии металла).
ѕо механизму своего действи€ на процесс электрохимической коррозии различают адсорбционные и пассивационные ингибиторы.
ћеханизм действи€ значительного числа ингибиторов заключаетс€ в адсорбции ингибитора на поверхности металла и последующем торможении катодных и анодных процессов.
јдсорбционные ингибиторы уменьшают скорость коррозии за счет снижени€ интенсивности процесса или сокращени€ площади участков, лимитирующих процесс. таким ингибиторам относ€тс€ органические вещества, содержащие в своем составе серу, азот, фосфор (диэтиламин, формальдегид, пиридин). »х широко используют при травлении металлов кислотами, а также дл€ защиты от атмосферной коррозии.
ƒл€ защиты металлических изделий в воздушной атмосфере, при перевозке, хранении используют летучие (атмосферные) ингибиторы, имеющие достаточно высокое давление паров. »ми пропитывают упаковочные материалы. ¬следствие достаточно высокого давлени€ паров летучие ингибиторы достигают границы раздела металл/воздух и раствор€ютс€ в пленке влаги, покрывающей металл. ƒалее они адсорбируютс€ на поверхности металла и образуют на нем защитную пленку. ¬ качестве летучих ингибиторов используютс€ обычно амины с небольшой молекул€рной массой.
ѕассивационные ингибиторы способствуют образованию на поверхности металла защитных пленок, в их присутствии поверхность металла становитс€ пассивной и не подвергаетс€ воздействию окружающей среды. ќни примен€ютс€, как правило, в нейтральных и щелочных средах, когда протекает коррози€ с восстановлением кислорода. ним относ€тс€ в основном неорганические вещества: хроматы, нитриты, а также некоторые органические вещества, например, соли бензойной и других органических кислот.
Ёлектрохимические способы основаны на торможении анодных или катодных процессов. ћетод эффективен в коррозионных средах с хорошей ионной электрической проводимостью.—ущность метода состоит в уменьшении скорости электрохимической коррозии металла при пол€ризации электрода от источника посто€нного тока или при контакте с добавочным электродом, €вл€ющимс€ анодом по отношению к защищаемой конструкции металла. ¬ зависимости от вида пол€ризации различают катодную и анодную защиты.
атодна€ защита внешним током. ¬ этом случае защищаемый металл присоедин€етс€ к отрицательному полюсу источника посто€нного тока и становитс€ катодом, дополнительный электрод Ц к положительному. »сточник посто€нного тока перекачивает электроны от дополнительного электрода на защищаемый металл, который все врем€ поддерживаетс€ в восстановленном состо€нии. ¬ качестве дополнительного электрода чаще всего используетс€ металлический лом. ¬спомогательный электрод (анод) раствор€етс€:
|
|
|
(−) ј: Me 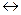 Men+ + n
Men+ + n 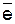 ,
,
где ће Ц дополнительный электрод.
Ќа защищаемом металле (катоде) в зависимости от характера среды выдел€етс€ водород или разр€жаетс€ кислород.
атодна€ защита внешним током примен€етс€ главным образом дл€ защиты металлических конструкций (трубопроводов, газопроводов, кабельных установок) от коррозии в услови€х несильно агрессивных сред.
ћетод протектора. ≈го преимущество состоит в том, что нет необходимости во внешнем источнике посто€нного тока, специальное сооружение которого бывает иногда экономически нецелесообразно.
ѕри протекторной защите к изделию подсоедин€ют металл или сплав-протектор, потенциал которого значительно отрицательнее потенциала металла издели€. ¬ образующемс€ гальваническом элементе протектор служит отрицательным электродом (анодом) и постепенно разрушаетс€, а на защищаемый металл поступают электроны с протектора; таким образом, он €вл€етс€ положительным электродом (катодом) и тем самым защищен от коррозии.
¬ качестве материалов протекторов чаще всего используют магний и его сплавы, реже алюминий и цинк. Ёто обусловлено тем, что Alи Zn в воде и грунтах склонны к пассивации Ц образованию на поверхности металла плотных оксидных пленок, нарушающих токоотдачу. ƒл€ предотвращени€ пассивации в засыпку ввод€т хлориды или другие вещества, раствор€ющие их, а также компоненты, увеличивающие сопротивление грунта, что способствует уменьшению скорости растворени€ протектора. Ёффективность этого вида защиты определ€етс€ радиусом действи€ протектора, т.е. максимально возможным его удалением от защищаемого издели€. „ем выше электрическа€ проводимость среды, тем выше радиус защитного действи€ протектора. ѕротекторную защиту используют дл€ борьбы с коррозией трубопроводов и металлоконструкций в воде, грунте и других нейтральных средах. ¬ысока€ скорость саморастворени€ протектора в кислотных средах ограничивает его применение в них.
(−) ј: Me 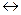 Men+ + n
Men+ + n 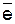 , где ће (Mg, Al, Zn),
, где ће (Mg, Al, Zn),
(+) : 2H2O + 2 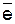
 H2
H2  + 2OH-.
+ 2OH-.
јнодна€ защита. ¬ основе данного способа лежит анодна€ пол€ризаци€: потенциал металла смещают в положительную сторону путем присоединени€ защищаемой конструкции к положительному полюсу внешнего источника посто€нного тока, а вспомогательного электрода (катода) Ц к отрицательному.
јнодна€ защита примен€етс€ только дл€ тех металлов и сплавов, которые легко переход€т в пассивное состо€ние при анодной пол€ризации, т.е. покрываютс€ пассивной пленкой оксида (большинство переходных металлов и сплавов на их основе, включа€ нержавеющие и углеродистые стали), например:
2Cr + 3H2O  Cr2O3 + 6H+ + 6
Cr2O3 + 6H+ + 6  .
.
Ўироко распространенные способы металлических покрытий занимают особое положение, так как их действие имеет двойственный характер. ƒо тех пор, пока целостность сло€ покрыти€ не нарушена, его защитное действие сводитс€ к изол€ции поверхности защищаемого металла от окружающей среды. Ёто не отличаетс€ от действи€ любого механического защитного сло€ (окраска, оксидна€ пленка и т.д.). — другой стороны − при повреждении металлического покрыти€ про€вл€ютс€ его электрохимические свойства.
¬ качестве металлических защитных покрытий могут быть использованы как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.).
ѕо характеру поведени€ металлических покрытий при коррозии их можно разделить на катодные и анодные.
катодным покрыти€м относ€тс€ покрыти€, потенциалы которых в данной среде имеют наиболее положительное значение, чем потенциал основного металла. ¬ качестве примеров катодных покрытий на стали можно привести Cu, Ni, Ag.
|
|
|
ѕри повреждении покрыти€ (или наличии пор) образуетс€ коррозионный элемент, в котором основной металл служит анодом и раствор€етс€:
(−) ј: Me 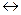 Men+ + n
Men+ + n 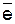 ;
;
а материал покрыти€ Ц катодом, на котором выдел€етс€ водород или поглощаетс€ кислород:
(+) : 2Ќ++ 2 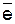
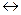 Ќ2
Ќ2 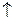 (рЌ<7),
(рЌ<7),
(+) : O2 + 2H2O + 4 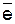
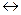 4OH- (pH
4OH- (pH 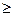 7).
7).
—ледовательно, катодные покрыти€ могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрыти€.
јнодные покрыти€ имеют наиболее отрицательный потенциал, чем потенциал основного металла. ѕримером анодного покрыти€ может служить цинк на поверхности железа. ¬ этом случае основной металл (Fe) будет катодом коррозионного элемента.
ћестное повреждение защитного цинкового сло€ ведет к дальнейшему его разрушению, при этом поверхность железа защищена от коррозии. Ќа анодных участках происходит процесс окислени€ цинка:
(−) ј: Zn 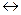 Zn2+ + 2
Zn2+ + 2 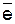 .
.
Ќа катодных участках Ц восстановление водорода или кислорода в зависимости от характера среды:
(+) : 2Ќ+ + 2 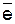
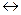 Ќ2
Ќ2  (Fe) (рЌ< 7),
(Fe) (рЌ< 7),
(+) : O2 + 2H2O + 4 
 4OH- (Fe) (pH
4OH- (Fe) (pH  7).
7).
Ёлектродные потенциалы металлов завис€т от состава растворов, поэтому при изменении состава раствора может мен€тьс€ и характер покрыти€. “ак, например покрытие железа оловом в растворе серной кислоты Ц катодное, а в растворе органических кислот Ц анодное.
Ёффективным методом повышени€ коррозионной стойкости металлов €вл€етс€ легирование. Ћегирование примен€етс€ тогда, когда материал конструкции не позвл€ет использовать другие способы защиты. ѕри легировании в состав сплава или металла ввод€т легирующие элементы (хром, никель, молибден и др.), вызывающие пассивность металла (процесс перехода металла или сплава в состо€ние его повышенной коррозионной устойчивости, вызванное торможением анодного процесса). Ћегирующие компоненты, облада€ высокой диффузионной способностью, вместе с основным металлом окисл€ютс€ кислородом воздуха, образу€ устойчивые оксидные пленки, преп€тствующие проникновению коррозионной среды.
Ўирокое применение нашло легирование дл€ защиты от газовой коррозии. Ћегированию подвергаютс€ железо, алюминий, медь, магний, цинк, а также сплавы на их основе.
Ћегирование также используетс€ с целью снижени€ скорости электрохимической коррозии, особенно коррозии с выделением водорода. сплавам с повышенной коррозионной устойчивостью, например, относ€тс€ нержавеющие стали, в которых легирующими компонентами служат хром, никель и другие металлы.






