



Суммарная реакция: 
В молекулярном виде: 
Электролиз водного раствора сульфата меди с медными электродами

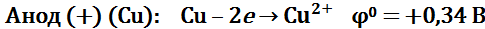
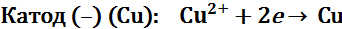
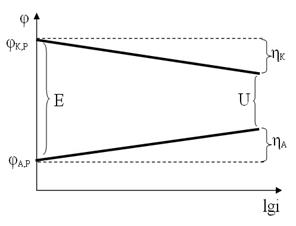
Поляризация электродов
Поляризация электродов – изменение потенциала электрода при прохождении через него тока, при этом потенциал анода становится более положительным, а потенциал катода – менее положительным

 – потенциала электрода
– потенциала электрода
 – равновесный потенциал (при отсутствии тока)
– равновесный потенциал (при отсутствии тока)
 – плотность тока
– плотность тока
Согласно уравнению Тафеля (a и b– константы, зависящие от материала электрода) зависимость потенциала от логарифма плотности тока является линейной

| 
|
| Изменение потенциалов катода и анода при изменении плотности тока в процессе электролиза | Изменение потенциалов катода и анода при изменении плотности тока в гальваническом элементе |
Различают три вида поляризации:
1. концентрационная поляризация обусловлена изменением концентрации ионов в приэлектродном пространстве в результате замедленности транспортных стадий;
2. х имическая поляризация связана с изменением химической природы электрода, например, образование оксидной пленки на аноде в результате выделения кислорода при разряде воды;
Электрохимическая поляризация обусловлена изменением потенциала в результате замедленности электрохимической стадии
Если известна природа замедленной стадии, т. е. ясна причина, обусловливающая появление поляризации, то вместо термина «поляризация» употребляют термин перенапряжение
Перенапряжение водорода растет в ряду Pt, Pd, W, Ni, Fe, Ag, Cu, Zn,
Законы Фарадея
Устанавливают зависимости между количеством электричества и количеством вещества, испытавшего химическое превращение на электроде
· Масса вещества, испытавшего электрохимическое превращение на электроде, пропорциональна количеству прошедшего через электролит электричества

Где m – масса вещества, Q – количество электричества (Кл), I – сила тока (А), t – время (с), Kэ– электрохимический эквивалент вещества
· При пропускании одинакового количества электричества через растворы или расплавы различных электролитов массы веществ, прореагировавших на электродах, пропорциональны молярным массам их эквивалентов

Обобщенное уравнение законов Фарадея:

Выход по току B – отношение массы реально выделенного вещества на электроде к теоретической:

Пример. Соединения кадмия (II) являются токсичными веществами. Ионы кадмия (II) (ПДК Cd2+ = 0,1 мг/м3) можно удалить из раствора по реакции восстановления, например, электрическим током:







