Электрохимические процессы
Электрохимические процессы – процессы взаимного превращения химической и электрохимической форм энергии.
Различают два типа электрохимических процессов:
· самопроизвольно протекающие процессы превращения химической энергии окислительно-восстановительной реакции в электрическую, осуществляемые в специальных устройствах – гальванических элементах;
· процессы превращения электрической энергии в химическую, которые требуют затраты энергии извне и не могут протекать самопроизвольно, осуществляются в электролизерах
Электрохимические процессы протекают на электродах
Электрод – электропроводящая фаза
Проводник первого рода –металл или полупроводник, обладающие электронным типом проводимости
Проводник второго рода – раствор или расплав электролита, обладающий ионным типом проводимости
Возникновение двойного электрического слоя на границе металл – электролит
При погружении металла в электролит (воду или водный раствор его соли) в результате межмолекулярного взаимодействия (ион‒дипольного или ион‒ионного) на поверхности металла устанавливается равновесие:
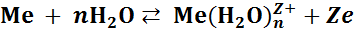
На границе раздела фаз: металл ‒ электролит образуются два противоположно заряженных слоя: один на самом металле, другой в электролите в непосредственной близости от поверхности металла. Их общее название – двойной электрический слой (ДЭС). В результате между металлом и раствором возникает разность потенциалов (или скачок потенциала) φ

При в пределах ДЭС на границе металл – электролит, устанавливается равновесие, характеризующееся равновесным электродным потенциалом φ.
Стандартный водородный электрод

 ,
,  101,3 кПа
101,3 кПа
 298 K
298 K

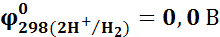
Стандартный электродный потенциал – потенциал электрода, погруженного в раствор, содержащий одноименный ион с относительной активностью, равной единице, и измеренный относительно стандартного водородного электрода
Для расплавов солей в качестве стандартного потенциала принимается потенциал натриевого электрода, погруженного в расплав соли натрия
Гальванический элемент. Электродвижущая сила элемента


Медно-цинковый гальванический элемент (элементДаниэля ‒ Якоби)
процесс окисления – на аноде:
Aнод (–) (Zn): 
процесс восстановления – на катоде:
Катод (+) (Cu): 
Токообразующая реакция, в результате которой возникает электрический ток:
ТОР: 
В общем виде:
 ,
,
где индексы Red и Ox относятся к восстановленной (Red) и окисленной (Ox) формам веществ А и В
Схема элемента Даниэля − Якоби с мембраной записывается в виде:
Анод (–)  (+) Катод;
(+) Катод;
с солевым мостиком (KCl,  ):
):
Анод (–) 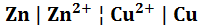 (+) Катод
(+) Катод
Схематически электроды записываются так: 
Концентрационный гальванический элемент:
(–)  (+)
(+)

Aнод (Cu) (–): 
Катод (Cu) (+): 
Окислительно-восстановительный электрод, или редокс-электрод–инертный проводник первого рода (платина или графит), погруженный в электролит, содержащий ионы какого-либо соединения в окисленной и восстановленной формах.
На инертным электроде (платина, графит) протекает электродная реакция:  ,
,
например, 
Электродвижущая сила элемента (ЭДС)






