
Уменьшение энергии Гиббса 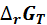 равно максимальной полезной работе
равно максимальной полезной работе  , которая определяется количеством электрической энергии
, которая определяется количеством электрической энергии  FE, получаемой в гальваническом элементе:
FE, получаемой в гальваническом элементе:
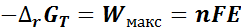
где n – количество электрических зарядов (электронов), равноценное количеству превращенного вещества, моль (нок в ОВР); F – постоянная Фарадея (количество электрической энергии, необходимой для превращения одного эквивалента вещества, F ≈ 96500Кл/моль); E – ЭДС элемента (  )
)
 ;
; 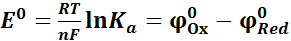
Уравнениями Нернста для электродного потенциала:
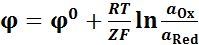

Или где – относительная активность иона
Уравнение Нернста для водородного электрода ( 

Где – относительное парциальное давление водорода
Приняв 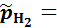 101,3 кПа и заменив активность ионов водорода величиной рН,
101,3 кПа и заменив активность ионов водорода величиной рН,  :
:

Уравнение Нернста для кислородного электрода:

Приняв  101,3 кПа:
101,3 кПа:

Пример. Рассчитайте электродные потенциалы и ЭДС медно-цинкового гальванического элемента, приняв активности ионов равными:
 .
.
Решение: В медно-цинковом гальваническом элементе на электродах протекают процессы:
Aнод (–) (Zn): 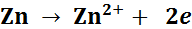
Катод (+) (Cu): 
Электродные потенциалы рассчитываем по уравнению Нернста:
 ;
;
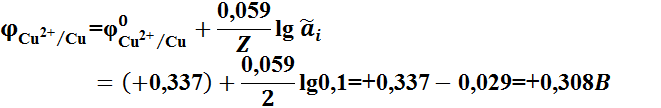
ЭДС равна:

Определение направления самопроизвольного протекания окислительно-восстановительной реакции
Можно установить на основании значений стандартных окислительно-восстановительных потенциалов различных редокс-пар
• редокс-пара с большим значением потенциала является окислителем по отношению к редокс-паре с меньшим значением потенциала;
• чем больше величина стандартного потенциала, тем сильнее выражена его окислительная способность и менее восстановительная способность;
• окислительно-восстановительная реакция будет протекать в прямом направлении только в том случае, если ЭДС 
(  ;
;
Количественной характеристикой направления протекания процесса являются стандартная энергия Гиббса и константа равновесия окислительно-восстановительной реакции
Пример. Определите направление, в котором может самопроизвольно протекать окислительно-восстановительная реакция:
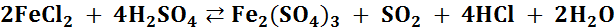
Вычислите изменение стандартной энергии Гиббса и стандартную константу равновесия для того направления реакции, в котором она протекает самопроизвольно.
(1) 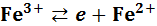 ;
;  ,
,
(2) 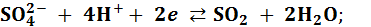

Решение: Окислитель находится в первой полуреакции, потенциал которой больше, это ион, принимающий электроны, т. е. первая полуреакция может протекать в прямом направлении, а вторая, в этом случае, – в обратном, восстановителем в ней будет SO2, отдающий электроны.
Запишем обе полуреакции в том направлении, в котором они могут протекать самопроизвольно:
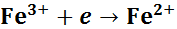 ;
;

В уравнении реакции, направление которой нужно определить,  и
и  находятся в правой части, т. е. реакция самопроизвольно может протекать только в обратном направлении:
находятся в правой части, т. е. реакция самопроизвольно может протекать только в обратном направлении:

Определим для самопроизвольно протекающей реакции, т.е. для обратного направления приведенной реакции, стандартную ЭДС:
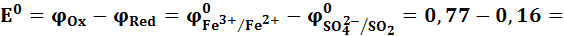 0,61 B
0,61 B
и с тандартную энергию Гиббса:

Из значения стандартной энергии Гиббса определяем стандартную к онстанту равновесия:



Рассчитанные величины  и
и  указывают на практически необратимое протекание реакции.
указывают на практически необратимое протекание реакции.
Электролиз. Применение электрохимических процессов






