- Рекомендовано проводить в первую очередь анальгезию, а затем седацию для пациентов в ОРИТ (+1А).
- Глубина и качество седации должны регулярно оцениваться у всех пациентов в ОРИТ (+1В).
- RASS и SAS – наиболее информативные и надежные шкалы для оценки качества и глубины седации у пациентов в ОРИТ (+1В).
- При наличии возможности в условиях центра анестезиологии и реанимации или специализированных учреждений предлагается использовать инструментальные методы оценки мозговых функций для мониторирования уровня седации у пациентов, получающих миорелаксанты (ЭЭГ, BIS, AEP, или вызванные слуховые потенциалы) (+2В).
- При наличии возможности в условиях центра анестезиологии и реанимации или специализированных учреждений показан ЭЭГ-контроль, или ЭЭГ- мониторирование неконвульсивной судорожной активности у пациентов в ОРИТ с риском развития судорог или для титрования дозы препаратов, подавляющих электрическую активность, назначаемых с целью предотвращения судорожных припадков у пациентов в ОРИТ с повышенным ВЧД (+1А).
- После стабилизации состояния пациента или купирования отека головного мозга достигать минимально возможного уровня седации и/или устраивать ежедневные перерывы в приеме седативных препаратов (+1В)
- У пациентов, внутричерепной гипертензией и в первые 7 – 8 суток постгипоксической энцефалопатии прерывать седацию не рекомендовано
- Использовать протоколы седации и карты наблюдения для улучшения проведения седации в ОРИТ (1 В)
- Рекомендовано ограничить использование бензодиазепинов (мидозалам или диазепам). В качестве альтернативных препаратов для пациентов на ИВЛ рекомендовано применять пропофол или дексмедетомидин (-2В)[6].
Задачи седативной терапии пациентов в ОРИТ,
- Уменьшение возбуждения.
- Снижение количества дней на ИВЛ.
- Уменьшение времени пребывания в ОРИТ.
- Уменьшение длительных когнитивных расстройств.
- Предупреждение осложнений со стороны сердечно-сосудистой системы, легких, печени и почек.
- Уменьшение частоты развития посттравматических стрессовых расстройств
- Уменьшение количества спонтанных экстубаций
- Уменьшение частоты встречаемости делирия и/или более успешное лечение делирия[11].
Основные правила седации:
- Седацию возбужденного пациента в критическом состоянии можно начинать только после обеспечения адекватной анальгезии на фоне лечения обратимых физиологических причин (гипоксемии, гипогликемии, гипотензии, алкогольной или наркотической абстиненции).
- Предупреждение боли эффективнее, чем лечение уже имеющейся боли.
- Важно также исключить наличие обструкции верхних дыхательных путей, а у пациентов на ИВЛ – однолегочной вентиляции.
- Необходимо соблюдать порядок седации в ОРИТ (рис. 1) с использованием протокола назначения седативных препаратов.
- Необходимо также использовать все доступные методы нефармакологической седации.
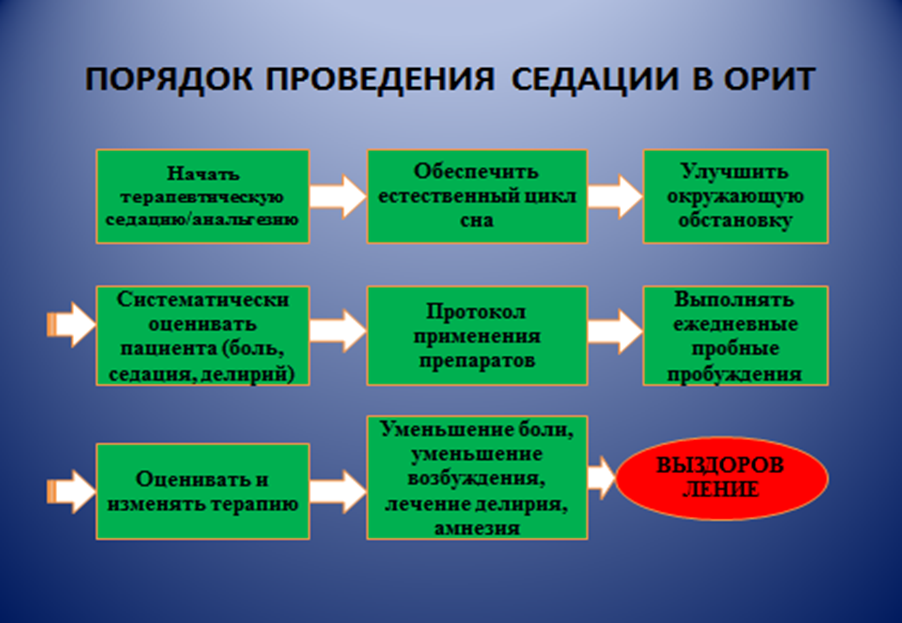
Рис.1. Порядок проведения седации в ОРИТ.
Нефармакологическая седация включает:
- Удаление ненужных инфузионных линий и трубок
- Прекращение или минимизация фиксации пациента
- Обеспечение нормального цикла сна (обеспечить естественный сон ночью, соблюдать режим сна, не будить ранее, чем через 90 минут, регулярные перерывы в уходе (60 – 90 минут), массаж спины 5 – 10 минут, создать спокойное окружение (в том числе, посредством привлечения близких и родственников пациента), темноту, не включать свет, использовать естественные маркеры для сна – окно или регулировка свет/темнота) [11].
Седативные препараты
Седативные препараты – это медикаментозные средства, которые успокаивают пациента, уменьшают возбуждение и обеспечивают сон. [12].
Отрицательные побочные эффекты седативных препаратов в ОРИТ:
- развитие толерантности к препаратам
-избыточный седативный эффект
-нарушение перистальтики желудочно-кишечного тракта
- появление симптомов отмены
- когнитивный дефицит.
Таблица 4
Клиническая фармакология седативных средств [6].
| Препарат | Время наступления действия | Время полувыведения | Активные метаболиты | Нагрузочная доза в/в | Поддерживающая доза, в/в | Побочные явления |
| Дексмедетомидин | 5-10 мин. | 1,8-3,1 ч | Нет | 1 мкг/кг в течение 10 мин. Не назначают при нестабильной гемодинамике | 0,2-0,7 мкг/кг в час, при нормальной переносимости можно повысить до 1,5 мкг/кг/час | Брадикардия, гипотензия; гипертензия при нагрузочной дозе; потеря рефлексов дыхательных путей |
| Пропофол | 1-2 мин. | Кратковременное применение 3-12 ч, длительное применение 50±18,6 ч | Нет | 5 мкг/кг/мин в течение 5 минут Вводят только пациентам, у которых маловероятная гипертензия | 5-50 мкг/кг/мин. | Угнетение дыхания, Боль при инъекциив периферические вены, гипотензия, гипертриглицеридемия, панкреатит, аллергические реакции, инфузионный синдром, связанный с пропофолом; после глубокой седации пропофолом пробуждение гораздо более длительное, чем после легкой седации |
| Ингаляционные анестетики | Несколько минут | 4 – 7 ч | Гипотензия, дозозависимое угнетение дыхания, брадикардия, тахикардия | |||
| Изофлуран | трифторацетат | 3 мл/ч | 2 – 7 мл/ч | |||
| Севофлуран | гексафторизопропанол | – 5 мл/ч | 4 – 10 мл/ч | |||
| Мидазолам | 2-5 мин. | 3-11 ч | Есть Продлевают седацию, особенно у больных с почечной недостаточностью | 0,01-0,05 мг/кг в течение нескольких минут | 0,02-0,1 мг/кг в час | Угнетение дыхания, гипотензия |
Дексмедетомидин
Является селективным агонистом α2 адренорецепторов, но не обладает селективностью к А, В и С подтипам α2 адренорецепторов. Препарат обладает седативным, обезболивающим и симпатолитическим эффектами, но без противосудорожного действия, позволяет снизить потребность в опиоидах. Седация при назначении дексмедетомидина имеет определенные особенности. Пациенты, получающие инфузию дексмедетомидина, легко просыпаются и способны к взаимодействию с персоналом, а признаки угнетения дыхания выражены минимально.
α2-агонисты вызывают активацию α2А-адренорецепторов в голубом пятне (locus coereleus) и стволе мозга. Это, в свою очередь, приводит к ингибированию выброса норадреналина и гиперполяризации возбудимых нейронов, что вызывает седативный эффект [13]. Поэтому седация, вызванная применением дексмедетомидина, близка к естественному сну[14].
Дексмедетомидин легко проникает через гематоэнцефалический барьер и обладает анальгетическим эффектом, особенно в сочетании с низкими дозами опиоидов или местных анестетиков [14 - 17].
Таким образом, симпатолитический эффект дексмедетомидина связан с уменьшением высвобождения норадреналина из симпатических нервных окончаний [18], а седативный эффект опосредован снижением возбуждения в голубом пятне, основном центре норадренергической иннервации ЦНС [19].
Дексмедетомидин потенцирует анальгетический эффект опиатов[20].
У взрослых на ИВЛ с факторами риска развития делирия использование для седации дексмедетомидина снижает выраженность делирия в сравнении с бензодиазепинамиии пропофолом. В сравнении с пропофолом, дексмедетомидин уменьшает частоту когнитивных расстройств в 1,6 раза [13]. Кроме того, дексмедетомидин сокращает время пребывания на ИВЛ и продолжительность пребывания в ОРИТ пациентов с делирием по сравнению с пациентами, для лечения которых применялся галоперидол [21].
Внутривенное введение дексмедетомидина обеспечивает эффективную седацию у пациентов на ИВЛ в ОРИТ и седацию во время кратковременных инвазивных вмешательств [14]. Обычно инфузия дексмедетомидина переносится хорошо и приводит к уменьшению потребности во внутривенном введении пропофола и мидазолама и снижает необходимость назначения опиатов.
Дексмедетомидин не вызывает депрессии дыхания. Препарат может применяться для седации самостоятельно дышащих неинтубированных пациентов и пациентов, которым проводят неинвазивную масочную вентиляцию легких. После прекращения введения дексмедетомидин не оказывает каких-либо остаточных влияний на систему дыхания. При использовании дексмедетомидина могут возникать гипотензия и брадикардия, но они проходят обычно самостоятельно, без дополнительного лечения. При седации дексмедетомидином возникает также побочный эффект в виде расслабления мышц ротоглотки [9].
Согласно российской инструкции,дексмедетомидин («Дексдор») показан для седации у взрослых пациентов, находящихся в отделении интенсивной терапии, необходимая глубина которой не превышает пробуждение в ответ на голосовую стимуляцию (соответствует диапазону от 0 до -3 баллов по шкале ажитации - седации Ричмонда (RASS).
Препарат противопоказан при:
- гиперчувствительности к компонентам препарата;
- атриовентрикулярной блокаде II – III степени (при отсутствии искусственного водителя ритма);
- неконтролируемой артериальной гипотензии;
- острой цереброваскулярной патологии;
- у детей до 18 лет.
Пациенты на ИВЛ могут быть переведены на инфузию дексмедетомидина с начальной скоростью 0,7 мкг/кг/ч с последующей постепенной коррекцией дозы в пределах 0,2 – 1,4 мкг/кг/ч с целью достижения необходимой глубины седации. Седация наступает в течение 5-10 минут, пик наблюдается через 1 час после начала в/в инфузии дексмедетомидина, длительность действия препарата после окончания инфузии составляет 30 минут. После коррекции скорости введения препарата необходимая глубина седации может не достигаться в течение одного часа. При этом не рекомендуется превышать максимальную дозу 1,4 мкг/кг/ч.
Для ослабленных пациентов начальная скорость инфузии дексмедетомидина может быть снижена до минимальных значений. У пожилых пациентов не требуется коррекции дозы.
Если нужно ускорить начало действия препарата, например, при выраженном возбуждении, рекомендовано проводить нагрузочную инфузию в дозе 0,5–1,0 мкг/кг массы тела в течение 20 мин, то есть начальную инфузию 1,5–3 мкг/кг/ч в течение 20 мин. После нагрузочной инфузии скорость введения препарата снижается до 0,4 мкг/кг/ч, в дальнейшем скорость инфузии можно корригировать.
Пациенты, у которых адекватный седативный эффект не достигнут на максимальной дозе препарата, должны быть переведены на альтернативное седативное средство. Введение насыщающей дозы препарата не рекомендуется, так как при этом повышается частота побочных реакций. До наступления клинического эффекта дексмедетомидина допускается введение пропофола или мидазолама. Опыт применения дексмедетомидина в течение более 14 дней отсутствует, при применении препарата более 14 дней необходимо регулярно оценивать состояние пациента.
Дексмедетомидин имеет ряд преимуществ по сравнению с другими седативными средствами, так как обладает одновременно седативным и анальгетическим действием, практически не влияет на внешнее дыхание и не вызывает кумулятивного эффекта. Успешное применение дексмедетомидина в условиях ОРИТ в России [22, 23] позволяет рекомендовать препарат в качестве одного из основных седативных средств как для пациентов на пролонгированной ИВЛ, так и на самостоятельном дыхании.
К агонистам α2 -адренорецепторов относится также клонидин который обладает влиянием на α1-адренорецепторы, оказывает анальгетическое и седативное действие. Существует ряд исследований, описывающих успешное применение клонидина в ОРИТ, в том числе при длительной седации и при отлучении от вентилятора [24 - 26]. Однако в российской инструкции к препарату клонидин седация к применению отсутствует в показаниях, в связи с чем клонидин не был включен в данные клинические рекомендации.
Пропофол.
Коротко действующий гипнотик. Механизм действия достаточно сложен и обусловлен воздействием на различные рецепторы ЦНС, в том числе рецепторы ГАМК, глицина, никотиновой кислоты и М1-мускариновые рецепторы. Препарат обладает седативным, снотворным, амнестическим, противорвотным и противосудорожным действием, но лишен обезболивающего эффекта [27]. Пропофол хорошо растворяется в липидах и проникает через гематоэнцефалический барьер, благодаря чему седативный эффект наступает быстро. При этом печеночный и внепеченочный клиренс пропофола высок, что обусловливает быстрое прекращение действия препарата. В связи с этим применение пропофола может быть рекомендовано для пациентов, которым требуется частое пробуждение для неврологической оценки или при дневном прерывании седации [28]. При длительном применении пропофола может произойти насыщение периферических тканей, что приведет к более длительному действию и более медленному выходу из седации [29]. Так же, как и бензодиазепины, пропофол вызывает угнетение дыхания и гипотензию, особенно у пациентов с уже имеющейся дыхательной недостаточностью или гемодинамической нестабильностью. Эти эффекты потенцируются одновременным назначением других седативных средств или опиоидов.
Доза введения пропофола в ОРИТ составляет 0,3 – 4,0 мг/кг/ч и не должна превышать 4 мг/кг/ч. Для пожилых пациентов скорость инфузии препарата должна быть снижена. Через 3 дня введения пропофола необходимо проверить уровень липидов крови. Длительность седации пропофолом не должна превышать 7 дней.
К побочным эффектам пропофола относятся гипертриглицеридемия, острый панкреатит и миоклонус [30 - 34]. Пропофол может также вызывать аллергические реакции у пациентов с аллергией на яичный лецитин и соевое масло (так как растворен в 10% эмульсии липидов, содержащей эти вещества). В редких случаях введение пропофола связано с развитием инфузионного синдрома.Симптомы пропофолового инфузионного синдрома варьируют, однако могут включать усиление метаболического ацидоза, гипертриглицеридемию, гипотензию с повышением потребности в сосудосуживающих препаратах и аритмии. Также описаны отдельные случаи повреждения почек, гиперкалиемии, рабдомиолиза и печеночной недостаточности при инфузионном синдроме [29, 30, 35, 36]. К возможным механизмам пропофолового инфузионного синдрома относятся дисфункция митохондрий, нарушение окисления жирных кислот, изменения метаболизма углеводов в жировые субстраты и накопление метаболита пропофола. Обычно инфузионный синдром развивается при длительном введении высоких доз пропофола (>70 г/кг в минуту), однако возможен и при инфузии низких доз [37, 38]. Частота инфузионного синдрома при инфузиях пропофола составляет примерно 1% [39].Смертность от инфузионного синдрома высокая (до 33%) и возможна даже после прекращения инфузии [32]. Разная картина, отсутствие специфичности диагноза и небольшая частота инфузионного синдрома осложняет выявление этого потенциально угрожающего жизни состояния. Раннее распознавание и отмена пропофола при подозрении на инфузионный синдром крайне важно. Лечение больных с инфузионным синдромом в основном симптоматическое.
Бензодиазепины
Механизм действия бензодиазепинов основан на взаимодействии с рецепторами гамма-аминомасляной кислоты (ГАМК) в головном мозге. Препараты обладают седативным, амнестическим, снотворным и противосудорожным эффектами, но не имеют обезболивающего действия. При этом мидазолам обладает более выраженным эффектом, чем диазепам. Отмечается повышенная чувствительность к бензодиазепинам у пожилых[40]. Бензодиазепины могут вызывать угнетение дыхания, а также вызывать артериальную гипотензию, особенно в сочетании с опиоидами [41]. При длительном применении развивается толерантность к препаратам данной фармакологической группы.
Все бензодиазепины метаболизируются в печени, поэтому их выведение замедлено у пациентов с печеночной недостаточностью, пожилых, а также при одновременном применении с препаратами, ингибирующими ферментную систему цитохромаP450 и конъюгацию глюкуронида в печени [42 – 44]. При почечной недостаточности могут накапливаться активные метаболиты мидазолама и диазепама[45].
При длительном применении бензодиазепинов возможно длительное восстановление сознания после окончания введения за счет насыщения периферических тканей, особенно при печеночной, почечной недостаточности и в пожилом возрасте. Особенно большой длительностью действия обладает диазепам [46]. При применении бензодиазепинов возможна повышенная частота развития делирия.
В настоящее время наиболее часто применяется мидазолам. Начальная доза препарата 2-2,5 мг, последующие дозы – 1 мг, общая доза – 3,5 – 7,5 мг. Для пожилых пациентов начальная доза должна быть снижена до 0,5-1 мг, последующие дозы: 0,5-1 мг, общая доза: <3,5мг, так как период полувыведения увеличивается в 2 раза.
Ингаляционные анестетики
В настоящее время в анестезиологии все большую популярность завоевывают ингаляционные анестетики (ИА). Важными преимуществами ИА являются возможность эффективного мониторинга их концентрации в конце выдоха и, как следствие, хорошая управляемость анестезией. Начало и конец действия ИА наступают очень быстро, так как они выводятся через легкие и мало кумулируются печенью и почками. Современные ИА (севофлуран, десфлуран в концентрации менее 1 MAC) не оказывают отрицательного влияния на центральную гемодинамику, что имеет особое значение для больных ОРИТ, находящихся в критическом состоянии. Кроме того, в ряде работ описан кардиопротекторный эффект севофлурана [47].
В ОРИТ используется устройство для ингаляционной седации «The Anaesthetic Conserving Device» (ACD) [48], в России зарегистрировано в 2013 г. ACD включает в себя модифицированный бактериальный фильтр с отражателем анестетика и пористый испаритель. Концентрация ИА в конце выдоха контролируется с помощью газового анализатора. В качестве ИА рекомендовано использование изофлурана или севофлурана.
В настоящее время эффективность и безопасность ACD подтверждена рядом исследований, в том числе рандомизированных [49 - 52]. Использование ингаляционных анестетиков в ОРИТ вошло в рекомендации по проведению седации в Германии [53].
ACD используется вместе с обычными аппаратами искусственной вентиляции лёгких и подключается между Y-образным коннектором и интубационной трубкой, так же, как бактериальный/вирусный фильтр. Помимо этого, данная система требует использования шприцевой помпы, монитора наркозного газа и системы выведения наркозного газа (возможно использование систем с адсорберами, например, «Контрфлурана»).
Применение севофлурана для продленной седации пациентов на ИВЛ позволяет снизить дозы опиатов и полностью отменить седативные препараты, вводимые внутривенно (IIC). У ряда пациентов с нестабильной гемодинамикой, выраженной гиповолемией возможно развитие артериальной гипотензии.
Рекомендуемая концентрация севофлурана на выдохе колеблется от 0,5% (при этом скорость инфузии севофлурана через шприцевую помпу составляет от 1,5 до 2,5 мл/ч) до 1% (скорость инфузии составляет 5 – 6 мл/ч). Для достижения уровня седации -2 – 3 балла по шкале RASS применяется скорость введения севофлурана 2,5 – 5,0 мл/ч, при этом концентрация анестетика в конце выдоха составляет около 0,75%. Скорость введения изофлурана несколько меньше и не превышает 3 мл/ч.
ACD – это одноразовое устройство. Производитель рекомендует менять ACD после 24-х часов использования. Возможно использование седации с помощью ACD как в течение нескольких часов в послеоперационном периоде до экстубации пациента, так и для длительной седации [53, 54].
Седативный эффект оценивается индивидуально у каждого пациента. Как только достигается намеченный уровень седативного эффекта (по шкале седации) необходимо выполнить другую настройку в течение первого часа после использования, применив для этого болюс (0.5 мл) или изменив скорость шприцевой помпы в соответствии с избыточным или недостаточным седативным эффектом. Обычно скорость введения анестетика постепенно снижается в течение нескольких часов до половины от исходных значений.
Седация ингаляционными анестетиками противопоказана в тех случаях, когда имеются противопоказания к соответствующему препарату для ингаляционного наркоза [55].
Противопоказания к седации галогенсодержащими ингаляционными анестетиками:
Подтвержденная или подозреваемая генетическая предрасположенность к развитию злокачественной гипертермии; повышенная чувствительность к севофлурану или другим галогенизированным препаратам.
Ограничения к применению:
С осторожностью применяют при нарушении функции почек, при нейрохирургических вмешательствах, если у больного имеется угроза повышения внутричерепного давления. Повышение концентрации ИА вызывает дозозависимое снижение АД; в таких случаях его можно повысить путем уменьшения концентрации подаваемого анестетика.
В качестве перспективного средства аналгоседации может обсуждаться инертный газ ксенон. В ряде научных работдоказано, что ксенон обладает аналгетическим, гипнотическим, нейро-, кардио- и ренопротективными эффектами, а также антигипоксическим, антиоксидантным и антистрессовым действием [56 - 58]. В настоящее время существуют единичные пилотные исследования, посвященные применению ксенона для седации в интенсивной терапии [59, 60]. В исследованиях использовались лечебные ингаляции ксенон-кислородных смесей по закрытому контуру с содержанием ксенона от 20 до 50% с сохранением спонтанного дыхания через маску, получен хороший обезболивающий и седативный эффект. Очевидно, необходимо проведение более крупных рандомизированных исследований для дальнейшего изучения возможностей применения ксенона для седации в ОРИТ.
Алгоритмы седации. 
Примечание: данный алгоритм предложен с учетом концепции аналгоседации [47, 61].
Тактика седативной терапии:
Доза выбранного препарата титруется до достижения желаемого уровня седации.
1. Пропофол – при проведении постоянной инфузии доза постепенно снижается на 5 – 10 мкг/кг/мин каждые 10 минут до достижения целевой седации (учет данных оценочных шкал).
2. Бензодиазепины (мидазолам) – после достижения более глубокого уровня седации скорость введения снижается в 2 раза, а затем титруется.
3. Дексмедетомидин – нагрузочная доза не используется. В большинстве наблюдений для достижения эффекта достаточны дозировки 0,5-1,0 мкг/кг/час, а для поддержания – 0,2-0,7 мкг/кг/час [19].
4. Для седации пациентов, находящихся на ИВЛ, могут быть использованы ингаляционные анестетики (изофлуран, севофлуран). Введение начинается со скоростью 5 мл/ч для севофлурана и 3 мл/ч для изофлурана, в течение первого часа седации скорость введения корректируется (уменьшается, увеличивается или вводится болюс 0,5 мл) для достижения необходимого уровня седации по оценочным шкалам.
Такм образом, необходимо титровать дозы седативных препаратов, периодически снижая скорость введения или ежедневно прерывать седацию с целью минимизации пролонгированных седативных эффектов за исключением случаев, когда требуется глубокая седация.
При необходимости проведения аналгоседации предпочтительно использовать препараты, обладающие комбинированным (обезболивающим и седативным) эффектами, например, дексмедетомидин или ИА.
Отмена инфузии бензодиазепинов должна быть обсуждена у пациентов, получающих высокие дозы препаратов или постоянную инфузию в течение 7 дней. Пропофол в этих случаях должен быть отменен. Дозы должны снижаться систематически на 10 – 30% в день для предупреждения симптомов отмены.
Лечение избыточной седации бензодиазепинами:
- для лечения используется флумазенил (анексат) (для пациентов, получавших бензодиазепины 7 дней и более используются более низкие дозы)
- флумазенил назначается в дозе 0,2 мг (2 мл) в/в. Через 30 с состояние оценивается снова, при необходимости можно ввести дополнительно 0,3 мг (3мл) и через 30 с оценить состояние снова.
- дополнительные дозы 0,5 мг (5 мл) могут быть назначены через 30 секунд с интервалами в 1 минуту, если это необходимо. Максимальная суммарная доза – 3 мг.






