ПОТЕНЦАЛІВ МЕТАЛІВ
Завдання 1. Платівки з нікелю занурені у водні розчини солей: MgSO4, NaCI, АІСІ3 і CuSO4.
З якими солями нікель буде реагувати?
Розв’язок
Умовою перебігу реакції між металом і сіллю є:
φокисника(ох) має бути більше за φвідновника (red).
Метал при взаємодії з сіллю буде відновником, а йон металу в солі – окисником.
В запропонованих солях тільки електродний потенціал міді відповідає вказаній умові (див.ряд стандартних електродних потенціалів), тому нікель буде реагувати з купрум(ІІ) сульфатом.



Складаємо електронні рівняння:
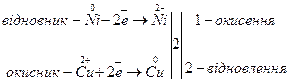

Реакція можлива.
ТЕМА 10. ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
Завдання 1. В якій схемі гальванічного елемента залізо слугує катодом?
- FeUFeSO4UCuSO4UCu;
- FeUFeSO4UZnSO4UZn;
- FeUH2SO4UCu.
Розв’язок
В гальванічному елементі більш активний метал, який має меншу алгебраїчну величину стандартного електродного потенціалу, слугує анодом (від’ємним електродом), а менш активний метал – катодом (додатнім електродом).
В запропонованих схемах гальванічних елементів тільки цинк має меншу величину стандартного потенціалу в порівнянні з залізом (див.ряд стандартних потенціалів).


Цій умові відповідає схема:
(-)ZnUZnSO4UFeSO4UFe (+)
При роботі цього гальванічного елемента відбуваютьсятакі півреакції:
A(-)Zn0 - 2b ºZn2+;
K(+)Fe2+ +2bºFe0.
Zn + Fe2+ = Zn2+ + Fe; Zn + FeSO4 = ZnSO4 + Fe
Більш активний метал витісняє менш активні з розчину солі.
Завдання 2. Визначити електрорушійну силу (е.р.с.) гальванічного елемента, представленого схемою:
(-)ZnUZnSO4UCuSO4UCu(+).
а) при стандартних умовах:
CM(Zn2+) = CM(Cu2+) = 1 моль/л;
б) якщо СM(Zn2+) = 0,01 моль/л, CM(Cu2+) = 0,1 моль/л.
Розв’язок
Якщо умови стандартні, то е.р.с. гальванічного елемента дорівнює різниці стандартних електродних потенціалів: від потенціалу окисника віднімають потенціал відновника.
В запропонованому гальванічному елементі Zn є відновником, а йон Cu2+ - окисником.
Отже, за стандартних умов е.р.с. =  =
=
= 0,34В - (-0,76В) = 1,1В.
За нестандартних умов необхідно спочатку за фомулою Нернста обчислити електродні потенціали металів для заданих концентрацій солей, а потім знайти їх різницю.
Формула Нернста має такий вигляд:
 .
.
Визначимо  і
і  :
:
 .
.
 .
.
е.р.с.=  .
.
ТЕМА 11. КОРОЗІЯ МЕТАЛІВ І ЗАХИСТ
ВІД КОРОЗІЇ
Завдання 1. Який метал буде кородувати в парі залізо – нікель в: а) кислому середовищі, б) в нейтральному середовищі.
Розв’язок
В кислому середовищі утвориться гальванічна пара, в якій залізо, к більш активний метал, буде анодом, а нікель – катодом.
Електролітом буде кислота, наприклад, H2SO4.
(-)FeUH2SO4UNi(+)
(-)Fe - 2b ºFe2+
(+)2H+ + 2b ºH2
Fe + 2H+ = Fe2+ + H2
Fe + H2SO4 = FeSO4 + H2.
Залізо витісняє водень з кислоти. Водень виділяється на нікелі.
В нейтральному середовищі окисником є кисень, розчинений у воді. Схема гальванопари буде мати вигляд:
(-)FeUH2O³ O2UNi(+)

Сумарне рівняння реакції: 2Fe + 2H2O + O2 = 2Fe(OH)2, але Fe(OH)2 окиснюється в Fe(OH)3 за реакцією:
4Fe(OH)2 + 2H2O = 4Fe(OH)3.
Fe(OH)3 частково втрачає воду і утворюється бура іржа:
Fe(OH)3 = FeOOH + H2O
2FeOOH = Fe2O3 . НО - іржа.
ТЕМА 12. ТВЕРДІСТЬ ВОДИ
Завдання 1. Обчислити, яку масу соди Na2CO3 необхідно додати до 1 м3, щоб усунути її твердість, що дорівнює 5 ммоль-екв/л?
Розв’язок
В 1 м3 води міститься 5 ммоль-екв . 1000 = 5000 ммоль-екв солей, що зумовлюють твердість.
З закону еквівалентів випливає, що соди треба додати до води таку ж кількість.
M(Na2CO3) = 2 . 23 + 12 + 16 . 3 = 106 (г/моль)
 (г/моль)
(г/моль)
1ммоль-екв Na2CO3 - 53 мг
5000 ммоль-екв Na2CO3 - X
 мг = 265 г.
мг = 265 г.
Для розв’язання задачі можна скористатись формулою:
 (ммоль-екв/л),
(ммоль-екв/л),
де: m – маса речовини, яку необхідно додати для усунення твердості; МЕ – молярна маса еквівалента цієї речовини, V – об’єм води.
З формули визначаємо масу речовини:
 .
.
 (г/моль).
(г/моль).
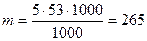 (г).
(г).
ЛІТЕРАТУРА
1. І.Є.Манековська. Хімія. Навчальний посібник. Рівне: НУВГП, 2010. – 250 с.
2. І.Є.Манековська, М.В.Яцков. Хімія, частина 1 (загально-теоретична). Навчальний посібник. Рівне: НУВГП, 2004.- 193 с.
3. І.Є.Манековська, М.В.Яцков. Хімія, частина ІІ (Хімія елементів). Навчальний посібник. Рівне: НУВГП, 2004.- 193 с.
4. Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф. Краткий справочник по химии. – К.: Наукова думка, 1987. – 829 с.
5. Корнілов М.Ю. Термінологічний посібник з хімії. – К.: ІЗМН, 1996. – 256 с.






