ПОТЕНЦАЛІВ МЕТАЛІВ
На основі значень стандартних електродних потенціалів металів визначити, які реакції можна здійснити. Написати для можливих реакцій молекулярні та йонно-молекулярні рівняння реакцій. Вказати окисник та відновник.
Варіанти завдань
1. Al + H2O; Al + H2SO4; Al + Cu2+.
2. Ca + H2O; Ca + HCl; Ca + Mg2+.
3. Cu + H2O; Cu + H2SO4; Cu2+ + Zn.
4. Na + H2O; Zn + H2SO4; ZnSO4 + Cu.
5. Ba + H2O; Ag0 + H+; Al + AgNO3.
6. Ni + H2O; Ni + HCl; Ni + CuCl2.
7. Pb + H2O; Pb(NO3)2 + Fe; Fe + H2SO4.
8. K + H2O; Sn(NO3)2 + Zn; Zn + HCl.
9. Zn + H2O; Zn + H+; FeSO4 + Zn.
10. Fe + H2O; Fe + HCl; Fe + CuCl2.
ТЕМА 10. ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
Варіанти завдань
1. Значення стандартних електродних потенціалів систем Zn2+/Zn і Cd2+/Cd відповідно дорівнюють -0,76В та -0,40В. Яка реакція відбувається самовільно в кадмієво-цинковому гальванічному елементі? Який електрод є анодом, який – катодом?
2. В гальванічному елементі самовільно відбувається реакція Fe + Cd2+ → Cd + Fe2+. Скласти схему гальванічного елемента. Який з електродів – залізний чи кадмієвий – слугує анодом? Які процеси відбуваються на аноді і катоді?
3. Гальванічний елемент складається з алюмінієвої та хромової платівок, занурених в розчини сульфатів. Скласти схему гальванічного елемента і вказати, які процеси відбуваються на катоді та аноді і яка реакція лежить в основі роботи цього гальванічного елемента.
4. Який електрод буде катодом в гальванічному елементі, що складається з алюмінієвої і цинкової платівок, занурених в розчини їхніх солей? Скласти схему гальванічного елемента. Які процеси відбуваються на аноді та на катоді, яка реакція лежить в основі роботи цього гальванічного елемента?
5. Визначити е.р.с. (Е) гальванічного елемента, що складається з залізної платівки, зануреної в 0,1М розчин FeSO4 і цинкової платівки, зануреної в 0,01М розчин ZnSO4.
6. В гальванічному елементі самовільно відбувається реакція Cd + Sn2+ → Cd2+ + Sn. Скласти схему гальванічного елемента, вказати який з електродів – кадмієвий чи олов’яний - слугує катодом. Які процеси відбуваються на аноді і катоді?
7. Визначити е.р.с. (Е) гальванічного елемента, що складається з кадмієвої і мідної платівок, занурених в 0,1М розчини їхніх солей.
8. В гальванічному елементі самовільно відбувається реакція Al+ Fe2+ → Al3+ + Fe. Скласти схему гальванічного елемента. Який з електродів – алюмінієвий чи залізний – слугує катодом? Які процеси відбуваються на аноді і катоді?
9. Визначити е.р.с. (Е) гальванічноо елемента, що складається з нікелевої платівки, зануреної в 0,1М розчин NiSO4 і мідної платівки, зануреної в 0,01М розчин CuSO4.
10. Які електродні процеси відбуваються в гальванічному елементі, утвореному нікелевою і мідною платівками, зануреними в розчини їхніх солей? Скласти схему гальванічного елемента. Вказати, який метал буде анодом, який – катодом.
ТЕМА 11. КОРОЗІЯ МЕТАЛІВ І ЗАХИСТ ВІД КОРОЗІЇ
Варіанти завдань
1. Яке залізо кородує швидше – в контакті з оловом чи міддю? Пояснити.
2. Як відбувається корозія у випадку пошкодження поверхневого шару оцинкованого заліза при контакті: а) з водою; б) з кислотою?
3. Як відбувається корозія у випадку пошкодження поверхневого шару нікельованого заліза при контакті з кислотою?
4. Як відбувається корозія у випадку пошкодження поверхневого шару лудженого заліза при контакті: а) з водою; б) з кислотою?
5. Чому для протекторного захисту залізних і стальних конструкцій застосовують пластину з кадмію або цинку? Які відбуваються процеси при атмосферній корозії та в кислому середовищі?
6. Чи однакове відношення до корозії технічного і хімічно чистого металу? Що спричиняє корозію сталі?
7. Які процеси відбуваються при атмосферній корозії хромованої залізної деталі? В чому полягає метод протекторів для захисту від корозії?
8. Які метали можна застосувати для протекторного захисту стальних конструкцій? Пояснити, виходячи з розміщення металів в ряді стандартних електродних потенціалів.
9. Яке покриття металів для захисту від корозії називають катодним, яке – анодним? Які метали можна застосовувати для катодного і анодного захисту заліза?
10. Для захисту від корозії залізна деталь покрита нікелем. Яке це покриття – катодне чи анодне? Що відбудеться при пошкодженні поверхневого шару в кислому середовищі?
ТЕМА 12. ТВЕРДІСТЬ ВОДИ
Варіанти завдань
1. Скільки г соди Na2CO3 необхідно додати до 1000 л води, щоб усунути постійну твердість, яка дорівнює 4,5 ммоль-екв/л?
2. Твердість води зумовлена наявністю тільки кальцій гудрогенкарбонату. Скільки г вапна Са(ОН)2 необхідно додати до 500 л води, щоб усунути карбонатну твердість, що дорівнює 3 ммоль-екв/л?
3. Визначити карбонатну твердість води, в 1 л якої міститься 0,146 г Mg(НСО3)2.
4. В 5 л води міститься 180 мг йонів Mg2+ та 100 мг йонів Са2+. Обчислити загальну твердість води.
5. Для усунення твердості до 1000 л води додали 212 г соди Na2СО3. Визначити твердість води.
6. Загальна твердість води дорівнює 6,5 ммоль-екв/л. Скільки грамів соди Na2СО3 необхідно додати до 1000 л води для усунення твердості? Які солі зумовлюють твердість води?
7. Скільки грамів гашеного вапна Са(ОН)2 необхідно додати до 200 л води для усунення твердості, яка дорівнює 2,5 ммоль-екв/л?
8. У воді міститься тільки кальцій гідрогенкарбонат. Який вид твердості він спричиняє? Скільки грамів гашеного вапна Са(ОН)2 необхідно додати до 500 л води, для усунення твердості, яка дорівнює 5 ммоль-екв/л?
9. У воді містяться хлориди, сульфати та гідрогенкарбонати кальцію та магнію. Які реагенти необхідно застосувати для усунення твердості? Написати рівняння відповідних реакцій.
10. В 100 л води міститься 14,6 г магній гідрогенкарбонату і 16,2 г кальцій гідрогенкарбонату. Визначити твердість води. Який це вид твердості?
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАВДАНЬ
ТЕМА 1. ОСНОВНІ ПОНЯТТЯ ТА ЗАКОНИ ХІМІЇ
Завдання 1. Знайти молярну масу бензену, якщо 600мл його пари при 87 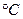 та тиску 83,2 кПа мають масу 1,3 г.
та тиску 83,2 кПа мають масу 1,3 г.
Розв’язок
За рівнянням Менделєєва-Клапейрона: 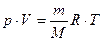 знаходимо
знаходимо
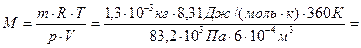
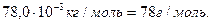
Завдання 2. Маса 260 мл газу за нормальних умов дорівнює 0,824 г. Знайти молярну масу газу та густину цього газу відносно повітря.
Розв’язок
За нормальних умов
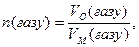
де: VМ - молярний об’єм газу.
Знаючи, що 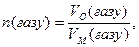 можна записати
можна записати
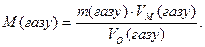
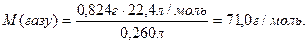
Густина газу відносно повітря
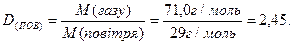
Завдання 3.
Визначити еквівалент та молярну масу еквівалента Zn(ОН)2 вреакції Zn(ОН)2 + 2НСІ = ZnCI2 + 2Н2.
Розв’язок
Для цієї реакції Z = 2, fЕКВ = ½.
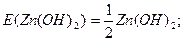
МЕ = fЕКВ . М, отже
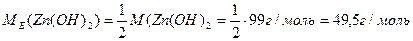 .
.
ТЕМА 2. БУДОВА АТОМА. ПЕРІОДИЧНИЙ ЗАКОН
І ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ З ПОГЛЯДУ
БУДОВИ АТОМА
Завдання 1. Орбітальне квантове число l = 2.Скільки значень магнітного квантового числа можливо для даного підрівня?
Розв’язок
Магнітне квантове число m приймає значення: -1; 0; +1.
Якщо l = 2, то m = -2, -1; 0; +1; +2.
Завдання 2. Скласти електронну формулу для елемента з порядковим номером 23. Скільки протонів і нейронів в його ядрі?
Розв’язок
Елемент з порядковим номером 23 - це Ванадій V.
Ванадій знаходиться в 4-му періоді, в побічній підгрупі V-ої групи. Його електронна формула 23V 1s22s22p63s23p6 3d34s2. Це d -елемент.
Число протонів 23, число нейронів N = A-Z = 51-23 = 28, де: А - округлена атомна маса, Z - порядковий номер елемента.
ТЕМА 3. ХІМІЧНА КІНЕТИКА І РІВНОВАГА
Завдання 1. Як зміниться швидкість прямої реакції N2 + 3H2 L 2NH3, якщо при незмінній температурі зменшити тиск у 2 рази?
Розв’язок
За законом діючих мас швидкість прямої реакції до зміни тиску можна записати:
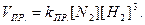
Після зменшення тиску у два рази концентрації реагуючих речовин зменшаться також у два рази, тому швидкість прямої реакції:
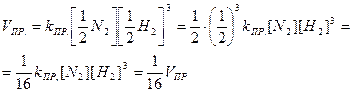
Отже, швидкість прямої реакції зменшиться у 16 разів.
Завдання 2. Як необхідно змінити температуру і тиск в рівноважній системі 4НСІ(г) + О2(г) L 2H2O(г) + 2СІ2(г); ∆Н < 0; щоб змістити рівновагу вліво?

Розв’язок
За принципом Ле Шательє, щоб змістити рівновагу вліво в даній системі, необхідно підвищити температуру (зворотна реакція є ендотермічною) та понизити тиск (зворотна реакція відбувається зі збільшенням кількості молекул газів, а саме: з 4-х молекул утворюється 5 молекул газів).






