СКЛАДУ РОЗЧИНІВ
Завдання 1. В 1 кг води розчинили 200 г натрій гідроксиду.
Обчислити моляльну концентрацію цього розчину, мольну і масову частку розчиненої речовини.
Розв’язок
Моляльна концентрація - це відношення кількості речовини до маси розчинника в кг.
 , де:
, де:  , тому
, тому  .
.
M(NaOH) = 23 + 16 + 1 = 40 (г/моль).
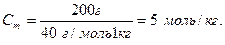
Мольна частка розчиненої речовини дорівнює відношенню кількості розчиненої речовини до суми кількості речовини всіх компонентів розчину.
 , де:
, де: 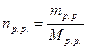 ,
,  .
.
M(NaOH) = 23 + 16 + 1 = 40 (г/моль)
М(Н2О) = 2 . 1+16 = 18 (г/моль)
Звідси 

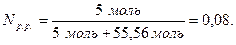
Масова частка розчиненої речовини – це відношення маси розчиненої речовини до маси розчину, виражене у відсотках.

mр-ну = mp.p. + mр-ка; mр-ка = р . V.
mр-ка = 1  . 1000
. 1000 
 = 1000
= 1000 
mр-ну = 40  +1000
+1000  = 1400
= 1400 
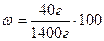 % = 2,86%
% = 2,86%
Завдання 2. Обчислити масу натрій карбонату Na2CO3, що міститься в 500 мл розчину, молярна концентрація еквівалента якого 0,3 моль/л.
Розв’язок
Молярна концентрація еквівалента – це відношення кількості речовини еквівалента до об’єму розчину.
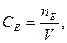 де:
де:  ;
; 
Еквівалентне число z для солі дорівнює добутку валентності елемента на число його атомів в солі.
Отже, 
Звідси МЕ (Na2CO3) = ½ . (23.2+12+16.3)=53 (г/моль).
З формули  визначимо масу розчиненої речовини:
визначимо масу розчиненої речовини:
m = CЕ .МЕ .V; m = 0,3 моль/л · 53 г/моль · 0,5 л = 7,95 г.
ТЕМА 5. РЕАКЦІЇ ОБМІНУ В РОЗЧИНАХ
ЕЛЕКТРОЛІТІВ
Завдання 1. Написати молекулярне, йонно-молекулярне і скорочене йонне рівняння реакції між натрій карбонатом і сульфатною кислотою.
Розв’язок
Запишемо молекулярне рівняння:
 H2O
H2O
 Na2CO3+ H2SO4 = Na2SO4+H2CO3
Na2CO3+ H2SO4 = Na2SO4+H2CO3
CO2
Na2CO3, H2SO4 і Na2SO4 - сильні електроліти, а H2CO3 - слабкий, електроліт, що розкладається на воду і вуглекислий газ.
Всі сильні електроліти запишемо в йонному виді, продукти розкладу слабкого електроліту – в молекулярній формі^
 H2O
H2O
 2 Na + +CO32- + 2H+ + SO 42- = 2Na+ + H2CO3
2 Na + +CO32- + 2H+ + SO 42- = 2Na+ + H2CO3
CO2↑ 
Виключимо подібні йони, що не беруть участі в реакції, і одержимо скорочене йонне рівняння:
 Н2О
Н2О
 2Н+ + СО32- = Н2СО3
2Н+ + СО32- = Н2СО3
СО2↑
Реагують сильні електроліти, а в результаті реакції утворюється слабкий електроліт.
Отже, ця реакція йде до кінця.
ТЕМА 6. ДИСОЦІАЦІЯ ВОДИ. ВОДНЕВИЙ ПОКАЗНИК
Завдання 1. Визначити концентрацію йонів Гідрогену в розчині, рН якого дорівнює 6,3.
Розв’язок
З умови завдання маємо: рН = -Ig[H+] = 6,3 або lg[H+] = -6,3; [H+] = 10-6,3; [H+] = 5. 10-7 моль/л.
Завдання 2. Концентрація йонів Н+ в грунтовому розчині сильно кислих підзолистих грунтів дорівнює 10-3 - 10-4 моль/л.
Визначити концентрацію йонів ОН -, рН і рОН розчину.
Розв’язок
З формули йонного добутку води 
визначаємо концентрацію гідроксид-йонів:
 ;
;
 моль/л
моль/л
 моль/л
моль/л
За концентрацією йонів Н+ визначаємо рН:
pH= -Ig [H+]:
pH1 = -Ig10 -3 = 3; pH2 = -Ig10 -4 = 4.
За концентрацією йонів ОН - визначаємо pOH:
pOH = -Ig[OH];pOH1 = -Ig10 -11 = 11; pOH2 = -Ig10 -10 = 10.
ТЕМА 7. ГІДРОЛІЗ СОЛЕЙ
Завдання 1. Кислі болотні грунти мають високий вміст алюміній хлориду, який знижує рН і погіршує структуру грунтів. Чим це пояснюється?
Розв’язок
Алюміній хлорид АІСІ3 – це сіль, утворена слабкою основою і сильною кислотою, тому вона гідролізується. Гідроліз відбувається за катіоном, і в розчині накопичуються йони Гідрогену, які спричиняють зниження водневого показника рН:
АІСІ3 = АІ+3 +3СІ-
АІ3+ + НОН L АІОН2+ +Н+, рН < 7, в молекулярній формі.
АІСІ3 + НОН L АІОНСІ2 + НСІ.
Завдання 2. В грунтовому розчині солончаків міститься натрій карбонат Na2CO3 (сода). Чому ці грунти мають лужну реакцію?
Розв’язок
Сода Na2CO3 – це сіль, утворена сильною основою і слабкою кислотою, тому вона гідролізується. Гідроліз відбувається за аніоном, і в розчині накопичуються йони ОН -, які спричиняють лужну реакцію.
Na2CO3 = 2Na+ + CO32-
СО32- + НОН L НСО3- + ОН- або в молекулярній формі
Na2CO3 + H2O L NaHCO3 + NaOH; рН > 7 (лужне cередовище).
ТЕМА 8. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Завдання 1. Лужність ґрунтового розчину може виникнути внаслідок життєдіяльності сульфатредукуючих бактерій, які відновлюють натрій сульфат в анаеробних умовах за схемою:
Na2SO4 + C → CO2 + Na2S;
Na2S + CO2 + H2O → Na2CO3 + H2S.
До яких типів належать ці реакції?
Для окисно-відновної реакції скласти електронні рівняння, розставити коефіцієнти і визначити молярні маси еквівалентів окисника та відновника.
Розв’язок
Визначаємо ступені окиснення елементів в обох реакціях:


В першому випадку змінюються ступені окиснення елементів, в другому - ступені окислення залишаються незмінними.
Отже, перша реакція - окисно-відновна, друга - не належить до окисно-відновних.
В окисно-відновній реакції змінюють ступінь окиснення Сульфур і Карбон.
Визначаємо окисник і відновник.
Окисник – це речовина, атоми або йони якої приєднують електрони, а відновник – це речовина, атоми або йони якої віддають електрони. Отже, окисник – Na2SO4, відновник – С.
Складаємо електронні рівняння і визначаємо процеси відновлення і окиснення.
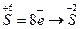 - відновлення-приєднання електронів;
- відновлення-приєднання електронів;
 - окиснення-втрата електронів.
- окиснення-втрата електронів.
Визначаємо найменше спільне кратне для кількості відданих і приєднаних електронів та одержуємо коефіцієнти для окисника і відновника.
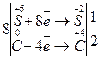
За коефіцієнтами лівої частини рівняння ставимо коефіцієнти в праву частину:
Na2SO4 + 2C = 2CO2 + Na2S.
Завдання 2. Визначити еквіваленти і молярні маси еквівалентів окисника і відновника в такій окисно-відновній реакції:
H2S + H2SO3 = S + H2O.
Розв’язок

відновник окисник

Йон S2- віддає 2 електрони, тому fЕКВ для H2S дорівнює 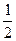 , а еквівалент - -
, а еквівалент - - 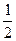 H2S. Йон SO32- приймає 4 електрони, тому fЕКВ для
H2S. Йон SO32- приймає 4 електрони, тому fЕКВ для
H2SO3 дорівнює  , а еквівалент -
, а еквівалент -  H2SO3.
H2SO3.
Молярна маса еквівалента відновника H2S:

Молярна маса еквівалента окисника H2SO3:







