Коефіцієнтом розподілу називають відношення концентрації домішки у твердій фазі до її концентрації у рідкій фазі. Це важливий параметр металургійного процесу, який визначає характер розподілу домішки вздовж вирощуваного кристала. Розрізняють рівноважний k0 і ефективний k коефіцієнти розподілу. Рівноважний коефіцієнт розподілу домішки k0 характеризує відношення концентрацій домішки в твердій і рідкій фазах за умов термодинамічної рівноваги
k 0 =  , (1.1)
, (1.1)
він тісно пов'язаний з бінарної діаграмою стану "напівпровідник - домішка". За малих концентрацій домішки (частки атомних %) і температурах, близьких до температури топлення основного компонента, можна представити криві ліквідусу і солідусу у вигляді двох відрізків, дотичних до ліній ліквідусу і солідусу в точці топлення основного компонента А (рис. 1.2).
| k 0 < 1 | k 0 > 1 |
 а а
|  б
б
|
а - домішка, яка знижує температуру топлення;
б - домішка, яка підвищує температуру топлення
Рисунок 1.2 - Фазові діаграми поблизу точки топлення основного компонента А
Домішки із значенням коефіцієнта розподілу менше одиниці знижують температуру кристалізації основної речовини. Якщо коефіцієнт розподілу більше одиниці, то введення домішки збільшує температуру кристалізації.
У реальності термодинамічно рівноважні умови не можуть бути реалізовані. Це пов'язано перш за все з тим, що процес кристалізації має кінцеву швидкість, коефіцієнти дифузії домішок у твердій фазі незначні, а дифузійні процеси у твердій фазі уповільнені, внаслідок чого стан термодинамічної рівноваги на межі "тверде - рідина" не встигає встановлюватися. При малих швидкостях направленої кристалізації рівноважний коефіцієнт розподілу може описувати умови рівноваги на межі розподілу рідкої і твердої фаз (рис. 1.3, а, в). У цьому разі концентрація домішки у всьому об'ємі стопу буде однаковою, а її концентрація в закристалізованій частині С т = k 0 С р.
Якщо швидкість кристалізації має кінцеве значення, то перед фронтом кристалізації з ростом кристала утворюється шар стопу з ефективною товщиною δ, збагачений домішкою, якщо k 0 <1, і збіднений домішкою, якщо k 0>1 (рис.1.3, б,г). За цих умов вміст домішки в закристалізованій частині зливка С т визначатиметься концентрацією домішки в стопі біля фронту кристалізації С т = k 0 С р0. Значення С р0, як правило, невідоме, тому в нерівноважних умовах зв'язок між концентраціями домішки у твердій С т і рідкій Ср фазах здійснюють за допомогою ефективного коефіцієнту розподілу k. Під Ср тут слід розуміти концентрацію домішки в об'ємі стопу.
Зв'язок між рівноважним k 0 і ефективним k коефіцієнтами розподілу визначають за допомогою рівнянням Бартона - Прима – Сліхтера:
k = 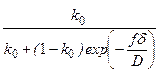 , (1.2)
, (1.2)
де f – швидкість кристалізації;
δ – товщина дифузійного шару;
D – коефіцієнт дифузії домішки у рідкій фазі.
Товщину дифузійного шару δ розраховують за формулою Сліхтера:
δ = 1,6 D1/3ν1/6ω–1/2, (1.3)
де D - коефіцієнт дифузії домішки в рідкій фазі, см2 / с;
ν - кінематична в'язкість стопу, см2 / с;
ω - швидкість обертання кристала щодо тигля, рад / с.
Значення δ може змінюватися від 1 до 10-3 см.
Рівноважний коефіцієнт розподілу розраховують з умови рівності хімічного потенціалу компоненту В у рівноважних твердій і рідкій фазах за виразом
ln k В =  , (1.4)
, (1.4)
| k 0 < 1 | |
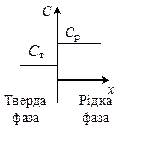
| 
|
| а | б |
| k 0 > 1 | |

| 
|
| в | г |
а, в - у рівноважних умовах (швидкість кристалізації нескінченно мала); б, г - у нерівноважних умовах (швидкість зростання кристалізації має кінцеве значення)
Рисунок 1.3 - Розподіл домішок на межі розділу твердої і рідкої фаз
де Δ H т о плВ - ентальпія топлення чистого компоненту В;
Т - температура ліквідусу твердого розчину "напівпровідник - домішка", К;
Т топлВ - температура топлення чистого компоненту В, К;
 і
і 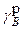 - коефіцієнти активності компонента В у рівноважних твердій і рідкій фазах;
- коефіцієнти активності компонента В у рівноважних твердій і рідкій фазах;
R - універсальна газова стала, R = 8,31 Дж / (моль∙К).
Оскільки роботу проводять з малими концентраціями домішки у твердій фазі (Т» ТА), то рівняння (1.4) приймає наступний вигляд:
ln k В =  . (1.5)
. (1.5)
Розрахункові значення коефіцієнтів активності залежать від обраної моделі розчину. Якщо рідкий і твердий розчини ідеальні, і γ Вi = 1, то рівняння для розрахунку рівноважного коефіцієнта розподілу таке:
ln k В =  . (1.6)
. (1.6)
Однак це наближення здебільшого не є достатньо коректним. Значно більшу точність вдається отримати при використанні наближення регулярного розчину, яке враховує міжатомну взаємодію в суміші компонентів. Відповідно до цієї моделі, коефіцієнт активності g компонентів у бінарній системі А - В визначається за формулою
RT lng B = a АВ (1 – хB)2, (1.7)
де a АВ - параметр міжатомної взаємодії у відповідній рідкій або твердій фазі; хВ - концентрація компонента В (в атомних частках) у відповідній фазі. У моделі регулярних розчинів параметр взаємодії a АВ беруть незалежним від температури і концентрації компонентів. У наближенні квазірегулярного розчину параметр взаємодії зазвичай розглядають як лінійну функцію температури
a АВ = а – bТ. (1.8)
Вивчення поводження домішок у кремнії і германії показало, що до твердої фази можна застосувати наближення регулярних розчинів, а до рідкої - переважно квазірегулярних. Тому в області нескінченно малих концентрацій компонента В коефіцієнт розподілу kВ можна визначити за допомогою наступного виразу:
ln k В =  =
=
=  . (1.9)
. (1.9)
У Додатку А (табл. 1.1, 1.2) наведено деякі термодинамічні характеристики напівпровідників і легуючих елементів, параметри міжатомної взаємодії в рідкій і твердій фазах для бінарних систем на основі германію і кремнію.






