На практиці можуть зустрітися парові процеси, які протікають у області або вологої насиченої пари, або у області перегрітої пари, або так, що одна частина процесу протікає у області вологої насиченої, а інша – у області перегрітої пари.
Для аналізу роботи паросилових установок велике значення мають ізохорний, ізобарний, ізотермічний і адіабатний процеси. Відрізки 1 – 1'' і 1'' – 2 на малюнках відносяться до випадків протікання процесів без зміни агрегатного стану пари: на відрізку 1 – 1'' пара залишається вологою насиченою, а на відрізку 1'' – 2 – перегрітою. Відрізок 1 – 2 відповідає випадку протікання процесу, в якому пара переходить з насиченого стану в перегрітий.
Ізохорний процес.
Ізохори на p, v –, T, S – і h, S – діаграмах представлені на мал. 12.1.
Ізохорний процес на р-v діаграмі (мал. 12.1.а) зображається відрізком вертикальної прямої 1-2, а на Т, S діаграмі (мал. 12.1б) – кривою лінією, яка у області вологої пари направлена опуклістю вгору, а у області перегрітої пари – опуклістю вниз. У h, S діаграмі (мал.12.1в) ізохора у області вологої пари є кривою, вельми близькою до прямої похилої, а у області перегрітої пари, направлену опуклістю вниз. Причому на цих діаграмах ізохори нахилені декілька крутіше за ізобари.
На Т, S – діаграмі, ізохори, які перетинають прикордонну криву пари, не можуть перетинати прикордонну криву рідини, оскільки завжди питомий об'єм рідини (х = 0) менше питомого об'єму сухої насиченої пари (х = 1).
З мал. 12.1а видно, що для всіх ізохорних процесів у області вологої пари можливі 2 випадки: 1) v < vкр. (де vкр – питомий об'єм в критичній точці); 2) v > vкр.
При підведенні теплоти до вологої пари в першому випадку (процес а-б) відбувається зменшення ступеня сухості вологої пари і в точці б перетини ізохори з прикордонною кривою рідини волога пара повністю перетворюється на воду.
При цьому температура і тиск підвищуються. Температура в точці б дорівнює температурі кипіння води при тиску рб. Підведення теплоти вологої пари в другому випадку v > vкр (процес 1 – 2) приводить до підвищення ступеня сухості вологої пари. У точці 1'' пар стає сухим насиченим. Подальше підведення теплоти викликає його перегрів.
Таким чином, в ізохорному процесі кількість теплоти q  , що підводиться до пари, витрачається на зміну його внутрішній енергії, тобто.:
, що підводиться до пари, витрачається на зміну його внутрішній енергії, тобто.:  , (12.1)
, (12.1)
або:  , (12.2)
, (12.2)
 На T, S–діаграммі кількість теплоти q
На T, S–діаграммі кількість теплоти q  зображається заштрихованою площею.
зображається заштрихованою площею.
При графічному методі розрахунку, величини, які входять у формулу 12.2, знаходять по h, S –діаграмі. При розрахунковому методі величини для 12.2 обчис-
Мал.12.1 люють за відповідними формулами. Ентальпію вологої пари визначають: 

Величини h' і r беруть з таблиць вологої пари для тиску р1. Ступінь сухості пари x = vx / v '' знаходять так: v '' беруть з таблиць вологої пари за тиском р1, а vx заданоза умовою завдання положенням точки 1. Значення ентальпії h2 (мал. 12.1.в) береться з таблиць перегрітої пари.
Ізобарний процес.
На мал. 12.2. приведений ізобарний процес в p, v –, T, S – і h, S – діаграмах.
Як видно, на p, v – діаграмі (рис.12.2.а), ізобара зображається горизонтальною прямою 1-2. У області вологої насиченої пари ізобара є одночасно і ізотермою. При підведенні теплоти до вологої насиченої пари, ступінь сухості її збільшується і волога пара при t=const переходить в суху насичену пару, а потім в перегріту.
На Т, S – діаграмі (мал. 12.2б) у області вологої насиченої пари ізобара також представляється прямою горизонтальною лінією, а у області перегрітої пари – кривою 1''-2, яка піднімається вгору і направлена опуклістю вниз.
На h, S – діаграмі (мал. 12.2.в) ізобара у області вологої насиченої пари представляє пряму похилу, що перетинає прикордонні криві рідини і пари. У області перегрітої пари вона переходить в криву, обернену опуклістю вниз.
Кількість теплоти, що підводиться до пари в ізобарному процесі, розраховується за рівнянням: q = h2 – h1, (12.3)
На T, S – діаграмі ця кількість дорівнює заштрихованій площі 1-2-S2-S1, а на h, S – діагра-мі – різниці ординат точок 2 і 1.
Робота процесу: l1-2 = q1-2 – (u2-u1) = p (v2 – v1), (12.4)
У p, v – діаграмі робота розширення дорівнює площі під ізобарою,тобто, заштрихованій площі прямокутника 1-2- v2 - v1.
Зміна внутрішньої енергії пари:
 , (12.5)
, (12.5)
Для процесу, що протікає у області вологої пари при p=const, за рівнянням 11.30. маємо:
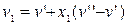 ,
,  .
.
Звідси знаходимо:  , (12.6)
, (12.6)
Нехтуючи питомим об'ємом рідини V’ у зв'язку з тим, що V1>>V’ і V2>>V’, одержуємо:
 , (12.7)
, (12.7)
v' і v'' визначаються за таблицями насиченої пари при заданому p=const.
Величини h2, h1, v2, v1 для (12.5) визначають або по h, S – діаграмі, або за відповідними формулами, паровими таблиця- ми.Наприклад, значення ен- тальпії вологої пари h1 визна-
 чається по формулі:
чається по формулі:

де х = vх /v'', а значення h', r, v'' беруть з таблиць вологої пари; h2, v2 для (12.5) – з таблиць перегрітої пари.
Мал. 12.2
Ізотермічний процес.
Ізотермічний процес в p, v –; T, S –; h, S –діаграмах зображений на мал. 12.3.
Як видно в p, v – діаграмі (мал. 12.3а) ізотерма у області вологої пари зображається відрізком горизонтальної прямої, яка одночасно є ізобарою. У області перегрітої пари вона переходить в гіперболічну криву, пологішу, ніж рівнобічна гіпербола (ізотерма ідеального газу).  У T, S – діаграмі (мал.12.3б) ізотермічний про- цес повністю зображається від- різком горизонтальної прямої.У h, S – діаграмі (мал. 12.3в) ізотерма у області вологої пари є прямою похилої, яка одночасно є ізобарою; у області перегрітої пари – крива, нап- равлена опуклістю вгору. Ця
У T, S – діаграмі (мал.12.3б) ізотермічний про- цес повністю зображається від- різком горизонтальної прямої.У h, S – діаграмі (мал. 12.3в) ізотерма у області вологої пари є прямою похилої, яка одночасно є ізобарою; у області перегрітої пари – крива, нап- равлена опуклістю вгору. Ця
мал.12.3 крива піднімається зліва направо і у міру віддалення від прикордонної кривої пари, асимптота наближається до горизонталі.
Кількість теплоти, підведена до 1 кг пари в ізотермічному процесі 1 – 2 (розширення пари), визначається за формулою:  , (12.8)
, (12.8)
У T,S – діаграмі кількість теплоти q1-2 дорівнює
заштрихованій площі прямокутника S1-1-2-S2.
Необхідно відзначити, що для водяної пари, як і для будь-якого реального газу, внутрішня енергія в процесі при Т=const на відміну від внутрішньої енергії ідеального газу змінюється унаслідок зміни потенційної енергії сил взаємодії між молекулами. Тому можна записати:
 , (12.9)
, (12.9)
Робота розширення пари визначається за рівнянням:
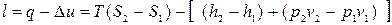 , (12.10)
, (12.10)
Величини, що входять в ці рівняння, можна знайти по h,S – діаграмі.
Адіабатний процес.
На мал. 12.4. приведений адіабатний процес в p, v –; T, S –; h, S –діаграмах.
 Рівноважний адіабатний процес протікає при постійній ентропії, тому на T, S і h, S –ді-аграмах адіабати зображаються відрізком відрізком прямої.
Рівноважний адіабатний процес протікає при постійній ентропії, тому на T, S і h, S –ді-аграмах адіабати зображаються відрізком відрізком прямої.
З мал. 12.4.а видно, що при адіабатному розширенні волога пара або зволожується або підсушується залежно від того,
Мал. 12.4 ближче до якої прикордонної кривої (рідини або пари) розташована початкова точка. Значення показника адіабати різні для перегрітї і вологї насиченї пари. У області вологої насиченої пари, показник адіабати визначається за формулою:
k=1,035+0,1x, (12.11)
Причому значення ступеня сухості х вологої пари при його розширенні приймається в початковому, а при стисненні - в кінцевому стані процесу.
Для адіабати, що починається або закінчується на прикордонній кривій пари (х = 1), k=1,135.
Для адіабати, повністю розташованої у області перегрітої пари, k=1,3. Тому, в p, v – діаграмі на прикордонній кривій пари адіабата має перегин (точка 1'' мал. 12.4.а).
Оскільки значення показника є середніми і наближеними, то при точних розрахунках ними користуватися не можна. Точний розрахунок адіабатних процесів проводиться за допомогою таблиць. Адіабата перегрітої водяної пари, подібно до адіабати ідеального газу, належить до сімейства політропних кривих. Тому, до неї застосовні ті формули для обчислення роботи, які витікають з рівняння, а саме:
 , (12.12)
, (12.12)
Для адіабатного процесу q1-2=0. Отже, на підставі 1-го закону ТТД робота адіабатного процесу визначається із співвідношення:
 , (12.13)
, (12.13)
Зміна внутрішньої енергії:
 , (12.14)
, (12.14)






