Лекція 6. АМІНИ
Амінами називаються похідні амоніаку, в молекулі якого один, два або три атоми Гідрогену заміщені на вуглеводневі радикали. Залежно від кількості вуглеводневих залишків розрізняють первинні, вторинні й третинні аміни:
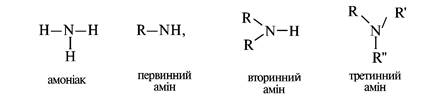
Залежно від природи вуглеводневих радикалів при атомі Нітрогену аміни поділяють на аліфатичні, аліциклічні та ароматичні. Аміни, в яких атом Гідрогену зв'язаний з аліфатичним і ароматичним вуглеводневими радикалами, називають змішаними:

НОМЕНКЛАТУРА ТА ІЗОМЕРІЯ
За замісниковою номенклатурою IUPAC назви первинних амінів утворюють шляхом додавання до назви вуглеводню суфікса -амін з позначенням положення аміногрупи в ланцюзі. При цьому найпростіші аміни називають за радикало-функціональною номенклатурою: назви амінів утворюють від назв вуглеводневих радикалів, які перелічують в алфавітному порядку, та суфіксу -амін:

При складанні назв вторинних і третинних амінів їх розглядають як похідні первинного аміну із замісниками при атомі Нітрогену. За вихідний первинний амін у цьому випадку беруть найскладніший за структурою радикал, зв'язаний з атомом Нітрогену. Решту вуглеводневих замісників перелічують в алфавітному порядку, вказуючи локант N-:
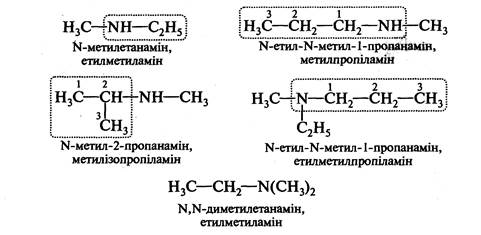
Якщо сполука містить дві або три аміногрупи, то в назві їх позначають множними префіксами ді- або три-, які ставляться перед суфіксом -амін:

Назви первинних ароматичних амінів, а також змішаних амі-нів утворюють за основою родоначального представника — анілі-ну. У випадку змішаних амінів положения замісників при атомі Нітрогену позначають локантом N-:

Похідні толуену, що містять аміногрупу в бензеновому ядрі, називають толуїдинами:

Ізомерія амінів зумовлена різною структурою вуглеводневих радикалів, різним положениям аміногрупи та метамерією. Суть метамерії полягає в тому, що аміни з тією ж самою бруто-форму-лою можуть бути первиииими, вторинними і третинними. Наприклад, метамерами є:

АЛКІЛАМІНИ
Алкіламінами називаються продукти заміщення одного, двох або трьох атомів Гідрогену в молекулі амоніаку алкільними трупами.
ХІМІЧНІ ВЛАСТИВОСТІ
Реакційна здатність алкіламінів визначається переважно наявністю в атома Нітрогену неподіленої пари електронів. За рахунок пари електронів атома Нітрогену аміни, з одного боку, здатні приєднувати протон від кислоти, виявляючи при цьому основні властивості, а з іншого,— можуть атакувати в молекулі реагенту електрофільний центр (частіше атом Карбону, що несе частковий або повний позитивний заряд) і утворювати хімічний зв'язок з ним, виявляючи нуклеофільні властивості.
Через порівняно низьку електронегативність атома Нітрогену та +І-ефект з боку алкільних груп зв'язок N—Н в алкіламінах малополяризований. Тому первинні та вторинні аміни є дуже слабкими NH-кислотами.
Основність
Будучи похідними амоніаку, алкіламіни подібно до нього виявляють основні властивості, зумовлені наявністю на атомі Нітрогену неподіленої пари електронів. Причому, алкіламіни є сильнішими основами, ніж амоніак.
Водні розчини алкіламінів мають лужне середовище:

3 кислотами алкіламіни утворюють солі алкіламонію:
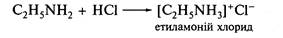
При дії на амонієву сіль сильною основою, наприклад натрій гідроксиду, вивільняється вихідний амін:

Реакцію солеутворення з подальшим виділенням вільного амі-ну часто використовують для очищения амінів.
Реакції з електрофільними реагентами
Взаємодія з галогеналканами. За допомогою цієї реакції до струк-тури аміну вводять алкільний замісник, тому вона дістала назву реакції алкілування. При взаємодії з галогеналканами первинні аміни перетворюються на вторинні, вторинні — на третинні, а третинні — утворюють четвертинні амонієві солі, наприклад:
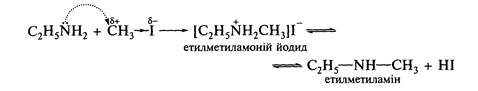
Аналогічно вторинний амін алкілується з утворенням третинного, а третинний — з утворенням четвертинної амонієвої солі (див. реакцію Гофмана).
Залежно від природи галогеналкану і алкіламіну реакція може відбуватися за механізмом SN1 або SN2.
Ацилування. Первинні та вторинні алкіламіни вступають у реакцію з функціональними похідними карбонових кислот — галогенангідридами, ангідридами або естерами, утворюючи аміди:

У процесі реакції атом Гідрогену при атомі Нітрогену в молекулі аміну заміщується на залишок карбонової кислоти  — ацильну групу. Реакції, за допомогою яких у молекулу органічної речовини вводиться ацильна група, називають реакціями ацилування.
— ацильну групу. Реакції, за допомогою яких у молекулу органічної речовини вводиться ацильна група, називають реакціями ацилування.
Третинні аміни не мають при атомі Нітрогену атома Гідрогену і тому в реакцію ацилування не вступають.
Відновлення нітроаренів (реакція Зініна):
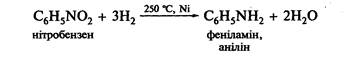
Як відновники використовують метали (Fe, Zn, Sn) у середовищі хлоридної кислоти, Na2S, SnCl2, водень у присутності каталізатора та ін.
Взаємодія галогенаренів з амоніаком і амінами. Галогенарени ре-агують з амоніаком, первинними та вторинними амінами за жорстких умов (високі тиск і температура, присутність як каталізатора міді або її солей). При взаємодії з амоніаком утворюються первинні ариламіни:

При взаємодії галогенаренів з ариламінами утворюються вторинні та третинні ариламіни:

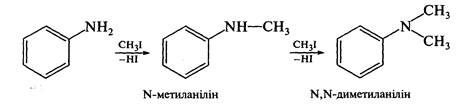
Алкілування первинних ариламінів. Цей метод дозволяє добувати змішані N-алкіл- та К,К-діалкілариламіни. Як алкілувальні реагенти найчастіше використовують галогеналкани або спирти в присутності кислот. У процесі реакції утворюється суміш вторинного і третинного амінів:
Взаємодія з нітритною кислотою. Первинні, вторинні й третинні ароматичні аміни при взаємодії з азотистого кислотою утворюють різні продукти. При дії азотистої кислоти на первинні ароматичні аміни в присутності сильної мінеральної кислоти утворюються солі діазонію. Ця реакція дістала назву реакції діазотування:
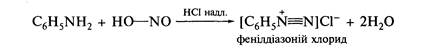
При нагріванні водні розчини солей діазонію розкладаються:







