Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства.
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:

Поэтому амины и аммиак обладают свойствами оснований.
1. Основные свойства.Будучи производными аммиака, все амины обладают основными свойствами.
Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические - более слабыми.
Это объясняется тем, что радикалы СН3-, С2Н5 - и др. проявляют положительный индуктивный (+I) эффект и увеличивают электронную плотность на атоме азота:
СН3 → NH2
Это приводит к усилению основных свойств.
Фенильный радикал C6H5— проявляет отрицательный мезомерный (-М) эффект и уменьшает электронную плотность на атоме азота:
 В водном растворе амины обратимо реагируют с водой, при этом среда становится слабощелочная:R-NH2 +H2O ⇄[R-NH3]++ OH-
В водном растворе амины обратимо реагируют с водой, при этом среда становится слабощелочная:R-NH2 +H2O ⇄[R-NH3]++ OH-
|
| 2. Амины реагируют с кислотами, образуя соли: CH3-NH2 + H2SO4 à [CH3NH3]HSO4 C6H5NH2 + HCl à [C6H5NH3]Cl Cоли аминов — твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов). При действии щелочей на соли аминов выделяются свободные амины: [CH3NH3]Cl + NaOH -tà CH3NH2 + NaCl + H2O Соли аминов вступают в обменные реакции в растворе: [CH3NH3]Cl + AgNO3 -tà [CH3NH3]NO3+ AgCl ↓ |
| 3. Амины способны осаждать гидроксиды тяжелых металлов из водных растворов:2R-NH2 + FeCl2 + 2H2O à Fe(OH)2↓+ 2[RNH3]Cl |
| 4. Горение. Амины сгорают в кислороде, образуя азот, углекислый газ и воду: 4 С2Н5NH2 + 15O2 à 8CO2 + 2N2 + 14 H2O |
| 5. Реакции с азотистой кислотой. а) Первичные алифатические амины при действии азотистой кислоты превращаются в спирты: R-NH2 + NaNO2 + HCl à R-OH +N2 + NaCl + H2O б) Вторичные амины (алифатические и ароматические) дают нитрозосоединения — вещества с характерным запахом: R2NH + NaNO2 + HCl à R2N-N=O + NaCl + H2O |
Особенности свойств анилина:
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
Особенности этих реакций обусловлены взаимным влиянием атомов.
- бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
- бензольное кольцо становится более активным в реакциях замещения, чем бензол.
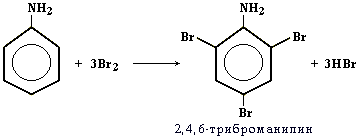
Аминогруппа - заместитель 1-го рода (активирующий орто-пара -ориентант в реакциях электрофильного замещения в ароматическом ядре). Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).
|
АМИНОКИСЛОТЫ
Аминокислоты — органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы -NH2.
Простейший представитель — аминоуксусная кислота H2N-CH2-COOH (глицин)

Природные аминокислоты можно разделить на следующие основные группы:
| 1) алифатические предельные аминокислоты (глицин, аланин) | NH2-CH2-COOH глицин NH2-CH(CH3)-COOH аланин |
| 2) серосодержащие аминокислоты (цистеин) | NH2-CH(CH2SH)-COOH цистеин |
| 3) аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2ОH)-COOH серин |
| 4) ароматические аминокислоты (фенилаланин, тирозин) | NH2-CH(CH2С6Н5)-COOH
фенилаланин
 тирозин тирозин
|
| 5) аминокислоты с двумя карбоксильными группами (глутаминовая кислота) | NH2-CH(CH2СН2COOH)-COOH глутаминовая кислота |
| 6) аминокислоты с двумя аминогруппами (лизин) | NH2(CH2)4-CH(NH2)-COOH лизин |
Номенклатура аминокислот
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:

Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита. Пример:

Для α-аминокислот R-CH(NH2)COOH, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия.
ПОЛУЧЕНИЕ АМИНОКИСЛОТ.
1. Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:

2. Присоединение аммиака к α,β-непредельным кислотам с образованием β-аминокислот (против правила Марковникова): CH2=CH–COOH + NH3 à H2N–CH2–CH2–COOH
3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот): O2N–C6H4–COOH + 3H2 à H2N–C6H4–COOH + 2H2O
СВОЙСТВА АМИНОКИСЛОТ.
Физические свойства
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы электропроводны. При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион: H2N-CH2-COOH ⇄ +H3N-CH2-COO-






