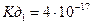¬ залежност≥ в≥д сили вих≥дних кислоти чи основи сол≥ можна розпод≥лити на 4 типи:
 |
—ол≥ 1,2,3 тип≥в п≥дл€гають г≥дрол≥зу, сол≥ 4-го типу Ч не п≥дл€гають г≥дрол≥зу.
–озгл€немо г≥дрол≥з солей кожного типу:
1) 





 Ч визначаЇтьс€ праворуч Ч лужне.
Ч визначаЇтьс€ праворуч Ч лужне.
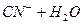


г≥дрол≥з ≥де по ан≥ону (середовище маЇ такий самий знак).
 | |||
 | |||



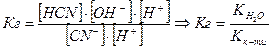
„им б≥льш слабкою буде кислота, тим сильн≥ше њњ сол≥ п≥дл€гають г≥дрол≥зу.
2) 








“аким чином, в розчин≥ накопичитьс€ надлишок ≥он≥в  ≥
≥ 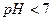 , тобто
, тобто
середовище кисле, а г≥дрол≥з ≥де по кат≥ону.

„им б≥льш слабка основа, тим в б≥льшому ступен≥ п≥дл€гають г≥дрол≥зу
сол≥, що утворен≥ нею.
3) 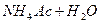





 близько 7, тому немаЇ надлишку н≥ ≥он≥в
близько 7, тому немаЇ надлишку н≥ ≥он≥в  , н≥ ≥он≥в
, н≥ ≥он≥в  , а
, а
г≥дрол≥з ≥де по ан≥ону ≥ кат≥ону.

„им б≥льш слабк≥ кислота ≥ основа, тим б≥льш буде  ≥ тим б≥льше с≥ль
≥ тим б≥льше с≥ль
п≥дл€гаЇ г≥дрол≥зу.
4) 








“ому, процес г≥дрол≥зу солей, що утворен≥ сильною кислотою та сильною основою зведений до процесу дисоц≥ац≥њ молекул води ≥ вести розмову про г≥дрол≥з не можна. √≥дрол≥зу не п≥дл€гають, тому що р≥вновага м≥ж недисоц≥йованими молекулами ≥ ≥онами води не порушуЇтьс€.
ƒл€ перших трьох тип≥в солей г≥дрол≥зу п≥дл€гаЇ не вс€ к≥льк≥сть сол≥, що знаходитьс€ в розчин≥, а лише њњ частка. “обто, в розчин≥ встановлюЇтьс€ динам≥чна р≥вновага м≥ж с≥ллю ≥ утвореною кислотою або основою. “аким чином, стан г≥дрол≥зу може бути охарактеризований ступенем г≥дрол≥зу.
—туп≥нню г≥дрол≥зу сол≥ називаЇтьс€ в≥дношенн€ числа г≥дрол≥зованих молей сол≥ до загальноњ к≥лькост≥ молей сол≥, що знаход€тьс€ в розчин≥:
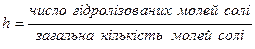
—туп≥нь г≥дрол≥зу  залежить в≥д
залежить в≥д  концентрац≥њ сол≥.
концентрац≥њ сол≥.  визначаЇтьс€ природою сол≥ ≥
визначаЇтьс€ природою сол≥ ≥  теж визначаЇтьс€ природою сол≥, що видно з попередн≥х викладок (закон ќствальда). –≥вновага г≥дрол≥зу, €к ≥ любому р≥вноважного процесу, може бути зм≥щеною.
теж визначаЇтьс€ природою сол≥, що видно з попередн≥х викладок (закон ќствальда). –≥вновага г≥дрол≥зу, €к ≥ любому р≥вноважного процесу, може бути зм≥щеною.
ѕ≥двищенн€ температури розчину сол≥ або зменшенн€ його концентрац≥њ, тобто розведенн€ розчину, може значно посилити г≥дрол≥з. р≥м того, ослабленню г≥дрол≥зу спри€Ї п≥дкисленн€ або п≥длуженн€ розчин≥в.
ƒо цього ми розгл€дали г≥дрол≥з солей, що переб≥гають в одну стад≥ю. ўо ж в≥дбуваЇтьс€, коли сол≥ ≥ зм≥стити р≥вновагу в сторону продукт≥в г≥дрол≥зу. «м≥щенню р≥вноваги в сторону вих≥дних речовин, тобто ослабленн€ його, спри€Ї зниженн€  розчину ≥ п≥двищенн€ концентрац≥њ сол≥.
розчину ≥ п≥двищенн€ концентрац≥њ сол≥.
« цього виб≥гаЇ, що збер≥гати розчини дл€ ослабленн€ процесу с≥ль м≥стить б≥льше 1-го кат≥ону, чи ан≥ону.
√≥дрол≥з солей, утворених слабкою багатоосновною кислотою або слабкою багатокислотною основою, переб≥гаЇ поступово, дек≥лька стад≥й.
–озгл€немо в тому ж пор€дку, що й одноосновн≥ ≥ однокислотн≥ сполуки.
1) 




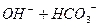

 I ст.
I ст.
ѕор≥вн€но з 


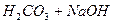


 I I ст.
I I ст.

як ви памТ€таЇте  . “ому г≥дрол≥з по перш≥й стад≥њ завжди переб≥гаЇ в б≥льшому ступен≥, н≥ж по друг≥й. √≥дрол≥з по трет≥й стад≥њ Ч проблематичний.
. “ому г≥дрол≥з по перш≥й стад≥њ завжди переб≥гаЇ в б≥льшому ступен≥, н≥ж по друг≥й. √≥дрол≥з по трет≥й стад≥њ Ч проблематичний.
“реба памТ€тати, що стад≥й г≥дрол≥зу завжди на одиницю менше, н≥ж зар€д самого багатозар€дного ≥она (вин€ток  )
)
|
|
|
2) 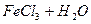





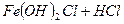
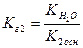


 - практично не ≥де
- практично не ≥де 
3) б≥льш глибоко ≥де г≥дрол≥з солей, що утворен≥ слабкою кислотою та слабкою основою:

√≥дрол≥з йде в одну стад≥ю ≥ до к≥нц€, тому що г≥дрол≥з кат≥она ≥ ан≥она п≥дсилюЇтьс€ один одним ≥ р≥вновага зм≥щуЇтьс€ в сторону утворенн€ к≥нцевих продукт≥в.
¬ажливим Ї процес посиленн€ г≥дрол≥зу в результат≥ реакц≥њ обм≥ну м≥ж сол€ми. Ќаприклад:

ѕовинна була б утворитис€ с≥ль Ч алюм≥н≥й сульф≥д, але ви памТ€таЇте, що г≥дрол≥з такоњ сол≥ йде до к≥нц€, тому в реакц≥њ обм≥ну утворюютьс€ одразу продукти г≥дрол≥зу сол≥. “аке в≥дбуваЇтьс€ дл€ солей, в таблиц≥ розчин≥в €ких стоњть риска.
ƒов≥дка:
ƒл€  :
:








ƒл€  :
: