О2 –ден тұрақты түрде, аз мөлшерде, оттектің активтелген формасы (ОАФ) деп аталатын улы заттар туындайды. Бұл қосылыстар күшті тотықтырғыш немесе өте реакцияласуға қабілетті бос радикал болып табылады. Олар жасуша құрылымын және қызметші молекулаларды бұзады.
Оттек молекуласы (О2) құрамында екі жұптаспаған электрон болады және осылай болғандықтан ол бирадикал болып табылады. Бірақ, О2 молекуласындағы жұптаспаған электрондар оның салыстырмалы түрде тұрақты болуына кедергі келтірмейді. Сонда да, егер молекула қосымша түрде электронды қосатын болса (стадия а), онда жоғары реакцияласуға қабілетті супероксид-радикал (•О2-) түзіледі. Келесі стадия, тотықсыздану, (стадия б) пероксид-анион (•О22-) түзілуіне әкеледі. Ол протонды оңай байланыстырады және соның нәтижесінде сутек асқын тотығы (Н2О2) түзілуіне әкеледі. Үшінші электронның байланысуы (стадия в) молекуланы О2- және О- иондарына ыдыратады. Бұл кезде О2- екі протонды байланыстыру жолымен су түзіуіне әкеледі. Төртінші электронның байланысуы және О- -тің протондалуы гидроксил-радикалдың (•ОН) түзілуімен аяқталады.
ОАФ-зақымдалуға негізінен эритроциттер түседі, олар оттекті тасымалдау қызметін атқаратын болғандықтан, өздерінде оттектің жоғары концентрациясы болуымен сипатталады. Эритроциттердегі оттектің активті формасының тұрақты шығу көзі гемоглобиннің ферментсіз тотығуы: Hb(Fe2+)+O2 ® MeтHЬ(Fe3+) + 02- .
ОАФ эритроциттердің гемолизін дамытуы мүмкін. Эритроциттер құрамында оттек радикалдарының улы әсерін болдырмайтын және эритроциттер мембранасын ыдыраудан сақтайтын ферменттік жүйе болады.
ОАФ әсерінен және басқа да радикалдардан қорғану үшін барлық жасушалардың құрамында тотғуға қарсы тұратын заттар - антиоксиданттар болады.
Антиоксиданттар - тотықсыздандырғыштар, олар тотықтырғыш заттармен оңай реакцияласады және соның нәтижесінде маңызды молекулаларды тотығудан сақтайды. Биологиялық антиоксидантқа С және Ε витаминдері, кофермент Q және кейбір каротиноидтар жатқызылады. Гемнің ыдырауы кезінде түзілетін билирубин де тотығудан қорғайтын қызметті атқарады.
Глутатион (трипептид Glu-Cys-Gly) аса маңызды, ол барлық жасушада жоғары концентрацияда болады. Оның тотықсыздандырғышы цистеин қалдығындағы тиолдық топ. Тотықсызданған формасының екі молекуласы (GSH) тотығу кезінде дисульфидті (GSSG) түзеді.
Эритроциттер де ОАФ-ті инактивтейтін және олардың зақымдалуын қалпына келтіретін жүйе (супероксиддисмутаза, каталаза, GSH) болады.
Ол үшін эритроциттерде қалыпты зат алмасуды қамтамассыз ететін заттар қажет. Сол себепті болуы мүмкін, эритроциттерде метаболизм тек гликолизбен және пентозофосфаттық жолмен шектелген болады.
Гликолиз кезінде түзілетін АТФ бәрінен бұрын Na+/ К+-АТФ-азаның субстраты қызметін атқарады,ол эритроциттердің мембраналық потенциалын ұстайды. Пентозофосфаттық жолда НАДФН+Н+ түзіледі, ол глутатионредуктаза әсерімен глутатиондисульфидтен (GSSG) глутатион (GSH)-тің регенерацияланып қалыптасуына қажетті Н+ -ті береді. Қалыптастырылған (тотықсызданған) глутатион — эритроциттердің ең маңызды антиоксиданты, ол метгемоглобинді қызметті активті гемоглобинге қалыптастыруда кофермент қызметін атқарады. Маңызды қорғаныстық ферментке селенқұрамды глутатионпероксидаза да жатқызылады. (Сур.3.)
Қалыптасқан (тотықсыздаған) глутатион көмегімен Н2О2 детоксикациясы да, сонымен бірге, эритроциттердің мембранасындағы қанықпаған май қышқылдарының АОФ-пен реакциясы кезінде пайда болатын гидропероксидтердің де детоксикациясы атқарылады.
Глюкозо-6-фосфатдегидрогеназа жұмысының генетикалық ақауында және кейбір күшті тотықтырғыш болатын дәрілік заттарды қабылдағанда глутатиондық қорғаныс потенциалы жеткіліксіз болуы мүмкін.
Бұл, жасушаларда гемоглобин молекуласындағы SH-тобының тотығуын жүргізетін оттектің активті формасы мөлшерінің жоғарлауына әкеледі. Гемоглобин мен метгемоглобин протомерлері арасында дисульфидтік байланыс түзілуі олардың агрегаттануына – Хайнц денешіктерінің түзілуіне әкеледі. Бұл денешіктер эритроциттерді ұсақ капиллярларға түскенде ыдырауын жүргізеді (Сурет 4).
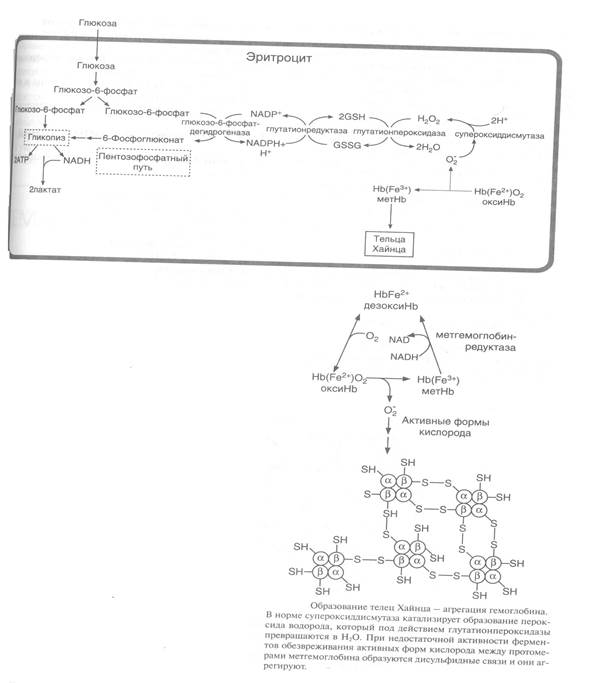
Сурет 2. Хайнц денешіктері түзілуінің механизмі
Эритроциттердің гемолизі
Эритроциттердің ыдырауы (гемолизі) бірнеше жолдармен жүреді. Бірінші, тамырда айналыста болған кезде механикалық соқтығысудан жарақаттанғанда. Бұл кезде жиі түрде жас эритроциттер ыдырайды. Екінші, мононуклеарлық фагоцитарлық жүйе жасушаларының тікелей қатысуымен. Олар эритроциттердің бір бөлігін фагоциттеуші бауыр мен көкбауырда ерекше көп болады. Үшінші, гемолиз нәтижесінде. Эритроциттер қартайған кезде сфераланған формаға айналып айналыстағы қаннның өзінде гемолизденеді.
Гемолиз – бұл эритроциттер қабықшасының ыдырау үдерісі, оның нәтижесінде гемоглобиннің қанға шығарылуы өтеді. Гемолиз бірнеше түрге бөлінеді.
Осмостық гемолиз – гипотониялық ортада дамиды, оның салдарынан қан мөлдір түске («лак түсті қан») айналады. Эритроциттердің осмостық тұрақтылығының (төзімділігі) шамасы натрий хлор ерітіндісінің гемолиз басталатын концентрациясы (физиологиялық ерітінді) болып табылады. Адамда эритроциттер тұрақтылығының шектері 0,4% -дан 0,34% -ға дейін (осындай концентрациясы бар ерітіндіде барлық эритроциттер ыдырайды). Кейбір аурулар кезінде эритроциттердің осмостық тұрақтылығы төмендейді, немесе, гемолиз натрий хлор ерітіндісінің біршама жоғары концентрациясында басталады.
Химиялық гемолиз – эритроциттердің протеиндік-липидтік қабығын ыдырататын заттар әсерінен (эфир, хлороформ және т.б.) өтеді.
Механикалық гемолиз – қанға күшті механикалық әсер болған кезде (мысалы, донорлық қаны бар ампуланы қатты шайқағанда) дамиды.
Термиялық гемолиз – қанды мұздатып және қайта жылытқан кезде байқалады. Эритроцитердің қабықтары мұз кристаллдарының әсерінен зақымдалады.
Биологиялық гемолиз – қанға тірі ағзаларда түзілетін заттардың (сәйкес келмейтін қанды құйған кезде, иммундық гемолизиндер әсері кезінде, биологиялық улардың (жылан, ара және т.б. улары) әсері кезінде) дамиды.
Темір алмасуы
Темірқұрамды протеиндердің биосинтезі үшін қажетті темірдің шығу көзі тағам өнімдері болып табылады. Бірақ, тағам темірінің 10%-ға жуығы ғана сіңіріледі. Бауыр мен көкбауыр жасушаларында эритроциттердің тұрақты ыдырауын кезінде босатылатын темір, қайтадан, темірқұрамды протеиндердің синтезі үшін пайдаланылады. Асқазандағы қышқылдық орта және тағам құрамындағы аскорбин қышқылы темірдің тағамдық органикалық заттармен тұздарынан көп мөлшерде босатылуын қамтамассыз етеді және сіңірілуін жақсартады.
Темірдің энтероциттерден қанға түсуі олардағы синтезделетін апоферритин протеинінің синтезделу жылдамдығына тәуелді болады. Апоферритин ішектің шырышты жасушаларында темірді өзіне байланыстырады да ферритинге айналады. Ол энтероциттерде қалады. Бұл жағдай темірдің ішек жасушаларынан қан капиллярларына түсуін төмендетеді. Ағзада темір қажеттілігі аз болғанда апоферритин синтезінің жылдамдығы жоғарлайды. Ішектің шырышты жасушаларының солуы (слущивание) кезінде ағза артық темірден босатылады. Ағзада темірдің жетіспеушілігі кезінде апоферритин энтероциттерде мүлдеге жуық синтезделмейді.
Қан ферменті ферроксидаза (церулоплазмин) темірді тотықтырады, ол қандағы гликопроетин трансферринмен байланысады және қан құрамында тасымалданады.
Трансферрин арнайы рецепторлармен байланысып қаннан жасушаға түседі. Трансферрин рецепторларының мөлшері жасушадағы темір мөлшеріне тәуелді және протеин-рецептордың генінің транскрипциясы деңгейінде реттеледі. Жасушадағы темір мөлшерінің азаюы кезінде рецепторлардың синтезделу жылдамдығы жоғарлайды және керісінше.
Ферритин протеині бауырда, көкбауырда, жілік майында темір депосы ролін атқарады.
Темірдің артық мөлшері бауыр және басқа да ұлпаларда гемосидерин грануласы құрамында аккумуляциаланады. Гемосидерин – бұл протеиннен, полисахаридтен және Ғе2+ -ден тұратын комплекс, суда нашар ериді және құрамында 3%-ға дейін темір болады.
Бауыр мен көкбауырдың ретикуло-эндотелиоциттеріндегі гемосидерин гранулаларының жинақталуы бұл мүшелердің қызметі бұзылуына (гемохроматоз) әкелуі мүмкін.
Темірдің жеткіліксіз түсуі немесе жұмсалуының бұзылысы кезінде теміржетіспеушілік анемия дамиды.
Медициналық маңызы
Гемоглобиннің қалыпты мөлшерінің мәндері: - ерлерде 130 - 160 г/л; - әйелдерде 120 – 140 г/л.
Гемоглобиннің концентрациясының жоғарлауы: полицитемия, дегитратация кезіндегі гемоконцентрация, күюде, ішек қаталауында, қатты құсуда; өте биікте болғанда, шамадан тыс физикалық жүктемеде немесе қоздырылғанда; жүрек-қантамырлары патологиясында, негізінен туабіткен; кейбір өкпе ауруларында, мет- және сульфогемоглобин түзілуін дамытатын нитрит, сульфониламидтердің созылмалы химиялық әсерінде болады. Гемоглобин концентрациясының жоғары болуы да - анемия.
ІҢ СУПЕРЖИЫНЫ. Қосымша 1.
Иммуноглобулиндердің супержиыны протеиндері ағзаның иммундық жүйесі жұмысында маңызды роль атқарады. Оған 3 протеиндер жиыны кіреді: - антиденелер (иммуноглобулиндер), Т-лимфоциттердің рецепторлары, гистосәйкестік комплексінің протеиндері.
Олардың бәрі де домен құрамды, гомологтық иммунотәрізді домендерден тұрады және ұқсас қызметтерді атқарады – қанда еріген, немесе, лимфа немесе жасушааралық сұйықта (антиденелер) немесе жасуша беткейінде болатын (өз немесе бөтен) бөтендік құрылымдармен әсерлеседі.
Антиденелер – бұл ағзаға бөтендік құрылымдардың (антигендердің) түскенінде қарсы жауап ретінде В-лимфоциттер арқылы өндірілетін спецификалық протеиндер.
Антиденелер құрылыстарының ерекшеліктері. – 1. Антиденелердің қарапайым молекулалары 4 полипептидтік тізбектен тұрады: 2 идентті жеңіл – L-тізбек (220 АҚ) және 2 идентті ауыр тізбек – Н (440-700 АҚ). Антиденелердің барлық 4 тізбектері бір бірімен көптеген ковалентсіз байланыстармен және 4 ковалентті байланыспен (дисульфидтік) қосылған. -2. Антиденелердің жеңіл тізбектері 2 доменнан: вариабельді (өзгермелі) (Vc) полипептид тізбегінің N-соңы аймағында және константты (тұрақты) (С1) С-соңында орналасқан. -3. Ауыр тізбектерде 4 домен болады: 1 вариабельді (өзгермелі) (Vc) полипептид тізбегінің N-соңы аймағында және константты (тұрақты) (СН1, СН2, СН3) С-соңында орналасқан (сур.5). -4. Иммуноглобулиндердің әрбір домендері β-қатпарлы супер құрылымда болады, олардағы цистеиннің 2 қалдығы дисульфидтік байланыспен қосылған. -5. Екі константты домендар (СН1, СН2) арасында көп мөлшердегі пролин қалдықтарынан тұратын аймақ болады. ол екінші реттік құрылым қалыптасуын және Н-тізбектердің бұл аймағында өзара әсерлесуін болдырмайды. Бұл шарнирлі аймақ антидене молекуласына иілгіштік қасиетте болуға мүмкіндік береді. -6. Ауыр және жеңіл тізбектердің вариабельдік аймақтары арасында 2 идентті антиген байланыстырушы аймақ болады. Сондықтан, олар жиі түрде бивалент деп аталады.
Антидененің антигенді байланыстыруына әрбір тізбектің гипервариабелді аймақта орналасқан 20-30-ға жуық аминоқышқылдар қатысады. Антидененің бұл аймақтары оның уникальді қабілетін - сәйкес антигенмен комплементарлы әсерлесуін қамтамассыз етеді немесе осы қасиетін айқындайды.
Антиденелер – бұл ағзаға енген бөтен ағза құрылымдарынан ағзаның қорғаныс жолдарының бірі. Олардың қызметін екі этапқа бөледі: -1-этап – антигенді тану және байланыстыру; -2- этап – үдерістің инициациялануы, нәтижесінде антиген инактивтеледі және ыдырайды. Екінші этаптың спецификалығы антиденелер классына тәуелді.
Ауыр тізбектердің 5 классы бар. Олар құрылысындағы константтық домендар құрылымы бойынша ерекшелінеді: - α, δ, ε, γ, μ – оларға сәйкес түрде иммуноглобулиндерді 5 классқа бөледі: IgА, IgD, IgE, IgG, IgM.
IgM. – олардың екі формасы кездеседі:
- 1. Мономерлік форма – антиденелердің бірінші классы, олар дамушы В-лимфоциттер арқылы өндіріледі. Ары қарай жетілген В-жасушалар басқа кластағы антиденелерді өндіреді, бірақ олардың бәріндегі антиген байланыстырушы аймақ бірдей құрылыста болады. IgM мембранаға орналасады да антиген танушы рецептор қызметін атқарады. Мебранаға орналасуы оның тізбектерінің соңдарында болатын 25 гидрофобты аминоқышқылдардың болуымен байланысты.
-2. Секреторлық форма – (пентамер) бір бірімен дисульфидтік байланыспен қосылған 5 түрлі мономерлік суббірліктер және қосымша полипептидтік Ј-тізбектің құрамында болуы арқылы ерекшелінеді. Бұл форманың ауыр тізбектерінің соңдарында гидрофобтық аминоқышқылдар болмайды. Пентамердің құрамында антигенмен байланысатын 10 байланыстырушы орталық болады. IgM-нің секреторлық формасы – бұл алғашқы иммундық жауап кезінде қанға секреттелетін антиденелердің негізгі классы.

Сурет 3.IgG-дің домендік құрылысы.
IgG. Иммуноглобулиндердің бұл классы қандағы мөлшері бойынша бәрінен басым (75%) болады. IgG – мономерлер, екінші иммундық жауап кезінде қанға секреттелетін антиденелердің негізгі классы. IgG микроағзалардың беткейлік антигендерімен әсерлескен соң антиген-антидене комплексі пайда болады, ол қабілетті: - комплемент жүйесі протеиндерін байланыстыруға және активтендіруге; - макрофагтар мен нейтрофилдердің спецификалық рецепторларымен әсерлесуге, бұл антиген-антидене комплексінің фагоцитозына әкеледі және фагосомада ыдыратады; - бұл плацентарлық кедергіден өте алатын және ұрықтың инфекциядан жатырішілік қорғанысын қамтамассыз ететін жалғыз иммуноглобулин классы.
IgА. Секреттер (сүт, слекей, тыныс алу жолы мен АІТ секреттері) құрамында құрамында басым болатын антиденелердің негізгі классы. IgА негізінен мономерлері қосымша Ј-пептид арқылы байланысқан димерлер түрінде секреттеледі. IgА комплемент жүйесімен де, фагоциттеуші жасушамен де әсерлеспейді, ол тек микроағзалармен байланысып, олардың эпителий жасушаларымен байланысуын және ағзаға өтуін болдырмайды.
IgE. Олардың құрылысы – мономер, құрамында ауыр тізбектер (ε-тізбек) және μ-тізбек, 1 вариабельді және 4 константты домен болады. IgE секреттелген соң тоық жасушалар (тучные клетки) мен базофилдердің беткейлеріндегі рецепторлармен С-соңдары арқылы байланысады. Нәтижесінде олар жасушалардың беткейлерінде антигендер үшін рецептор болады (сур.7).
Антигеннің IgE –нің антиген байланыстырушы бөлігімен байланысқан соң жасуша өзіне биоактивті заттарды (гистамин, серотонин) секреттеу туралы сигналды алады. Бұл биоактивті молекулалар басым түрде қабыну реакциясы дамуына және алллергиялық реакциялар (астма, сенная лихорадка, бөртпелер) байқалуларын дамытады.

Сурет 4. IgE –нің толық жасуша беткейіндегі антигенмен әсерлесуі
IgМ антигенмен байланысқан кезде оның конформациясы өзгереді және комплемент жүйесінің бірініші компонентімен байланысуын индукциялайды жәнеғ бұл жүйенің активтенуіне әкеледі. Егер антиген микроағзаның беткейінде орналасқан болса, онда комплемент жүйесі бактериялық жасуша мембранасының бүтіндігін зақымдап бұзады.

Сурет 5. IgА, IgD, IgE, IgG, IgM құрылысы
IgD. Қансарысуында аздаған мөлшерде анықталады. Мономер, құрамында 5 ауыр тізбекте 1 вариабельді және 3 константты домен болады. В-лимфоциттердің рецепторы ролін атқарады. Спецификалық антигендердің В-лимфоциттер бекейлеріндегі рецепторлармен әсерлесуі бұл сигналдарды жасушаға беріп олардағы лимфоциттер клондарын көбейтетін механизмнің іске қосылуын қамтамассыз етеді..






