ОCНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
КЛАСИФІКАЦІЯ НЕОРГАНІЧНИХ СПОЛУК
Прості речовини.
Молекули складені із атомів одного виду (атомів одного елемента). В хімічних реакціях не можуть розкладатися і утворювати другі речовини.
Складні речовини (або хімічні сполуки).
Молекули складені із атомів різного виду (атомів різних хімічних елементів). В хімічних реакціях розклдаются і утворюють декілька інших речовин.
| Неорганічні речовини | |
| Прості | Метали |
| Неметали | |
| Складні | Оксиди |
| Основи | |
| Кислоти | |
| Солі |
Чіткої границі між металами та неметалами немає тому, що є прості речовини, які виявляють двоякі властивості.
Алотропія
Алотропія - властивість деяких хімічних елементів утворювати декілька простих вечовин, які відмінні за своїми властивостями та будовою.
Речовини, що утворюються називають – алотропними видозмінами, або модифікаціями
С - алмаз, графіт, карбін.
O - кисень, озон.
S - ромбовидна, пластична.
P - білий, червоний, чорний.
Явище алотропії обумовлене двома причинами:
1) різним числом атомів в молекулі, наприклад кисень O2 та озон O3
2) утворенням різних кристалічних форм, наприклад алмаз, карбін і графіт.
ОСНОВИ
Основи - це складні речовини, в яких атоми металів з’єднані з одною або декількома гідроксильними группами (з точки зору теорії електролітичної дисоціації, основи - складні речовини, при дисоціації яких в водному розчині утворюютьсяя катіони металу (або NH4+) і гідроксид - аніони OH-).
Класификація.
Розчинні У воді (луги) і нерозчинні.
Амфотерні основи виявляють властивості слабких кислот.
Добування
1. Реакції активних металів (лужних та лужно-земельних металів) з водою:
2Na + 2H2O ® 2NaOH + H2
Ca + 2H2O ® Ca(OH)2 + H2
2. Взаємодія оксидів активних металів з водою:
BaO + H2O ® Ba(OH)2
3. Електроліз водних розчинів солей
2NaCl + 2H2O ® 2NaOH + H2 + Cl2
Хімічні властивості
| Луги | Нерозчинні основи |
| 1. Дія на індикатори | |
| лакмус - синій метилоранж - жовтий фенолфталеїн - малиновий | –– |
| 2. Взаємодія з кислотними оксидами. | |
| 2KOH + CO2 ® K2CO3 + H2O KOH + CO2 ® KHCO3 | –– |
| 3. Взаємодія з кислотами (реакція нейтралізації) | |
| NaOH + HNO3 ® NaNO3 + H2O | Cu(OH)2 + 2HCl ® CuCl2 + 2H2O |
| 4. Реакція обміну з солями | |
| Ba(OH)2 + K2SO4 ® 2KOH + BaSO4¯ 3KOH+Fe(NO3)3 ® Fe(OH)3¯ + 3KNO3 | –– |
| 5. Термічний розклад. | |
| –– | Cu(OH)2 –t°® CuO + H2O |
ОКСИДИ
Оксиди - складні речовини, які утворенні двома елементами, один із яких Оксиген
Класификація:
| ОКСИДИ | |
| Несолетворні | CO, N2O, NO |
| Солетворні | Основні-це оксиди металів, в яких метали виявляють невелику ступінь окислення +1, +2 Na2O; MgO; CuO |
| Амфотерні (металли ступінь окисления яких +3, +4). В качестве гидратов им соответствуют амфотерные гидроксиды ZnO; Al2O3; Cr2O3; SnO2 | |
| Кислотні - це оксиди неметалів і металів, ступінь окислення яких від +5 до +7 SO2; SO3; P2O5; Mn2O7; CrO3 | |
| Основним оксидам відповідають основи, кислотним– кислоти, амфотерним – і ті і другі |
Добування:
1. Взаємодія простих і складних речовин с киснем:
2Mg + O2 ® 2MgO
4P + 5O2 ® 2P2O5
S + O2 ® SO2
2CO + O2 ® 2CO2
2CuS + 3O2 ® 2CuO + 2SO2
CH4 + 2O2 ® CO2 + 2H2O
4NH3 + 5O2 –кат.® 4NO + 6H2O
2. Розклад деяких речовин, які містять кисень (основ, кислот, солей) при нагріванні:
Cu(OH)2 –t°® CuO + H2O
(CuOH)2CO3 –t°® 2CuO + CO2 + H2O
2Pb(NO3)2 –t°® 2PbO + 4NO2 + O2
2HMnO4 –t°;H2SO4(конц.)® Mn2O7 + H2O
Хімічні властивості
| Основні оксиди | Кислотні оксиди |
| 1. Взаємодія з водою | |
| Утворюється основа: Na2O + H2O ® 2NaOH CaO + H2O ® Ca(OH)2 | Утворюється кислота: SO3 + H2O ® H2SO4 P2O5 + 3H2O ® 2H3PO4 |
| 2. Взаємодія з кислотою або основою: | |
| В реакції с кислотою утворюється сіль та вода MgO + H2SO4 –t°® MgSO4 + H2O CuO + 2HCl –t°® CuCl2 + H2O | В реакції с основою утворюється сіль та вода CO2 + Ba(OH)2 ® BaCO3 + H2O SO2 + 2NaOH ® Na2SO3 + H2O |
| Амфотерні оксиди взаємодіють: | |
| з кислотами як основні: ZnO + H2SO4 ® ZnSO4 + H2O | с основами як кислотні: ZnO + 2NaOH ® Na2ZnO2 + H2O (ZnO + 2NaOH + H2O®Na2[Zn(OH)4]) |
| 3. Взаємодія основних і кислотних оксидів між собою - утворюється сіль. | |
| Na2O + CO2 ® Na2CO3 | |
| 4. Відновлення до простих речовин: | |
| 3CuO + 2NH3 ® 3Cu + N2 + 3H2O P2O5 + 5C ® 2P + 5CO |
КИСЛОТИ
Кислоти – складні речовини, які складаються із атомів водню та кислотного залишку. (З точки зору теорії електролітичної дисоціації: кислоти - електроліти, які при дисоціації в якості катіонів утворюють тільки H+).
Классификация:
1. За оксигеновмісністю:
безоксигенові та оксигеновмісні.
2. За числом атомів водню, які можуть заміщуватися на метал:
одно-, двох-, трьохосновні...
| безоксигенові: | Назва солі | |
| HCl - хлороводнева (соляна) | одноосновна | хлорид |
| HBr - бромоводнева | одноосновна | бромід |
| HI - йодоводнева | одноосновна | йодид |
| HF - фтороводнева | одноосновна | фторид |
| H2S - сірководнева | двохосновна | сульфид |
| оксигеновмісні: | ||
| HNO3 – нітратна (азотна) | одноосновна | нітрат |
| H2SO3 – сульфітна (сірчиста) | двохосновна | сульфіт |
| H2SO4 – сульфатна (сірчана) | двохосновна | сульфат |
| H2CO3 - карбонатна | двохосновна | карбонат |
| H2SiO3 - силікатна | двохосновна | силікат |
| H3PO4 - ортофосфорна | трьохосновна | ортофосфат |
Добування:
1. Взаємодія кислотного оксиду з водою (для оксигеновміснихкислот):
SO3 + H2O ® H2SO4
P2O5 + 3H2O ® 2H3PO4
2. Взаємодія водню с неметалами і подальшим розчиненням отриманого продукту в воді (для безоксигеновмісних кислот):
H2 + Cl2 ® 2HCl
H2 + S ® H2S
3. Реакція обміну солі с кислотой
Ba(NO3)2 + H2SO4 ® BaSO4¯ + 2HNO3
в тому числі, витіснення слабких, летучих або малорозчинних кислот із солей більш сильними кислотами:
Na2SiO3 + 2HCl ® H2SiO3¯ + 2NaCl
2NaCl(тв.) + H2SO4(конц.) –t°® Na2SO4 + 2HCl
Хімічні властивості
1. Дія на індикатори.
лакмус - червоний
метилоранж - рожевий
2. Взаємодія з основами (реакція нейтралізації):
H2SO4 + 2KOH ® K2SO4 + 2H2O
2HNO3 + Ca(OH)2 ®Ca(NO3)2 + 2H2O
3. Взаємодія з основними оксидами:
CuO + 2HNO3 –t°® Cu(NO3)2 + H2O
4. Взаємодія з металами:
Zn + 2HCl ® ZnCl2 + H2
2Al + 6HCl ® 2AlCl3 + 3H2
(метали, які стоять в витискувальному ряді металів до водню).
5. Взаємодія з солями (реакції обміну), при яких виділяється газ або утворюється осад:
H2SO4 + BaCl2 ® BaSO4¯ +2HCl
2HCl + K2CO3 ® 2KCl + H2O + CO2
СОЛІ
Солі – складні речовини, утворені атомами металів та кислотними залишками. Це самий багаточисельний клас неорганічних сполук.
Класифікація:
| СОЛІ | |
| ¨ Середні | |
| ¨ Кислі | |
| ¨ Основні | |
| ¨ Подвійні | |
| ¨ Змішані | |
| ¨ Комплексні |
Середні. При дисоціації дають лише катіони металу (або NH4+)
Na2SO4 «2Na+ +SO42-
CaCl2 «Ca2+ + 2Cl-
Кислі. При дисоціації дають катіони металу (NH4+), іони водню і аніони кислотного залишку.
NaHCO3 «Na+ + HCO3- «Na+ + H+ + CO32-
Основні. При дисоціації дають катіони металу, гідроксид – іони ОН- і аніони кислотного залишку.
Zn(OH)Cl «[Zn(OH)]+ + Cl- «Zn2+ + OH- + Cl-
Продукти неповного заміщення групи OH- відповідної основи на кислотний залишок.
Подвійні. При диссоціації дають два катіона та один аніон.
KAl(SO4)2 «K+ + Al3+ + 2SO42-
Змішані. Утворенні одним катіоном і двома аніонами:
CaOCl2 «Ca2+ + Cl- + OCl-
Комплексні. До складу входять складні катіони або аніони.
[Ag(NH3)2]Br «[Ag(NH3)2]+ + Br -
Na[Ag(CN)2] «Na+ + [Ag(CN)2]-
Середні солі
Добування
Більшість способів добування солей мають в основі взаємодію речовин з протилежними властивостями:
1) металу с неметалом:
2Na + Cl2 ® 2NaCl
2) металу з кислотою:
Zn + 2HCl ® ZnCl2 + H2
3) металу з розчином солі менш активного металу
Fe + CuSO4 ® FeSO4 + Cu
4) основного оксиду з кислотним оксидом:
MgO + CO2 ® MgCO3
5) основного оксиду з кислотою
CuO + H2SO4 –t°® CuSO4 + H2O
6) основи з кислотним оксидом
Ba(OH)2 + CO2 ® BaCO3¯ + H2O
7) основи з кислотою:
Ca(OH)2 + 2HCl ® CaCl2 + 2H2O
8) солі з кислотою:
MgCO3 + 2HCl ® MgCl2 + H2O + CO2
BaCl2 + H2SO4 ® BaSO4¯ + 2HCl
9) розчину основи з розчином солі:
Ba(OH)2 + Na2SO4 ® 2NaOH + BaSO4¯
10) розчинів двох солей
3CaCl2 + 2Na3PO4 ® Ca3(PO4)2¯ + 6NaCl
Хімічні властивості
1. Термічний розклад.
CaCO3 ® CaO + CO2
2Cu(NO3)2 ® 2CuO + 4NO2 + O2
NH4Cl ® NH3 + HCl
2. Гідроліз.
Al2S3 + 6H2O «2Al(OH)3¯ + 3H2S
FeCl3 + H2O «Fe(OH)Cl2 + HCl
Na2S + H2O «NaHS +NaOH
3. Реакції обміну з кислотами, основами та іншими солями.
AgNO3 + HCl ® AgCl¯ + HNO3
Fe(NO3)3 + 3NaOH ® Fe(OH)3¯ + 3NaNO3
CaCl2 + Na2SiO3 ® CaSiO3¯ + 2NaCl
4. Окисно-відновні реакції, обумовленні властивостями катіона або аніона.
2KMnO4 + 16HCl ® 2MnCl2 + 2KCl + 5Cl2 + 8H2O
ГЕНЕТИЧНИЙ ЗВ’ЯЗОК МІЖ РІЗНИМИ КЛАСАМИ СПОЛУК
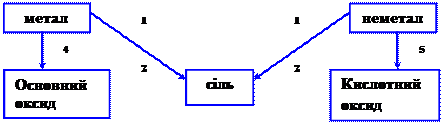 |




Приклади:
1. металл + неметал ® сіль
Hg + S ® HgS
2Al + 3I2 ® 2AlI3
2. основний оксид + кислотний оксид ® сіль
Li2O + CO2® Li2CO3
CaO + SiO2 ® CaSiO3
3. основа + кислота ® сіль
Cu(OH)2 + 2HCl ® CuCl2 + 2H2O
4. метал ® основний оксид
2Ca + O2 ® 2CaO
4Li + O2 ® 2Li2O
5. неметал ® кислотний оксид
S + O2 ® SO2
4As + 5O2 ® 2As2O5
6. основний оксид ® основа
BaO + H2O ® Ba(OH)2
Li2O + H2O ® 2LiOH
7. кислотний оксид ® кислота
P2O5 + 3H2O ® 2H3PO4
SO3 + H2O ® H2SO4






