Фенол и его производные обладают дезинфицирующим свойством.. Карболовая к-та – 3%-ный раствор фенола – для дезинфекции хирургических инструментов. В промышленности фенол используют для получения фенолоформальдегидных смол и ряда красителей.
Резорцин – используется при лечении кожных заболеваний в составе примочек или мазей.
Гидрохинон – в организме восстановительная способность замещенного гидрохинонового фрагмента делает его участником важного процесса транспоста электронов от окисляемого субстрата к кислороду.
Пирокатехин применяется для синтеза адреналина – гормона надпочечников. Адреналин является одним из важнейших регуляторов жизнедеятельности организма. Это первый гормон, который удалось получить синтетически.
Амины - Это производные аммиака NH3, где один, два или три атома Н замещены на радикал R (алифатический или ароматический).
Классификация
I. По количеству NH2 групп различают: моноамины, диамины:
СН3-СН2-NH2 NH2 – CH2 – CH2 – NH2
Этиламин Этилендиамин
II. В зависимости от числа атомов Н, замещенных на R, различают первичные, вторичные и третичные амины. NH2 – аминогруппа, –NH – иминогруппа.
СН3-СН2-NH2 – этиамин, первичный амин
СН3-СН2-NH - СН3-СН3 – диэтиламин, вторичный амин
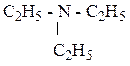 - триэтиламин, третичный амин
- триэтиламин, третичный амин
III. По характеру углеводородного радикала различают:
· алифатические СН3-СН2-NH2 - этиламин
· ароматические С6Н5NH2 – аминобензол, анилин
Номенклатура
Рациональная – название радикала (R) + «амин»:
СН3 – СН2– СН2– NН2 СН3 – NН– СН3
Пропиламин Диметиламин
МН рассматривает гр. –NH2 как заместитель в первичных аминах и ее название ставят в приставке перед названием основной цепи (корня):
 2-Аминопропан
2-Аминопропан
Изомерия
Для первичных аминов – изомерия углерод-углеродной цепи и положения гр. – NH2 (1, 2); для вторичных и третичных аминов – изомерия радикала - метамерия
1) СН3 – СН2– СН2– NН2 
Пропиламин Изопропиламин
2) СН3 – СН2– СН2– СН2– NН2 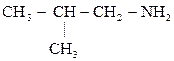
Бутиламин Изобутиламин
3) СН3 – СН2– СН2–NН–СН3 СН3 – СН2–NН – СН2–СН3
Метилпропиламин Диэтиламин
Физические свойства
Метиламин, диметиламин, триметиламин – газы, хорошо растворимые в воде; средние члены гомологического ряда аминов – жидкости, высшие – твердые вещ-ва.
Амины в заметных количествах образуются при гниении органических остатков, содержащих белки. Ряд аминов образуется в организме человека и животных из a-аминокислот под действием ферментов. Такие амины принято называть биогенными аминами, например, кадаверин и путресцин.
Строение молекулы амина
Связи N – H, C – N полярны, однако полярность NH связи больше, чем CN согласно различной ЭО атомов N, С, Н. Поэтому первичные и вторичные амины, подобно спиртам, склонны к образованию Н-связей.
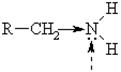
Нуклеофильный и оснóвный центры
В связи с меньшей полярностью связи С – N (0,45 D) по сравнению с полярностью N – Н (1,3 D) для аминов не характерны реакции замещения гр. NН2 – и кислотные свойства.
Важнейшее свойство аминов связано с наличием свободной электронной пары у атома N и его способностью присоединять «+» частицы. С этим связано проявление аминами свойств оснований, т.е. присоединять Н+ от воды и кислот, а также вступать в р-ции алкилирования, ацилирования, выполняя при этом роль Nu.
Химические свойства
I. Оснóвные свойства
Амины более сильные основания, чем NH3. Это объясняется + I эффектом радикалов. Чем больше электронная плотность на атоме N, тем больше основность. Вторичные амины более сильные основания, чем первичные. Основность третичных аминов уменьшается, что объясняется экранирующим влиянием атома N тремя алкильными группами.
Поскольку электроотрицательность атома N меньше электроотрицательности атома О, амины образуют менее прочные ассоциаты, чем соответствующие спирты и имеют более низкие температуры кипения. Температура кипения этанола 78 оС, а этиламина – 17 оС.
1. При растворении в воде к аминам присоединяется Н+ от молекулы НОН, поэтому растворы аминов имеют щелочную реакцию:
С2Н5  H2 + HOH ® [С2Н5
H2 + HOH ® [С2Н5  H3]OH-
H3]OH-
Гидроксидэтиламмония
2. При взаимодействии с кислотами образуются соли:
С2Н5  H2 + HС1 ® [С2Н5
H2 + HС1 ® [С2Н5  H3]Сl-
H3]Сl-
Хлоридэтиламмония
Щелочи разлагают соли аминов и выделяют свободные амины:
[С2Н5  H3]Сl- + NaOH ® NaCl + С2Н5NH2 + H2O
H3]Сl- + NaOH ® NaCl + С2Н5NH2 + H2O
Особенно сильные оснóвные свойства у чертвертичных аммониевых оснований, которые по силе соответствуют щелочам:

Оснóвные свойства ароматических аминов ослаблены за счет р,p-сопряжения NH2 – группы с бензольным кольцом. Поэтому анилин образует соли только с сильными минеральными к-тами. Водный р-р анилина не изменяет окраску индикаторов.
II. Реакции алкилирования и ацилирования
В этом случае амины проявляют нуклеофильные свойства за счет электронной пары атома азота.
1. Реакция алкилирования (замещение атомов водорода в гр. NH2 на углеводородный радикал, в результате чего образуется вторичный амин):
С2Н5NH2 + СН3CI → С2Н5NH-CH3 + HCI
метилэтиламин
2. Реакция ацилирования (замещение атомов водорода в гр. NH2 на ацильный радикал):

Подобным образом алкилируется и ацилируется С6Н5NH2.
С6Н5NH2 + СН3CI → С6Н5NH-CH3 + HCI (реакция алкилирования)
С6Н5NH2 + СН3 COCI → С2Н5NH-C-CH3 + HCI (реакция ацилирования)
║
О
III. Реакция с альдегидом с образованием основания Шиффа:
С2Н5 – NH2 + O = 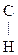 – СН3
– СН3 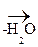 С2Н5 – N =
С2Н5 – N = 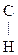 – СН3
– СН3
IV. Качественные реакции на амины (реакция с HNO2)
1) С2Н5 – NH2 + O = N – OH 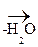 [С2Н5 – N= N – OH]
[С2Н5 – N= N – OH]  С2Н5OH
С2Н5OH
2) 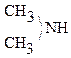 + HONO
+ HONO 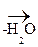
 -NO¯
-NO¯
Желтый Нитрозоамины
Нитрозоамины являются канцерогенными веществами. Нитраты в организме восстанавливаются до нитритов.
3) R3N: + НNO2 ® [R3NH]+NO2-
Соль
При действии HNO2 на соли анилина образуется не фенол, а соли диазония (широко используемые в химии красителей), которые при нагревании выделяют азот N2 с образованием фенола:
[С6Н5  H3]Cl- + HONO ® [С6Н5
H3]Cl- + HONO ® [С6Н5  ºN]Cl- + 2Н2О
ºN]Cl- + 2Н2О
Соль диазония
[С6Н5  ºN]Cl- + 2Н2О
ºN]Cl- + 2Н2О  N2 + HCl + С6Н5OH
N2 + HCl + С6Н5OH
V. Реакции по радикалу
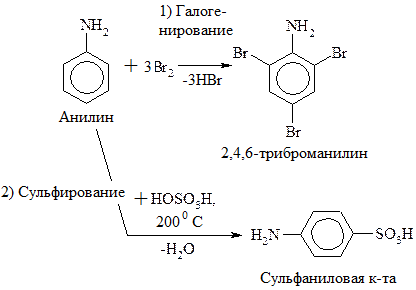
Сульфаниловая кислота – важный продукт в синтезе лекарственных веществ (сульфаниламидных препаратов) и красителей. Наибольшую активность имеют производные сульфаниламидов, в которых атом Н в группе – SO2NH2 замещен на гетероцикл. Например,
сульфадиметоксин: 
Сульфаниламиды, являясь антиметаболитами n-аминобензойной к-ты (ПАБК), блокируют биосинтез фолиевой к-ты (витамин Вс), необходимой для нормального развития и размножения микроорганизмов. Сульфаниламиды имеют сходные геометрические параметры с ПАБК, что позволяет им встраиваться вместо последней в синтез фолиевой к-ты.
Диамины.
Простейшим диамином является этилендиамин. Он образуется при аммонолизе 1,2-дихлорэтана.
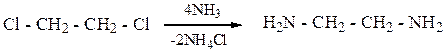
Тетраметилендиамин (путресцин) и пентаметилендиамин (кадаверин), образуются при декарбоксилировании диаминокислот и обусловливают ядовитость гниющих белков.
Аминоспирты
Это соединения, содержащие в молекуле одновременно гр. –NН2 и –ОН. Первый член гомологического ряда
 2-Аминоэтанол-1, моноэтаноламин, коламин
2-Аминоэтанол-1, моноэтаноламин, коламин
Коламин входит в состав сложных липидов. Производное коламина – димедрол – обладает противоаллергическим и слабым снотворным действием.
Коламин по гр. –NН2 проявляет свойства аминов и спиртов.
Р-ции, протекающие по –ОН гр: с Ме, РС15, НС1, R–C1, R–COC1; р-ции окисления и дегидратации.
1. Взаимодействие с активными металлами.

2. Взаимодействие с РCl5 и НСl (реакции SN)
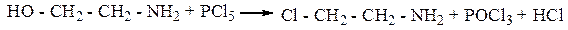

3. Взаимодействие с галогеналканами:

4. Взаимодействие с ангидридами кислот:
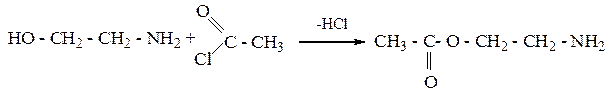 Реакции по NH2- группе.
Реакции по NH2- группе.
1. Взаимодействие с сильными кислотами приводит к образованию устойчивых солей.
 гидрохлорид 2- аминоэтанола
гидрохлорид 2- аминоэтанола
2. Взаимодействие с водой.

3. Взаимодействие с ангидридами кислот.

4. В реакции алкилирования коламин образует метилированное производное по типу четвртичного аммониевого основания – холин – триметилоксиэтилгидроксид аммония:

В организме донором метильных групп является аминок-та метионин 
Холин является составной частью фосфолипидов. Особенно его много в нервных тканях, мозге, печени, мышцах сердца, почках. Сложный эфир холина и уксусной кислоты – ацетилхолин, является посредником при передаче нервного импульса в тканях организма.
 в организме образуется при ацетилировании холина с помощью ацетилкофермента А.
в организме образуется при ацетилировании холина с помощью ацетилкофермента А.
Вопросы для самоконтроля:
1. Классификация спиртов.
2. Виды изомерии спиртов.
3. Номенклатура спиртов
4. Физические свойства спиртов. Водородная связь.
5. Электронное строение спиртов.
6. Химические свойства спиртов.
7. Механизмы реакции нуклеофильного замещения SN1 и SN2.
8. Механизм реакции элиминирования
9. Применение спиртов
10. Классификация фенолов.
11. Номенклатура и изомерия.
12. Строение фенола, взаимное влияние бензольного кольца и гидроксильной группы.
13. Физические свойства.
14. Химические свойства фенола.
15. Фенол. Резорцин. Гидрохинон. Пирокатехин. Применение в медицине. Фенолы как антиоксиданты.
16. Какие вещества называются аминами.
17. Классификация аминов.
18. Виды изомерии аминов..
19. Номенклатура аминов.
20. Физические свойства аминов
21. Электронное строение аминов.
22. Какие из алифатических аминов проявляют более выраженные основные свойства и почему?
23. Химические свойства аминов.
24. Докажите, что анилин является сопряженной системой.
25. Какие эффекты проявляет группа NH2 в анилине?
26. Строение этилендиамина.
27. Строение коламина. Как влияют функциональные группы в коламине друг на друга.
28. Строение холина и ацетилхолина.
Упражнения
1. Изобразите строение молекулы этилового спирта. Укажите четыре реакционных центра.
2. Напишите реакцию, доказывающую кислотные свойства пропанола.
3. Напишите реакцию этерификации бутанола-1 с уксусной кислотой.
4. Сравните кислотные свойства этанола и этадиола и напишите соответствующие реакции.
5. Напишите качественную реакцию на многоатомные спирты.
6. В присутствии серной кислоты и при нагревании этиловый спирт претерпевает внутримолекулярную дегидратацию. Укажите механизм и напишите реакцию.
7. Напишите реакцию окисления пропанола-2.
8. Напишите реакцию взаимодействия бутанола с хлороводородом. Укажите механизм реакции и назовите продукты.
9. Напишите реакцию образования простого эфира из пропанола-1 и пропанола-2.
10. Нитроглицерин в спиртовом растворе применяется при стенокардии в качестве сосудорасширяющего средства, напишите реакцию его образования.
11. Напишите реакции фенола с хлорангидридом уксусной кислоты.
12. Напишите качественную реакцию на фенол.
13. Напишите реакции фенола с бромом и азотной кислотой.
14. Напишите реакцию окисления диоксибензола.
15. Напишите реакцию взаимодействия фенола с гидроксидом натрия и объясните, почему фенол реагирует сщелочами, а одноатомные спирты нет.
16. Салициловая кислота частично выделяется из организма почками и оказывает некоторое дезинфицирующее влияние в мочевых путях. Напишите реации образования её из фенола.
17. Пикриновая кислота входит в состав взрывчатых веществ. Напишите реакцию её образования.
18. Напишите все изомеры формулы С4H11N. Назовите их по м.н.
19. Напишите реакции взаимодействия этиламина с HNO3, CH3Cl.
20. Напишите реакции взаимодействия анилина Br2, HO-NO2, HO-SO3H
21. Какое из соединений: метиламин или анилин проявляет более выраженные основные свойства. Напишите соответствующие реакции.
22. Напишите качественную реакцию на первичные, вторичные и третичные амины.
23. Напишите уравнение реакции взаимодействия анилина с ангидридом уксусной кислоты. Укажите механизм реакции.
24. Коламин – проявляет амфотерные свойства. Докажите эти свойства соответствующими реакциями.
25. Холин – структурный элемент сложных липидов. Он способен предотвращать ожирение печени и удаляет уже отложенный жир из печени. Напишите реакцию его образования.
26. Ацетилхолин – сложный эфир холина и уксусной кислоты, участвует при передаче нервного возбуждения в нервных тканях, т. е. является нейромедиатором. Напишите реакцию его образования.
Лабораторная работа
“Свойства спиртов, фенолов”
Опыт 1 Получение глицерата меди (II)
В пробирку внесите 2-3 капли раствора сульфата меди (II) и 2 капли раствора гидроксида натрия. Что наблюдаете? К полученному осадку гидроксида меди (II) добавьте 4 капли глицерина и встряхните пробирку. Что наблюдаете? Напишите соответствующую реакцию.
Для каких спиртов эта реакция является качественной?
Опыт 2 Образование фенолята натрия и разложение его кислотой
В пробирку с 5 каплями воды поместите кристаллик фенола и встряхните. К образовавшейся мутной эмульсии добавьте по каплям р-р гидроксида натрия до получения прозрачного р-ра. Добавьте к этому р-ру несколько капель соляной кислоты. Что наблюдаете?
Напишите реакцию фенола с гидроксидом натрия. Какие свойства проявляет фенол в этой реакции? Почему фенолят натрия не разлагается водой?
Опыт 3 Качественная реакция на фенол
В пробирку внесите 6 капель прозрачного водного раствора фенола и 1 каплю раствора хлорида железа (III) FeCI3. Что наблюдаете? Напишите соответствующую реакцию.






