ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО РЫБОЛОВСТВУ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ
"АСТРАХАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ"
ИНСТИТУТ НЕФТИ И ГАЗА
КАФЕДРА "ОБЩАЯ, НЕОРГАНИЧЕСКАЯ И АНАЛИТИЧЕСКАЯ ХИМИЯ"

ОСНОВЫ
ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
И БИОЭНЕРГЕТИКИ
Учебное пособие
По общей химии
Астрахань
УДК 540
ББК
Р98
Основы химической термодинамики и биоэнергетики: учебно-метод. пособие по общей химии / Рябухин Ю.И. – Астрахань: Астрахан. гос. техн. ун-т, 2016. – с.
Химическая термодинамика изучает макроскопические физико-химические системы (газообразные, жидкие и твёрдые вещества, растворы и др.) и процессы (химические реакции, фазовые превращения и др.) на основе законов взаимопревращения теплоты, различных видов работы и энергии.
Печатается по решению
Табл. 1, рис. 4, библиогр.: назв., приложение 1.
Печатается по решению кафедры "Общая, неорганическая и аналитическая химия" (протокол № от июня 2016).
Рецензент: канд. техн. наук, доцент И.И. Шавель
Набор и вёрстка:
© Рябухин Ю.И., 2016
1. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ
Термодинамика изучает законы, которые описывают энергетические превращения, сопровождающие физические, химические и биологические процессы.
Переходы энергии из одной формы в другую, энергетические эффекты, сопровождающие различные химические реакции, а также условия самопроизвольного протекания процессов и пределы их протекания в данных условиях – всё это является предметом изучения науки, называемой химической термодинамикой.
Одним из основных понятий в термодинамике является физико-химическая система (или просто система) [*] – тело или группа взаимодействующих тел, фактически или мысленно выделяемых из окружающей среды.
Гомогенная система – однородная система, в которой нет частей, различающихся по свойствам и разделённых поверхностями (границами) раздела. Например, воздух, вода, истинные растворы.
Гетерогенная система – разнородная система, состоящая из двух или более частей, отличающихся по свойствам, между которыми есть поверхность раздела, где свойства системы резко меняются (скачком). Например, молоко, кровь, смеси воды и льда, воды и масла.
Ч асть гетерогенной системы, которая имеет одинаковые свойства и отделённая поверхностью раздела, называется фазой. Например, в молоке имеются три фазы: водная (жидкая) фаза – раствор солей, углеводов, белков и других веществ, в которой распределены две другие фазы: мельчайшие капельки жидких жиров и мельчайшие частички твёрдых жиров, (твердая фаза).
Живые системы, существующие на Земле, — гетерогенны. Они всегда отделены от окружающей среды оболочкой, кроме того, внутри каждой живой клетки имеется множество различных мембран – границ между её частями.
В зависимости от характера взаимодействия с окружающей средой различают системы изолированные, закрытые (замкнутые) и открытые.
Изолированная система характеризуется отсутствием обмена энергией и веществом с окружающей средой. Например, термос.
Закрытая система обменивается с окружающей средой энергией, а обмен веществом исключён. Например, закупоренная бутылка, попеременно помещаемая в горячую и холодную воду, будет получать и отдавать энергию, но масса содержимого бутылки будет оставаться постоянной.
Открытая система обменивается с окружающей средой энергией и веществом. Например, кипящая в кастрюле вода получает энергию от плиты, а при испарении теряет часть своей энергии и массы.
Живой организм представляет собой открытую систему, жизнедеятельность которой невозможна без постоянного обмена веществом, и энергией с окружающей средой. Абсолютно изолированных систем в природе нет.
В термодинамике принято различать три состояния системы: равновесное, стационарное и переходное.
Термодинамически равновесное состояние системы характеризуется постоянством свойств во времени в любой её точке и отсутствием потоков вещества и энергии.
Термодинамически равновесное состояние системы — это прежде всего устойчивое состояние системы. Для выведения системы из этого состояния необходим обмен энергией или веществом между системой и окружающей средой. Важно различать состояния термодинамического равновесия и химического равновесия; последнее всегда имеет динамический характер, так как достигается в результате выравнивания скоростей обратимых процессов.
Стационарное состояние системы характеризуется постоянством свойств во времени, которое поддерживается за счёт непрерывного обмена веществом и энергией между системой и окружающей средой.
Для живого организма характерно стационарное состояние, а не равновесное, означающее для него смерть, так как прекращаются потоки вещества, энергии и информации между окружающей средой и организмом, обеспечивающие его жизнедеятельность.
Когда система переходит из одного (равновесного или стационарного) состояния в другое, то она находится в переходном состоянии.
Переходное состояние характеризуется изменением свойств системы во времени.
Состояние системы характеризуется определённой совокупностью физических и химических величин – параметров системы, к которым относятся: масса (m), количество вещества (n), объём (V), температура (Т), давление (р), концентрация (с). Значение параметра можно измерить непосредственно.
Параметры системы разделяют на экстенсивные и интенсивные.
Значения экстенсивных параметров пропорциональны числу частиц в системе (m, n, V).
Значения и нтенсивных параметров не зависят от числа частиц в системе (T, p, c).
Различие экстенсивных и интенсивных параметров чётко проявляется при взаимодействии систем: значения экстенсивных параметров суммируются, а интенсивных – усредняются.
Для характеристики состояния системы, наряду с параметрами, используют функции состояния. Их значения рассчитывают по соответствующим математическим формулам, исходя из значений параметров, описывающих данное состояние системы. Функцией состояния системы, например, является энергия.
Функции состояния системы - экстенсивные величины.
Значения параметров и функций состояния системы определяются только состоянием системы. Поэтому при переходе системы из одного состояния в другое изменения (Δ) этих величин не зависят от пути перехода, а определяется лишь начальным и конечным состояниями системы, то есть их значениями в этих состояниях.
Δ = 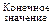
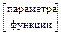 –
– 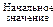
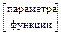
Переход системы из одного состояния в другое, сопровождающийся необратимым или обратимым изменением хотя бы одного параметра, характеризующего данную систему, называется процессом.
В отличие от состояния системы, которое характеризуется значениям и существующих параметров или функции, характеристикой процесса является их изменение, то есть значение Δ.
Процессы, в зависимости от изменения параметров системы, разделяют на изотермические, изобарические, изохорические:
изотермический процесс Т = const, DТ = 0;
изобарический процесс р = const, Dр = 0;
изохорический процесс V = const, DV = 0.
Жизнедеятельность человека протекает при постоянстве температуры и давления, то есть при изобарно-изотермических условиях (р, Т = const).
Для описания движения материи в живых организмах, по мнению В.И. Слесарёва, необходимо знать значения трёх функций состояния: энергии, энтропии и информации.
Энергия (Е) – количественная мера интенсивности различных форм перемещения и взаимодействия частей в системы, включая перемещение системы в целом и её взаимодействие с окружающей средой. Единица энергии – кДж/моль
В зависимости от формы движения материи различают тепловую, электрическую, химическую, ядерную и другие виды энергии. Термодинамика рассматривает превращение тепловой энергии в другие виды энергии – механическую, химическую, электрическую и т. д.
Движение материи включает перемещение частей системы, которое характеризуется кинетической энергией (Екин), и взаимодействие частей системы, которое характеризуется потенциальной энергией (Епот).
Энергетическое состояние системы описывается такой функцией состояния, как внутренняя энергия.
Внутренняя энергия (U) представляет собой полную энергию системы, которая равна сумме потенциальной и кинетической энергии частей данной системы, в том числе на молекулярном, атомарном и субатомарном уровнях:
U = Екин + Епот.
Внутренняя энергия не включает потенциальную энергию, обусловленную положением системы в пространстве, и кинетическую энергию движения системы в целом.
Внутренняя кинетическая энергия обусловлена тепловым хаотическим движением химических частиц (атомов,молекул,) = что непосредственно связано с температурой – с увеличением интенсивности этого движения температура тела возрастает.
Внутренняя потенциальная энергия системы обусловлена взаимодействием химических частиц друг с другом.
Значение внутренней энергии определить невозможно, так как любая термодинамическая система материальна, а материя неисчерпаема. Экспериментально можно определить изменение внутренней энергии (DU) при взаимодействии системы с окружающей средой, если обмен энергией осуществляеться в виде работы и теплоты.
Работа (А) – энергетическая мера направленных форм движения частей системы в процессе её взаимодействия системы с окружающей средой.
Работа в термодинамике считается положительной (А > 0), когда она совершается системой против внешних сил окружающей среды, при этом внутренняя энергия системы уменьшается (∆U < 0).
Теплота (Q) – энергетическая мера хаотических форм движения частей системы в процессе её взаимодействия системы с окружающей средой.
В термодинамике теплота считается положительной (Q > 0), если она сообщается системе из окружающей среды, при этом внутренняя энергия системы увеличивается (∆U > 0).
Работа и теплота не являются свойствами системы, а характеризуют процесс обмена энергией системы с окружающей средой, поэтому их величины зависят от пути процесса, по которому система переходит из одного состояния в другое.
Термины " работа " и " теплота " означают как сам процесс передачи энергии, так и величину передаваемой при этом энергии.
Для характеристики движения частей системы в термодинамике, наряду с энергией, используется ещё одна функция состояния – энтропия.
Энтропия (S) – термодинамическая функция, характеризующая меру неупорядоченности системы, то есть неоднородности расположения и движения её частей.
Изменение энтропии системы в условиях термодинамически обратимого процесса равно отношению передаваемой теплоты к температуре, при которой осуществляется этот процесс:
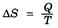
Единица энтропии – Дж/(моль∙К).
Факторы, влияющие на величину энтропии, описаны в разд. 3.
Энтропия является экстенсивным свойством системы, поэтому её изменение в результате какого-либо процесса равно разности энтропий конечного и начального состояний системы, независимо от пути процесса:
D S = S кон – S нач.
Движение материи невозможно описать без таких термодинамических характеристик, как энергия и энтропия. Если энергия количественно характеризует интенсивность движения и взаимодействия частей системы, то энтропия – мера неупорядоченности системы, то есть расположения и движения её частей. Изменение энтропии при превращения энергии из одного вида в другой характеризует величину рассеяния энергии при этом процессе. Чем больше DS, тем меньше коэффициент полезного действия (КПД) процесса. Именно этим объясняется низкий КПД (~ 40 %) при превращении тепловой энергии в электрическую. В то же время в гальваническом элементе, где химическая энергия окислительно-восстановительной реакции превращается в электрическую, КПД может достигать 98 %. В первом случае хаотическое движение частей системы необходимо превратить в направленное, при этом происходит сильное изменение энтропии. Во втором случае направленное движение электронов и ионов, сопровождающее химическую реакцию, превращается в направленное движение заряженных частиц, то есть упорядоченность движения частиц сохраняется, и поэтому изменение энтропии незначительно, а следовательно, и рассеяние энергии незначительно.
Для полной характеристики движения частей системы наряду с энергией и энтропией вводится такая функция состояния системы, как информация.
Информация (I О.Ш) – мера организованности системы, то есть упорядоченности расположения и движения её частей.
Информация выражается в битах, причём 1 бит информации эквивалентен 10–23 Дж/К, то есть является очень малой величиной.
Энтропия и информация являются статистическими характеристиками движения, описывающими его с противоположных сторон.
Для самоорганизующихся систем наряду с законами сохранения массы, электрического заряда, энергии (разд. 2 ) выполняется ещё закон сохранения:
I + S = const.
При этом, обе величины измеряются в одинаковых единицах, а значение их суммы зависит от типа системы. Это соотношение означает, что энтропия есть мера недостатка информации. При возрастании I убывает S и наоборот. Физический смысл этого закона: за полученную информацию система платит уменьшением энтропии, поэтому получение системой любой информации всегда связано с возрастанием энтропии в окружающей среде. Живые организмы – это высокоупорядоченные системы, содержащие колоссальное количество информации и, соответственно, обеднённые энтропией. Понятие "информация системы" тесно связано со структурой системы, поэтому целесообразно для характеристики соответствующих систем (нуклеиновые кислоты, белки, водные растворы) использовать термин "структурно-информационные свойства".
2. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Первый закон (первое начало) термодинамики – это всеобщий закон природы – закон сохранения и превращения энергии, соответствующий основному положению диалектического материализма о вечности и неуничтожимости движения.
Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в эквивалентных соотношениях.
Впервые этот закон в 1842 г. сформулировал немецкий физик Ю. Мейер, врач по образованию.
В зависимости от типа системы I закон термодинамики имеет различные формулировки.
В изолированной системе её внутренняя энергия постоянна (∆U = 0).
Для закрытой системы I закон – термодинамики устанавливает связь между теплотой, получаемой или выделяемой системой в некотором процессе, изменением её внутренней энергии и произведённой при этом работой.
Если к закрытой системе подвести теплоту Q, то она расходуется на увеличение внутренней энергии этой системы DU и на совершение ею работы против внешних сил окружающей среды:
Q= DU + А.
В изобарно-изотермических условиях, в которых функционируют живые организмы, совершаемая работа А = pDV, тогда:
Q = DU + pDV = (Uкон - Uнач) + (pVкон - pVнач) =
= (Uкон + pVкон) – (Uнач + pVнач)
Сумму внутренней энергии системы и произведения объёма на давление (U + pV) называют теплосодержанием, или энтальпией системы*.
Энтальпия (Н) – термодинамическая функция, характеризующая энергетическое состояние системы при изобарно-изотермических условиях.
Раздел химии, занимающийся изучением тепловых эффектов химических реакций, называется термохимией.
Теплота, полученная системой при р, Т = const, равна приращению энтальпии системы D Н:
Q = H кон – Н нач = D Н.
Величину энтальпии системы, как и абсолютную величину её внутренней энергии системы, определить невозможно, поэтому в термодинамических расчётах используется лишь изменение энтальпии, происходящее при переходе системы из одного состояния в другое. Величина DН системы не зависит от пути процесса, а определяется, как и для любой другой функции состояния, разностью энтальпий, характеризующих конечное и начальное состояния системы:
D Н = H кон – Н нач.
Количество теплоты, которое выделяется или поглощается при прохождении химической реакции в изобарно-изотермических условиях, характеризуется изменением энтальпии системы и называется энтальпией реакции (D Н р).
Химические процессы (химические реакции) и физико-химические процессы подразделяются на экзотермические и эндотермические.
Экзотермические процессы сопровождаются выделением энергии из системы в окружающую среду.
В результате экзотермических процессов энтальпия системы уменьшается (Н кон < H нач), следовательно:
D Н экзо = (Н кон - H нач ) < 0.
Эндотермические процессы сопровождаются поглощением энергии системой из окружающей среды.
В результате эндотермических процессов энтальпия системы увеличивается (Hкон > Hнач), следовательно:
D Н эндо = (Н кон - H нач ) > 0.
Энтальпия системы является, как и другие функции системы экстенсивной функций и зависит от количества вещества, температуры и давления, поэтому изменение энтальпии в результате химической реакции физико-химических процессов определяется при стандартных условиях.
Стандартные условия: количество вещества - 1 моль;
давление - 760 мм рт. ст. 101 325 Па (1 физическая атмосфера,или 760 мм рт.ст.)
температура - 298 К или 25 °С.
Термодинамические параметры и функции состояния системы и их изменения, определённые измеренные при стандартных условиях, обозначаются соответствующим символом с верхним индексом "°". Стандартную энтальпию реакции обозначают 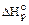 , кДж/моль.
, кДж/моль.
Стандартная энтальпия химической реакции представляет собой энергетическую характеристику реакции, проводимой при стандартных условиях. Уравнения химических реакций, в которых указано значение энтальпии, называются термохимическими уравнениями. Например, для реакции окисления процесса сгорания 1 моль ацетилена:
С2Н2(г) + 2,5О2(г) = 2СО2(г) + Н2О(г); = - 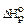 1256 кДж/моль.
1256 кДж/моль.
Кроме теплового эффекта в термохимических уравнениях указывают индексы, обозначающие агрегатные состояния реагирующих веществ. Стехиометрические коэффициенты могут иметь дробные; это связано с тем, что тепловой эффект реакции рассчитывается на 1 моль продукта реакции или на 1 моль одного из реагирующих веществ.
Для оценки энергетического состояния веществ используются значения их стандартных энтальпий образования, обозначаемые ∆ Н °[вещество (агрегатное состояние)], кДж/моль.
Стандартная энтальпия образования простых веществ в их наиболее термодинамически устойчивом агрегатном и аллотропном состоянии при стандартных условиях принимается равной нулю.
Например, для кислорода D Н о (О2) = 0, для графита 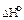 (Сграфит) = 0. Однако стандартная энтальпия образования озона DHо (О3) = 142,2 кДж/моль, алмаза D Н о (Салмаз) = 1,8 кДж/моль.
(Сграфит) = 0. Однако стандартная энтальпия образования озона DHо (О3) = 142,2 кДж/моль, алмаза D Н о (Салмаз) = 1,8 кДж/моль.
Стандартная энтальпия образования сложного вещества равна энтальпии реакции получения 1 моль этого вещества из простых веществ при стандартных условиях.
Например, стандартная энтальпия образования этанола равна стандартной энтальпии гипотетической реакции:
2Сграфит + 3Н2(г) + 0,5О2 (г) = С2Н5ОН(ж);
D Н о (С2Н5ОН) = -277 кДж/моль.
Значение стандартной энтальпии образования сложного вещества зависит от его природы и агрегатного состояния. Числовые значения стандартных энтальпий образования веществ приводятся в справочниках.
Энтальпию химической реакции можно определить как экспериментально, так и методами расчёта с использованием стандартных энтальпий образования реагирующих веществ веществ, в химической, на основе закона, открытого Г. И. Гессом (1840 г.).






