Общая формула: С n H 2n+2 O m где обычно m = 1…3.
Предельные одноатомные спирты (одна гидроксильная группа – ОН) имеют общую формулу С n H 2n+2 O или С n H 2n+1 OH.
Гликоли – двухатомные спирты (две гидроксильных группы – ОН) С n H 2n+2 O 2 или С n H 2n(OH)2. Производные глицерина имеют общую формулу С n H 2n+2 O 2.
Непредельные спирты встречаются редко и здесь не рассматриваются.
Ароматические спирты – фенолы - обладают особыми свойствами и будут обсуждаться в следующей главе.
Номенклатура:
1) рациональная; (название радикала с окончанием - овый с добавлением слова спирт)

2) систематическая: название углеводорода с окончанием – ол (диол, триол)

3) для одноатомных предельных спиртов нумерация атмов углерода начинается с того края, где ближе гидроксильная группа, с указанием ее местоположения:
 CH3 – CH2 – CH - CH2 - CH2 – CH3 гексанол - 3
CH3 – CH2 – CH - CH2 - CH2 – CH3 гексанол - 3
ОН


 СН2 – СН - СН2 глицерин
СН2 – СН - СН2 глицерин
ОН ОН ОН

Изомерия:
1) углеводородной цепи;
2) по положению гидроксогруппы или взаимному расположению нескольких гидроксогрупп;
3) межклассовая изомерия с простыми эфирами.
Строение. Спирты – это органические соединения, включающие одну или нескольких гидроксильных групп (ОН-), соединенных с углеводородным радикалом. В молекулах спиртов атомы углерода находятся в состоянии sp3 – гибридизации. Молекула спирта полярна, благодаря присутствию высокоотрицательного атома кислорода.
Физические свойства: до С = 15 - жидкости; С ≥ 16 – твердые вещества. С1 и С2 = спирты смешиваются с водой в любых соотношениях. Температуры кипения спиртов выше, чем у соответствующих углеводородов из – за присутствия водородных связей.
Гликоли и гомологи глицерина – вязкие жидкости, сладкие на вкус, хорошо растворимые в воде. Гликоли кипят при более высокой температуре и имеют большую плотность, чем соответствующие (с тем же числом углеродных атомов) им одноатомные спирты.
Получение:
1) промышленный способ получения одноатомных предельных спиртов – каталитической гидратацией алкенов. Катализаторы – концентрированная H2SO4 и Al2O3 при высоких температурах:

2) щелочным гидролизом моно- и полигалогенопроизводных алканов:
а) одноатомные CnH2n + H 2 O → C n H 2n+1 OH
б) многоатомные
CH 2 Cl – CH 2 Cl + 2 H 2 O → CH 2 OH – CH 2 OH + 2 HCl
3) гидролизом сложных эфиров органических кислот

4) для одноатомных спиртов – восстановлением карбонильных соединений. При Na в водном или водноспиртовом растворе; каталитическое восстановление водородом (Pt, Pd, Ni)


5) специфическими способами:
а) метанол из синтез – газа 
б) этанол – спиртовым брожением глюкозы

Химические свойства.
1. Общие для одноатомных и многоатомных спиртов:
а) горение 
б) с металлами (спирты – очень слабые кислоты за счет атома ггидроксогруппы):
CnH2n+1OH + 2Na → H2 + 2CnH2n+1ONa
в) реакция этерификации с органическими и минеральными кислотами (катализатор – концентрированная H2SO4)

CH3OH + HOSO2OH → CH3OSO2OH + H2O
г) дегидратация для одноатомных спиртов с получением алкенов или простых эфиров (катализаторы – концентрированная H2SO4 или Al2O3), 

д) окисление первичных одноатомных спиртов в альдегиды и втричных – в кетоны


2. Качественные реакции:
а) на одноатомные спирты – с оксидом меди (II) при нагревании (образуется оранжевый порошок меди):

б) на многоатомные спирты – со свежеприготовленным раствором гидроксида меди (II) - Cu(OH)2. Образуется раствор синего цвета:

Задачи
26. Для стабилизации формалина при хранении, в него добавляют предельный одноатомный спирт, в котором из 800 г 300 г составляет углерод. Определите формулу и название спирта. Тип № 4.
Решение. Общая формула предельных одноатомных спиртов C n H 2nO.
Пусть число молей спирта будет х. Тогда выразим значение n через уравнения
масса спирта (г) m = x (12 n + 2 n + 2 + 16) = 800
масса углерода (г) m (C) = 12 nx = 300
Разделим первое уравнение на второе: (14n + 18)/12 n = 2,667
14 n + 18 = 32 n; n = 1
Ответ: метанол CH3OH.
27. Вычислите молярную и процентную концентрацию технического этанола, если он получен из 100 л этилена, растворенного в 10 л воды при температуре 25 0С и нормальном давлении, выход реакции 78 % по массе. Тип № 2.
Решение.
Реакция получения этанола: 
По уравнению Менделеева–Клайперона: pV1 = nRT1; pV2 = nRT2
V1 = 22,4 л/моль; Т1 = 273 К; Т2 = 298 К.
Пусть количество вещества газа – 1 моль. Объем пропорционален температуре. Выразим объем газа при 298 К. Следовательно,

Найдем число молей этилена и его концентрацию: n (C2H4) = 100/24,45 = 4,1 моль;  .
.
С учетом 78 % - ного выхода реакции: С (C2H4) = 0,41/0,78 = 5,24 моль/л; m (C2H4) = 5,24 ∙ 28 = 146,72 г.
Ответ: С (C2H4) = 5,24 моль/л; m (C2H4) = 146,72 г.
28. Одно из веществ, используемых при хирургических операциях в XIX в., было обозначено П. Бертло - С4Н4(О2Н2); Ю. Либихом – (С4Н15)О, Н2О), Ж. Дюма – (С4Н8 + Н2О2). Кто из этих ученых был ближе к истине, если при дегидратации 4,6 г этого вещества образуется 3,13 л водяных паров при 100 0С и углеводород – алкен с массовой долей углерода в нем 85,7 %? Тип № 3.
Решение. Общая формула алкена С n H 2n.
Предположим, что в алкене четыре атома углерода, тогда это бутен - С4Н8.
Молярная масса бутена М (С4Н8) = 56 г/моль; масса углерода m (C) = 48 г. Массовая доля углерода в алкене составит:

Тогда можно предположить формулу спирта С4Н10О2 , т.е.

Реакция первичной дегидратации спирта
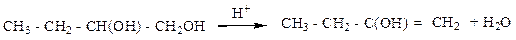
Молярная масса спирта: M (С4Н10О2) = 48 + 10 + 32 = 90 г/моль.
Найдем количество вещества спирта: n (С4Н10О2) = 4,6/90 = 0,051 моль;
Количество вещества воды будет  0,1 моль, так как в конце реакций дегидратации образуются 2 молекулы воды.
0,1 моль, так как в конце реакций дегидратации образуются 2 молекулы воды.
Из уравнения Менделеева – Клайперона: pV = nRT; найдем объем водяных паров:

Ответ: Ближе всех был Ж.Дюма.
29. Известно, что сердечное средство нитрогилицерин первым получил А. Себеро в артиллерийской академии г.Турина, но скрыл изобретение и не рекомендовал его использовать в военных целях. В чем он видел опасность нитроглицерина? Какое количество этого вещества было получено впервые ученым из 100 г глицерина и раствора, содержащего 250 г азотной кислоты? Тип № 8.
Решение. Реакция получения тринитроглицерина

Тринитроглицерин – взрывчатое вещество.
Молярная масса глицерина М (С3Н9О3) = 36 + 9 + 48 = 93 г/моль; найдем число молей глицерина: n (глиц.) = 100/93 = 1,08 моль.
Молярная масса азотной кислоты М (HNO3) = 63 г/моль; найдем n (HNO3) = 250/63 = 3,97 моль – HNO3 в избытке.
Рассчитаем массу тринитроглицерина по количеству вещества глицерина (недостаток).
Молярная масса тринитроглицерина М (С3Н5О9N3) = 36 + 5 + 16 ∙ 9 + 14 ∙ 3 = 227 г/моль; из стехиометрических коэффициентов следует, что n (тринитроглиц.) = 1,08 моль. Тогда найдем массу тринитроглицерина  .
.
Ответ: получено 245,16 г тринитроглицерина.
Фенолы
Общая формула Ar – OH, где Ar – ароматический радикал.
Номенклатура. Нумерация атомов углерода начинается от гидроксильной группы ОН (если она старшая). Продолжают нумерацию в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
Например:



фенол 2-метилфенол (или о-крезол) 2-этил-4-хлорфенол
У многоатомных фенолов указывают положение каждой гидроксогруппы и добавляют слово «бензол». Например:



1,3 -дигидроксибензол 1,2-дигидроксибензол 1,4 -дигидроксибензол
(или резорцин) (или пирокатехин) (или гидроидрохинон)


1,2,3-тригидроксибензол 1,3,5-тригидроксибензол
(или пирогаллол) (или флороглюцин)


α-нафтол β -нафтол
Изомерия:
1) положение заместителей в бензольном кольце;
2) строение боковой углеродной цепи.
Строение. Фенолы – ароматические углеводороды, содержащие одну или несколько гидроксильных групп в бензольном кольце. В составе образующегося π-электронного облака электронная плотность, выравниваясь, перераспределяется от атома кислорода в сторону кольца +М (мезомерный) эффект.

-ОН группа является ориентантом первого рода, т.е. обогащает ароматическое ядро электронной плотностью и облегчает электрофильное замещение в положениях 2,4,6 (реакции идут лучше по сравнению с бензолом). При этом происходит ослабление связи О←Н. Таким образом, фенолы должны проявлять слабые кислотные свойства.
Физические свойства. Фенолы – кристаллические вещества при комнатной температуре, кроме м-крезола. Хорошо растворимы в горячей воде, обладают характерным запахом. Наличие водородных связей определяет высокие температуры плавления и кипения. Фенол имеет Тпл = 410С, Ткип = 1820С. Со временем при окислении кристаллы фенола краснеют и темнеют. Фенол ядовит, вызывает ожоги при попадании на кожу.
Получение:
1) плавлением сульфокислот со щелочами (чаще всего используется NaOH) 

2) в промышленности


3) гидролизом хлорбензола


4) из бурых углей и каменноугольной смолы.
Химические свойства. Характерны свойства ароматических углеводородов и спиртов. При этом возрастает кислотность ОН-группы и повышается реакционная способность бензольного кольца.
1) Кислотность фенола

С6Н5ОН + NaOH  C6H5ONa + H2O
C6H5ONa + H2O
Кдисс. = 1,7·10-10, т.е. фенол, как кислота, слабее H2S и Н2СО3, но сильнее R-OH.
C6H5 – ONa + H2O + CO2  C6H5OH + NaHCO3
C6H5OH + NaHCO3
2) Образование простых эфиров

3) Образование сложных эфиров. Фенолы не образуют сложные эфиры непосредственно с органическими кислотами, нужно использовать хлорангидриды органических кислот (CH3 – C(Cl) = O – хлорангидрид уксусной кислоты)

4) Реакции замещения ароматического кольца


Качественная реакция на фенол:
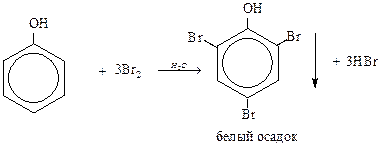



5) Каталитическое гидрирование протекает в газовой фазе при 1800С, катализатор Ni. В жидкой фазе реакция протекает при повышенном давлении.

Побочно образуется циклический кетон:

Окисление

Условия окисления: хромовая смесь K2Cr2O7 + H2SO4.
7) Качественная реакция на фенолы
3С6Н5ОН + FeCl3  (C6H5O)3Fe↓ + 3HCl
(C6H5O)3Fe↓ + 3HCl
красно-фиолетовый
Крезолы – голубые, другие фенолы – зеленые.
Задачи
30. Для грунтовки досок в иконописных мастерских использовали казеиновый клей. При анализе этого клея было выяснено, что одно из составляющих его органических веществ. в котором массовые доли углерода, кислорода и водорода, соответственно равны 76,59%, 17,02% и 6,38%, было известно на Руси за 250 лет до того, как было официально получено и зарегистрировано английским ученым. Укажите формулу этого вещества. Тип № 4.
Решение: Пусть масса вещества составляла 100 г. Тогда массы элементов углерода, кислорода и водорода составят: mC = 76,59 г, mO = 17,02 г, mH = 6,38 г.
Разделим массы элементов на их атомные массы и получим при этом число моль каждого элемента в 100 г данного вещества:
| m(г) | C | O | H |
| 76,59 | 17,02 | 6,38 | |
| n | 6,38 | 1,06 | 6,38 |
Разделим эти цифры на наименьшее число (1,06): 6,0; 1; 6.0
Таким образом, неизвестное вещество – С 6 Н 6О, т.е. фенол.
Ответ: формула вещества С6Н5ОН, фенол.
31. Выведите формулу вещества, относящегося к спиртам, и предложите его изомеры, содержащим ароматический радикал, придающего краске для волос светоустойчивость, если при полном гидрировании 0,2 моль этого вещества поглощается 1,2 г водорода, 55 г этого вещества, с молярной массой 110 г/моль взаимодействует с 23 г натрия. Тип № 4.
Решение. Рассчитаем число моль водорода: n (H2) = 1,2: 2 = 0,6 моль.
Число моль неизвестного вещества при взаимодействии с натрием составит n (X) = 55: 110 = 0,5 моль.
Число моль натрия: n (Na) = 23: 23 = 1 моль. Из соотношения n(X): n (Na) очевидно, что на 1 моль неизвестного вещества приходится 2 моль натрия. Поэтому можно предположить, что неизвестное вещество представляет собой одноядерный (с учетом соотношения молей реагентов при гидрировании) двухатомный фенол, т.е. дигидроксибензол – С 6 Н 6О2.
Молярная масса дигидроксибензола М (С6Н6О2) = 110 г/моль. Изомеры: 1,2; 1,3; 1,4 – дигидроксибензолы.
Ответ: один из трех дигидроксибензолов или их смесь.
32. Вычислите выход реакции гидролиза салола (С6Н5ОСОС6Н4ОН), если в 100 г зубной пасты «Жемчуг» содержится его от 5,3 до 6,8%, а число молекул фенола, образующегося при чистке зубов в процессе гидролиза от 1,2 · 1022 до 1,395 ∙ 1023 молекул. Другим продуктом гидролиза является ароматическая спиртокислота. Тип № 8. 
Решение. Уравнение гидролиза салола имеет вид:

Примем, что в 100 г зубной пасты содержится 5,3% салола, а число молекул фенола, образующегося при чистке зубов в процессе гидролиза 1,2 ∙ 1022 молекул. Тогда масса салола составит 5,3 г.
Молярная масса салола М (С13Н10О3) = 214 г/моль. Число моль салола n (салола) = 5,3: 214 = 0,025 моль.
Число моль фенола n (C6H5OH) = 1,2 · 1022: 6,02 ∙ 1023 = 0,02 моль (6,02 ∙ 1023 – число Авогадро).
Выход гидролиза салола  .
.
Ответ: выход гидролиза салола 80%.
33. Для опровержения заявления представителей предприятия «Оргсинтез» о невозможности нахождения в сбросах их сточных вод фенола, ученики 14 школы г.Дзержинска Нижегородской области провели эксперимент: собрав сточную воду в банку, емкостью 3 л, они добавили 1М раствор хлорида трехвалентного железа и выделился фиолетовый осадок, массой 2,0  2,5 г. Какова была масса фенола в сточной воде и превзошла ли она ПДК = 0,001 моль/л. Тип № 8.
2,5 г. Какова была масса фенола в сточной воде и превзошла ли она ПДК = 0,001 моль/л. Тип № 8.
Решение. Хлорид трехвалентного железа был наверняка в большом избытке. Протекала следующая реакция:
3С6Н5ОН + FeCl3  (C6H5O)3Fe↓ + 3HCl
(C6H5O)3Fe↓ + 3HCl
Пусть масса осадка составила 2,5 г. Молярная масса фенолята железа (III) М = (72 + 15 + 16)∙3 + 56 = 335 г/моль. Число моль вещества осадка составит n( осадка) = 2,5: 335 = 0,0075 моль, следовательно по уравнению реакции число моль фенола будет в три раза больше, т.е. n (C6H6O) = 0,0075 · 3 = 0,0225 моль.
Найдем массу фенола m (C6H6O) = 0,0225 ∙ 94 = 0,21 г.
Эта масса содержится в 3 л воды. В одном литре m (C6H6O) = 0,21: 3 = 0,07 г/л = 70 мг/л, что в 70000 раз превышает ПДК.
Ответ: m (C6H6O) = 70 мг/л, превышает ПДК.
34. Какой продукт образуется в результате последовательного превращения ацетилена по реакциям тримеризации, замещения с хлором, обмена с водой, замещения с бромом? Тип № 4.
Решение. Реакция тримеризации ацетилена

Реакция замещения бензола с хлором

Реакция взаимодействия хлорбензола с раствором щелочи

Реакция взаимодействия фенолята натрия с соляной кислотой

Реакция бромирования фенола

Ответ: 2,4,6 – трибромфенол.
Альдегиды и кетоны
Общая формула предельных альдегидов и кетонов: C nH2n O
 Номенклатура.
Номенклатура.
1) Альдегиды:
а) от исторически сложившихся названий соответсвующих карбоновых кислот:

б) заместительная: углеводород с добавлением окончания – аль, выбирается самая длинная углеродная цепь, нумерация начинается от карбонильной группы.

 СН3 – СН – СН2 – С = О 3-метил - бутаналь
СН3 – СН – СН2 – С = О 3-метил - бутаналь
СН3 Н
в) тривиальные названия: СН2 = О – формальдегид (муравьиный альдегид).
2) Кетоны:
а) систематическая. Названия радикалов от младшего к старшему с добавлением слова «кетон»:

б) заместительная. Названия углеводорода с добавлением окончания – он. Нумерация начинается с атома углерода, ближайшего к карбонильной группе:

Изомерия.
1) Для альдегидов связана только со строением углеродного скелета. Например,


2) Изомерия кетонов связана со строением углеродного скелета и с положением карбонильной группы:


3) межклассовая изомерия у альдегидов и кетонов с одинаковым числом атомов углерода.
Строение. Это соединения с одной или несколькими карбонильными группами >C=O. В альдегидах одна связь карбонильного атома углерода занята атомом водорода.

Могут быть алифатическими и ароматическими.
Карбонильная группа имеет плоское строение. Атом углерода в sp2 -гибридном состоянии: 3 δ связи и 1 π связь. Высокая электроотрицательность атома кислорода способствует сильной поляризации двойной связи в карбонильной группе и смещению подвижных π-электронов в сторону атома кислорода (рис. 2).
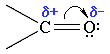


Рис.2. Строение карбонильной группы.
Химические свойства определяются полярной электроноакцкпторной группой, которая способна присоединять различные нуклеофилы. Поэтому для карбонильных соединений наиболее типичны реакции, идущие по механизму нуклеофильного присоединения (AN). В соединениях имеется подвижный α-Н атом.
Физические свойства. Не имеют водородных связей, поэтому температуры кипения альдегидов и кетонов существенно ниже, чем у соответствующих спиртов. Так СН2О – газ. Обладают резким запахом, хорошо растворимы в воде. Уксусный альдегид СН3СОН имеет Ткип.= + 20 0С.
Получение.
1) Окислением углеводородов.
а) В промышленности: медленным окислением предельных ациклических алканов в газовой фазе. Катализатор - соли Мn2+, образуется большая смесь продуктов.

б) Окислением циклоалканов воздухом в жидкой фазе при 1000С, давление 5-6 атм, катализатор – соли Со2+.
2С6Н12  С6Н11ОН + С6Н10О
С6Н11ОН + С6Н10О
в) окислением ароматических углеводородов с боковой цепью:
С6Н5 – СН2 – СН3  С6Н5 – С(О)СН3
С6Н5 – С(О)СН3
г) окислением алкенов:
- окислители: KMnO4 или K2Cr2O7 в кислой среде, нагревание):
CH3 – C(CH3) = CH – CH3  CH3 – C(O)CH3 + CH3COOH
CH3 – C(O)CH3 + CH3COOH
CH2 = CH2 + 0,5O2  CH3COH
CH3COH
- окислитель – озон О3:
CH3 – C(CH3) = CH – CH3  CH3 – C(O) – CH3 + CH3 – C(O)H
CH3 – C(O) – CH3 + CH3 – C(O)H
2) Гидролизом геминальных дигалогеналканов (2 атома галогена у одного атома углерода):
СН3 – ССl2 – CH3 + 2KOH  2KCl + CH3 – C(O) – CH3 + H2O
2KCl + CH3 – C(O) – CH3 + H2O
CH3 – CHCl2 + 2KOH  CH3 – C(O)H + 2KCl + H2O
CH3 – C(O)H + 2KCl + H2O
3) Окислением и дегидрированием спиртов.
а) Окислением:
Окислители: KMnO4 или K2Cr2O7 в кислой среде, CrO3; СuO при нагревании.
Первичные спирты дают при окислении альдегиды:
СН3 – СН2 – ОН + CuO  CH3COH + Cu + H2O
CH3COH + Cu + H2O
Вторичные спирты при окислении превращаются в кетоны:
CH3 – CH(OH) – CH3 + CuO  CH3 – C(O) – CH3 + Cu + H2O
CH3 – C(O) – CH3 + Cu + H2O
б) Каталитическим дегидрированием (промышленный способ).
Катализаторы: Cu, Ag, Cr, Ni, ZnO, Pt, при нагревании.
СН3 – СН2 – ОН  СH3 – CH(O)H + H2
СH3 – CH(O)H + H2
CH3 – CH(OH) – CH3  CH3 – C(O) – CH3 + H2
CH3 – C(O) – CH3 + H2
4) Реакцией М.Г. Кучерова. Катализаторы: серная кислота и соли ртути.


5) Карбонилированием (гидроформированием алкенов – оксосинтезом). Катализатор – НСо(СО)4, тетракарбонилгидрид кобальта, Р, t0.

Химические свойства.
1) Реакция у α-углеродного атома

2) Реакции карбонильной группы с нуклеофильными реагентами АN. Это реакции присоединения нуклеофильных реагентов по карбонильной группе.
а) Взаимодействие с реактивом Гриньяра
СН3 – СОН + СН3 – MgBr  CH3 – CH(CH3) – O – MgBr
CH3 – CH(CH3) – O – MgBr 
CH3 – CH(OH) – CH3
При взаимодействии реактива Гриньяра с альдегидами образуются вторичные спирты
СН2О + СН3 – MgBr  CH2 (CH3) – O – MgBr
CH2 (CH3) – O – MgBr  CH3 – CH2 – ОН
CH3 – CH2 – ОН
При взаимодействии реактива Гриньяра с формальдегидом образуются первичные спирты
CH3 – C(O) + CH3 – MgBr  C(CH3)3 – O – MgBr
C(CH3)3 – O – MgBr  C(CH3)3 – OH
C(CH3)3 – OH
Кетоны дают третичные спирты.
б) Альдольная конденсация (взаимодействие альдегидов) протекает в присутствии катализаторов NaOH или HCl
2CH3 – COH  CH3 – CH(OH) – CH2 – COH (альдоль)
CH3 – CH(OH) – CH2 – COH (альдоль)
в) Присоединение Н2О. Эта реакция характерна для низших альдегидов
СН2О + Н-ОН  НО – СН2 – ОН (гидратная форма альдегида)
НО – СН2 – ОН (гидратная форма альдегида)
В случае формальдегида равновесие реакции в растворе практически полностью сдвинуто в сторону образования гидратной формы. В случае кетонов эта реакция не осуществима.
г) Присоединение галогенводородов (HCl или HBr)
CH3 – COH + HClr  CH3 – CH(OH)Cl
CH3 – CH(OH)Cl  CH3 – CH(Cl2) + H2O
CH3 – CH(Cl2) + H2O
д) Взаимодействие со спиртами в присутствии кислотных катализаторов (чаще всего HCl)
СН3 – СН2 – С(О) – СН3 + СН3 – ОН 
СН3 – СН2 – С(СН3)ОН – О – СН3 (полуацеталь) 
СН3 – СН2 – С(О-СН3)2 – СН3 (ацеталь)
е) Взаимодействие с гидросульфитами NaHSO3 и KHSO3. Эта реакция используется для выделения карбонильных соединений из смеси органических веществ и для их очистки.
СН3 – СН2 – С(О) – СН3 + NaHSO3  СН3 – СН2 – С(СН3)ОН – SO3Na↓
СН3 – СН2 – С(СН3)ОН – SO3Na↓
Эти соединения хорошо кристаллизуются, а при их гидролизе идет обратная реакция.
3) Восстановление карбонильных соединений до спиртов или углеводородов. Восстановители: гидриды Mg, Al или LiAlH4, а также каталитическое гидрирование (Pt, Ni - катализаторы)
СН3 – СОН + Н2  СН3 – СН2 – ОН
СН3 – СН2 – ОН
(СН3)2 = О + Н2  (СН3)2 – СН (ОН)
(СН3)2 – СН (ОН)
При восстановлении карбонильных соединений Zn или Mg в кислых растворах образуются предельные углеводороды
СН3 – СН2 – С(О) – СН3 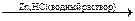 СН3 – СН2 – СН2 – СН3
СН3 – СН2 – СН2 – СН3
4) Окисление карбонильных соединений
а) Окисление альдегидов. Окислители: KMnO4 или K2Cr2O7 в кислой среде, CrO3; аммиачный раствор оксида серебра  или свежеприготовленный раствор гидроксида меди (II)
или свежеприготовленный раствор гидроксида меди (II)


Реакция серебряного зеркала – качественная реакция на альдегиды.

б) Окисление кетонов. Кетоны устойчивы, окисляются только при высоких температурах в жестких условиях с разрывом углерод-углеродных связей по обе стороны карбонильной группы.
5) Особенности реакций альдегидов.
а) Окисление
б) Могут тримеризоваться и полимеризоваться:

nCH2O  (- CH2 – O -)n параформ
(- CH2 – O -)n параформ
в) легче идут все реакции нуклеофильного присоединения.
Следует отметить, что алифатические альдегиды более реакционноспособные, чем ароматические. В ряду HCN, CH3COH, C6H5 – COH реакционная способность убывает.
6) Получение фенол-формальдегидных смол и пластмасс. Данная реакция протекает в водном слабощелочном растворе
а) С6Н5 – ОН + СН2О  С6Н4(ОН)СН2ОН + С6Н4(ОН)СН2ОН (оксибензиловые спирты)
С6Н4(ОН)СН2ОН + С6Н4(ОН)СН2ОН (оксибензиловые спирты)
б) При проведении дальнейшей реакции в присутствии HCl (катализатор) на холоду получаем следующее соединение
С6Н4(ОН)СН2ОН + С6Н5 – ОН  С6Н4(ОН) - СН2 - С6Н4 – ОН + Н2О
С6Н4(ОН) - СН2 - С6Н4 – ОН + Н2О
в) При нагревании протекает реакция поликонденсации
n С6Н5 – ОН + nCH2O  [- C6H3(OH) – CH2 -]n + nH2O
[- C6H3(OH) – CH2 -]n + nH2O
Получают фенолформальдегидные смолы и пластмассы.
Задачи
35. Каков состав равновесной газовой смеси оксида углерода (II) и водорода в закрытом сосуде, общем количеством 5 Кмоль, если давление в системе за время реакции уменьшилось в 1,4 раза. Какую массу 40% раствора (формалина) можно получить из продукта данной реакции? Достаточно ли его будет для хранения всех препаратов раздела «Рыба» в студенческой биологической лаборатории, если потребность формалина в год составляет 8,5 кг. (Тип № 5).
Решение. Реакция протекает по следующей схеме:
СО + Н2  СН2О
СН2О
Пусть прореагировало х моль СО, тогда число моль Н2 составит (5 - х) моль. В газофазных реакциях давление пропорционально числу молей реагентов:
p1V = n1RT p2V = n2RT
Считаем, что реакция проходит в постоянном объеме.
 х = 1,1 Кмоль.
х = 1,1 Кмоль.
Молярная масса формальдегида М (CH2O) = 30 г/моль.
Масса получившегося формалина m (CH2O) = 1,1 ∙ 30 = 33 кг.
Число моль Н2: n (Н2) = 5 – 1,1 = 3,9 Кмоль.
Масса оксида углерода: m (CO) = 3,9 ∙ 28 = 109,2 кг.
Рассчитаем массу раствора: m (раствора) = 33/0,4 = 82,5 кг.
Ответ: n (CO) = 1,1 Кмоль, n (H2) = 3,9 Кмоль, достаточно.
36. Определите состав очищенных отходов Дзержинского завода Оргсинтез, если средняя плотность смеси этилбензола и альдегида составляет 3,125 г/л, а при взаимодействии этого альдегида с гидроксидом меди (II) при нагревании, образуется углекислый газ. (Тип № 5).
Решение: Реакция идет по схеме:

Пусть моль газа имеет массу: m (газа) = 3,125 ∙ 22,4 = 70 г.
Пусть в одном моль смеси содержится х моль формальдегида, тогда число моль этилбензола (1 - х). Можно составить уравнение:
30 ∙ х + 106 ∙ (1 - х) = 70
30 х + 106 – 106 х = 70
х = 0,5 моль
Ответ: состав отходов – 50% каждого из веществ.
37. Определите состав медицинского раствора формальдегида, если в нем 16% углерода по массе.
Решение. Пусть было 100 г неизвестного вещества. Тогда масса углерода составит 16 г и число моль атомов С: n (C) = 1,33 моль. Столько же моль формальдегида было в растворе. Поскольку молярные массы воды и формальдегида не сильно различаются, принимаем плотность раствора равной 1 г/мл. Молярная концентрация: С (СН2О) = 1,33 моль/л.
Ответ: С (СН2О) = 1,33 моль/л.
38. В 1858 г. немецкий химик Либих впервые наладил производство зеркал кабинетного формата ( ), для чего он использовал реакцию серебряного зеркал. На покрытие одного зеркала уходило до 6 г формальдегида. Определите, каким слоем серебра было покрыто зеркало. если образовалось 11,34 г формиата аммония, а плотность покрытия составила 2,2 г/см3 ? Тип № 8.
), для чего он использовал реакцию серебряного зеркал. На покрытие одного зеркала уходило до 6 г формальдегида. Определите, каким слоем серебра было покрыто зеркало. если образовалось 11,34 г формиата аммония, а плотность покрытия составила 2,2 г/см3 ? Тип № 8.
Решение. Реакция серебряного зеркала

Молярная масса формиата аммония М (НСООNH4) = 63 г/моль; найдем его количество вещества n (соли) = 11,34/63 = 0,18 моль.
По уравнению реакции видно, что образовалось n (Ag) = 2 ∙ 0,18 = 0,36 моль. Масса серебра составит: m (Ag) = 0,36 ∙ 108 = 39 г.
Объем серебряного покрытия: 
Площадь поверхности зеркала составит:  .
.
Толщина покрытия: 
Ответ: Толщина покрытия:  .
.
39. Какой способ получения альдегидов объясняет латинское происхождение названия класса (alcohol + dehid…)?
Возможные варианты ответов:
1) 2СН3ОН + О2  СН2О + 2Н2О
СН2О + 2Н2О
2) С2Н5ОН + [O]  СН3CОH + Н2О
СН3CОH + Н2О
3) С2Н5ОН  СН3CОH + Н2
СН3CОH + Н2
4) C2H4Cl2 + H2O  СН3CОH
СН3CОH
Литература:
1. Артеменко А.И. Органическая химия: Учебник для вузов. 4-е изд., перераб. и доп. – М.: Высш.шк., 2000.
2. Иванов В. Г., Горленко В.А., Гева О.Н. Органическая химия: Учеб. пособие для студентов высших педагогических учеб. заведений. – М.: Мастерство, 2003.
3. Кузьменко Н.Е., Еремин В.В., В.А. Попков. Начала химии. – 7-ое изд., перераб. и доп. – М.: Экзамен, 2002.
4. Нейланд О.Я. Органическая химия: Учебник для вузов. – М.:Высш. шк., 1990.
5. Пузаков С.А., Попков В.А. Пособие по химии. Вопросы, упражнения, задачи. – 3-е изд. перераб. и доп. – М.: Высш. шк., 2004.
6. Шабаров Ю.С. Органическая химия: Учебник для вузов в 2-х т., - 3-е изд., стер. – М.: Химия, 2000.
Оглавление:
| Предисловие……………………………………………………………… | |
| 1. Предельные углеводороды. Алканы…………………………….……….. | |
| 2. Алкены. Алефины……………………………………………………….... | |
| 3. Диеновые углеводороды (диены)……………………………………….. | |
| 4. Алкины. Ацетиленовые углеводороды………………………….………. | |
| 5. Ароматические углеводороды. Арены………………….……………….. | |
| 6. Предельные одноатомные и многоатомные спирты………….………… | |
| 7. Фенолы …………………………………………………………….……… | |
| 8. Альдегиды и кетоны……………………………………………………….. | |
| 9. Литература………………………………………………........................... |






