В молекуле одно или несколько бензольных колец С6Н6.
Общая формула C n H 2n-6
Номенклатура. Систематическое название всех ароматических углеводородов – арены. Родоначальник гомологического ряда – бензол С 6 Н 6. Радикал С 6 Н 5– называют фенилом. Названия аренов образуются из положения заместителей при бензольном кольце с добавлением слова – бензол. Возможны также тривиальные названия: например, винилбензол называют стиролом, метилбензол – толуолом.
Примеры:




По отношению к заместителю Х - положение:
1) 6 и 2 – орто – положение (орто-диметилбензол);
2) 3 и 5 – мета – положение (мета - диметилбензол);
3) 4 – пара – положение (пара - диметилбензол).
Наиболее важное соединение с непредельным заместителем в кольце – винилбензол:
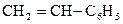 (стирол).
(стирол).
Изомерия:
1) взаимное расположение заместителей при бензольном кольце

2) изомерия скелета боковой углеродной цепи

Строение молекулы бензола представлено на рис.1.

Рис.1. Строение молекулы бензола.
Молекула бензола имеет строение плоского шестиугольника, стороны которого равны между собой. Атомы углерода находятся в состоянии sp2 – гибридизации. Каждый атом С в кольце имеет 3 δ связи и одну ароматическую π – связь. Молекула – плоская и симметричная, валентный угол составляет 1200. В кольце существует общая электронная система (сопряженная), образованная шестью р – электронами. Поскольку система замкнута, при подобном перекрывании образуется общее π – электронное облако, в котором π – электронная плотность распределена равномерно. Образование единого молекулярного облака можно рассматривать как результат эффекта π, π – сопряжения. Энергия сопряжения Е  150 кДж/моль, система весьма прочная, разрушить бензольное кольцо можно только в очень жестких условиях.
150 кДж/моль, система весьма прочная, разрушить бензольное кольцо можно только в очень жестких условиях.
Физические свойства. Бензол – бесцветная, нерастворимая в воде жидкость с характерным запахом. Ткип = 80,1 0С, Тплавл. = 5,5 0С. Сильно токсичен.
Получение:
1) выделяют из побочных продуктов коксовых и газовых заводов – пиролиз (сухой перегонкой угля), Т  1000 0С;
1000 0С;
2) из нефти;
3) пиролизом алканов с числом атомов С ≥ 6…8, Т > 800 0С, в присутствии катализатора Cr2O3:
 ;
;
4) каталитическим дегидрированием предельных циклических углеводородов. Реакция Н.Д. Зелинского (катализаторы Pt, Ni)
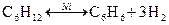
При Т = 100…180 0С реакция идет в прямом направлении, при Т > 300 0C – в обратном;
5) тримеризацией ацетилена
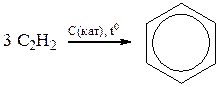
6) алкилированием ароматического ядра в присутствии катализаторов. Реакция Фриделя – Крафтса

7) реакцией Ж.Дюма для ароматических кислот (таким способом впервые получил бензол М. Фарадей)

Химические свойства.
Ароматичность. Характерны реакции электрофильного замещения SE, идущие в жидкой фазе по ионному механизму в присутствии электрофильных катализаторов – кислот FeHal2, AlHal3, H3PO4; ZnHal2.
1) Реакции замещения:
а) алкилирование по Фриделю-Крафтсу

Наличие электродонорных заместителей в кольце (радикалов, ОН-, NH2 – группы) облегчает реакции замещения, причем эти заместители ориентируют группы в орто - и пара - положения.
Hal также ориентируют группы в орто – и пара – положения, но, будучи акцепторами, осложняют последующую реакцию. Другие заместители, например,  , - CH=, - COOH, ориентируют группы в мета – положение и только затрудняют последующую реакцию.
, - CH=, - COOH, ориентируют группы в мета – положение и только затрудняют последующую реакцию.
б) галагенирование (идет трудно) 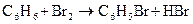
в) нитрование идет в присутствии концентрированной H2SO4 при нагревании:

2) Реакции присоединения водорода и хлора с разрушением ароматической системы идут трудно: высокая температура, давление, при хлорировании – свет:
 циклогексан;
циклогексан;
 гексан;
гексан;


3) Горение 
4) Реакции заместителей:
а) окисление заместителей при бензольном кольце раствором KMnO4 в водном растворе при нагревании:
 бензойная кислота;
бензойная кислота;
 «орто» - терефталевая кислота
«орто» - терефталевая кислота
б) замещение галогенами на свету:

Задачи
20. Определите молярную концентрацию пестицида ДДТ (Cl-C6H4-CH(CCl3) - C6H4Cl) в сосуде для обработки растений, если на упаковке стоит число 2 %. Достаточно ли этой концентрации для уничтожения тли, если минимальная концентрация ДДТ, действенная в таких случаях, составляет 10-3 моль/л? Тип № 8.
Решение: Бруттоформула пестицида ДДТ - С14Н9Cl5.
Молярная масса пестицида М (С14Н9Cl5) = 12 ∙ 14 + 9 + 35,5 ∙ 5 = 354,5 г/моль.
Поскольку раствор водный и очень разбавленный, считаем, что ρраствора = 1 г/мл. Пусть объем сосуда - 1 л, тогда, mраствора = 1000 г.
Так как концентрация ДДТ 2 %, то масса m(ДДТ) = 1000 ∙ 0,02 = 20 г.
Определим число молей пестицида:  . Отсюда, С (ДДТ) = 5,64 ∙ 10-2 моль/л, что выше минимальной концентрации. Следовательно, тля будет уничтожена.
. Отсюда, С (ДДТ) = 5,64 ∙ 10-2 моль/л, что выше минимальной концентрации. Следовательно, тля будет уничтожена.
Ответ: С (ДДТ) = 5,64 ∙ 10-2 моль/л, т.е. концентрация достаточна.
21. Выведите формулу компонента шампуня «Озалия», используемого для образования пены. В формулу шампуня входит гомолог бензола с предельным углеводородным радикалом. В этом ароматическом углеводороде доля углерода 87,8 %. Тип № 4.
Решение: В общем виде формула компонента шампуня: СnH2n+1 - C6H5.
Так как W (C) = 87,8 %, тогда W (H) = 12,2 %. Масса углерода в гомологе бензола будет 12 n + 72, масса водорода - 2 n + 6. Составим пропорцию и определим n:
12n + 72 - 87,8 %
2n + 6 - 12,2 %
(12n + 72) ∙ 12,2 = (2n + 6) ∙ 87,8
Решая уравнение, получим n = 12. Формула компонента шампуня С12Н25 – С6Н5.
Ответ: С12Н25 – С6Н5.
22. Определите выход реакции Фриделя – Крафтса, используемой для получения пенообразующего компонента шампуней, если в образовании этого компонента для одного тюбика шампуня «Яичный», вместимостью 50 г, где доля пенообразователя 10 %, участвовало 13,85 г бензола и 41,565 г монохлоралкана. Формулу пенообразующего компонента возьмите в ответе предыдущей задачи. Тип № 8.
Решение: Формула пенообразующего агента С12Н25 - С6Н5.
Реакция Фриделя-Крафтса

Молярные массы бензола и пенообразующего компонента: M (C6H6) = 78 г/моль; М (C12H25Cl) = 12 ∙ 12 + 25 + 36,5 = 204,5 г/моль
Определим число молей веществ по формуле  : n (C6H6) = 13,85/78 = 0,178 моль; n (C12H25Cl) = 41,565/204,5 = 0,2 моль
: n (C6H6) = 13,85/78 = 0,178 моль; n (C12H25Cl) = 41,565/204,5 = 0,2 моль
Бензол находится в недостатке, следовательно, количество продукта рассчитываем по бензолу. Исходя из стехиометрических коэффициентов в уравнении реакции, количество вещества продукта составит 0,178 моль.
М прод. = 169 + 77 = 246 г/моль
Так как доля пенообразователя 10 %, то тогда масса пенообразующего агента С12Н25 - С6Н5 будет 5 г. Количество его молей будет: n прод. = 5/246 = 0,02 моль.
Выход продукта бензол 
Ответ: выход продукта 11,24 %.
23. Определите состав очищаемых газообразных выбросов Дзержинского завода Оргсинтез, если средняя плотность смеси этилбензола и этаналя при 120 0С 1,786 г/л. Тип № 6.
Решение: Нужно взять 1 моль смеси и рассчитать его массу, определить мольные доли компонентов газовой смеси. Однако нельзя воспользоваться цифрой 22,4 л/моль, так как условия отличаются от н.у.
Воспользуемся уравнением Менделеева – Клайперона
pV = nRT
В нашем случае n =1 моль; р =const, следовательно, объем прямопропорционален температуре.
273 К - 22,4 л/моль,
393 К - V одного моля смеси,

Молярная масса моля смеси М = 1,786 ∙ 32,2 = 57,5 г/моль; этилбензола М (С8Н10) = 12 ∙ 8 + 10 = 106 г/моль; этаналя М (С2Н4О) = 24 + 4 + 16 = 44 г/моль
Пусть х – мольная доля ароматического соединения, тогда (1 - х) моль – мольная доля альдегида.
Составим уравнение: 106 х + 44(1 – х) = 57,5 x = 0,22 моль; (1 – х) = 0,78 моль.
Ответ: в 1 моле смеси 0,22 моль С8Н10 и 0,78 моль С2Н4О.
24. Какой объем метана при 25 0С следует хлорировать, чтобы получить впоследствии толуол, необходимый для склеивания ученического пенала? Для этого потребуется 10 мл 30 % - ного раствора толуола, плотностью 0,9 г/мл. Выход реакции хлорирования метана 85 % по объему, по реакции Фриделя – Крафтса – 75 %. Тип № 8.
Решение. Задача решается с конца. Уравнение реакции Фриделя – Крафтса – получение толуола
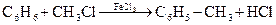
Определим массу толуола  .
.
Молярная масса М (C7H8) = 12 ∙ 7 + 8 = 92 г/моль.
Определим число молей толуола  .
.
С учетом 75 % - ного выхода реакции число молей хлористого метила
n (CH3Cl) = 0,03/0,75 = 0,04 моль
Реакция хлорирования метана:

C учетом 85 % - ного выхода n (CH4) = 0,04/0,85 = 0,046 моль.
Объем 1 моль газа при 298 К  .
.
Необходимый для хлорирования объем метана
V (CH4) = 24,45 ∙ 0,046 = 1,12 л
Ответ: V (CH4) = 1,12 л.
25. Из приведенных ниже уравнений выберите соответствующее рекции дегидроциклизации:
1)  2)
2) 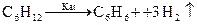
3)  4)
4) 
Ответ: правильно 4-е.






