Общая формула C n H 2n-2
Номенклатура. В неразветвленных алкинах нумерация начинается с того конца, где ближе тройная связь. Главная цепь обязательно содержит тройную связь (пусть она и не самая длинная). Перед названием главной цепи помещают номер атома углерода С, при котором есть заместитель, и название заместителя. Номер после названия главной цепи указывает положение тройной связи. Окончание – ин.

4 – метилпентин - 2
Если молекула непредельного углеводорода содержит одновременно двойную и тройную связи, то предпочтение в нумерации отдают двойной связи:

Изомерия:
1) структурная (углеродного скелета и положения тройной связи);

2) межклассовая изомерия – с алкадиенами.
Строение. Непредельные углеводороды имеют тройную связь, одна из них - δ, две другие π – связи. Атомы углерода С при тройной связи находятся в состоянии sp - гибридизации, молекула - линейная. Длина тройной связи меньше, чем у двойной.
Физические свойства.
С2 - С4 – газы; С5 - С16 – жидкости; С ≥ 17 – твердые вещества.
Ткип. выше, чем у соответствующих алкенов. Хорошо растворимы в неполярных органических растворителях, хуже – в воде. Ацетилен хорошо растворяется в ацетоне.
Получение.
1. Из дигалогенопроизводных (атомы Hhal расположены у соседних атомов углерода). Условия протекания реакции – спиртовой раствор щелочи и нагревание:

2. Каталитическим дегидрированием алканов и алкенов:


3. Производство ацетилена:
а) из карбида кальция:

б) крекингом предельных углеводородов (сырье – природный газ или нефть):


Химические свойства. Характерны реакции электрофильного присоединения АЕ, идущие несколько хуже, чем у алкенов.
1. Галагенирование и гидрирование:
 катализаторы: Pt; Pd; Ni.
катализаторы: Pt; Pd; Ni.

2. Гидрогалогенирование (в присутствии катализаторов – кислот Льюиса AlCl3, AlBr3 или H2SO4 для HCl), согласно правилу В.В. Марковникова

3. Реакция гидратации (реакция М.Г. Кучерова). Катализаторы: серная кислота и соли ртути.


4. Полимеризация:
а) димеризация


б) тримеризация
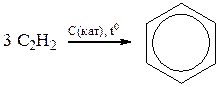
5. Кислотные свойства проявляются у алкинов с концевой тройной связью. Электронноакцепторное поведение тройной связи приводит к сдвигу электронов и поляризации δ – связи  .
.


бутин-2
Качественная реакция на концевую тройную связь:

белый осадок

красный осадок
6. Окисление ацетилена KMnO4 в водной среде

7. Горение

Задачи
15. Какой объем воздуха потребуется для сгорания 1 м3 смеси ацетилена с пропаном, взятых в массовом соотношении 8: 1, при сваривании водопроводной трубы? Тип № 6.
Решение: Реакции горения смеси углеводородов:
 (а)
(а)
 (б)
(б)
Молярные массы ацетилена и пропана равны:
M (C2H2) = 26 г/моль; M (C3H8) = 36 + 8 = 44 г/моль
Считаем, что все газы находятся при нормальных условиях. Тогда количество вещества смеси углеводородов:  , где Vm = 22,4 л/моль (молярный объем газа при нормальных условиях).
, где Vm = 22,4 л/моль (молярный объем газа при нормальных условиях).
Пусть количество вещества ацетилена (C2H2) - x моль; тогда количество вещества пропана (C3H8) - y моль. Следовательно, массы этих веществ будут: m (C2H2) = 26 x г; m (C3H8) = 44y г
Получаем систему уравнений:
 (в)
(в)
Из уравнений (в):  моль.
моль.
Из уравнений (в): у = 3,1 моль; х = 42 моль.
Из уравнения реакции (а) число молей кислорода: n (O2) = 42 ∙ 2,5 = 105 моль. Из уравнения реакции (б): n (O2) = 3,1 ∙ 5 = 15,5 моль. Общее количество молей кислорода: n (O2) = 105 + 15,5 = 120,5 моль.
Объемная (мольная) доля кислорода в воздухе составляет 21 %. Следовательно,  . Объем воздуха будет равен V воздуха = 574 ∙ 22,4 = 12853 л ≈ 13 м3.
. Объем воздуха будет равен V воздуха = 574 ∙ 22,4 = 12853 л ≈ 13 м3.
Ответ: Vвоздуха ≈ 13 м3.
16. При исследовании в лабораторных условиях реакции превращения алкинов в алкены взяли 10 л исходной смеси пропина с водородом (н.у). Плотность по водороду исходной смеси  Реакция не прошла количественно, после установления равновесия плотность по водороду конечной газовой смеси составила
Реакция не прошла количественно, после установления равновесия плотность по водороду конечной газовой смеси составила  Определите количество продукта и выход пропена на пропин в данных лабораторных условиях. Тип № 6.
Определите количество продукта и выход пропена на пропин в данных лабораторных условиях. Тип № 6.
Решение:
Гидрирование пропина протекает по уравнению
 (а)
(а)
Молярные массы пропина, водорода и пропена соответственно равны:
M (C3H4) = 40 г/моль; М (Н2) = 2 г/моль; М (С3Н6) = 42 г/моль
Относительная плотность вещества рассчитывается по формуле:  , где М1 – молярная масса исходной или конечной смеси, М2 – молярная масса водорода. Тогда,
, где М1 – молярная масса исходной или конечной смеси, М2 – молярная масса водорода. Тогда,
 г/моль.
г/моль.
Возьмем 1 моль исходной смеси. Пусть в нем было: n (C3H4) = x моль; тогда n (H2) = (1-x) моль. Зная молярные массы этих веществ, составим уравнение:
40 х + 2(1 - х) = 17,2 (б)
Из уравнения (б) получим, что n (C3H4) = x = 0,4 моль; тогда n (H2) =1 - x = 0,6 моль.
Пусть прореагировало у моль С3Н4. Составим материальный баланс для конечной газовой смеси.
n (C3H4) = 0,4 – y; n (H2) = 0,6 – y; n (C3H6) = y
Сумма молей газов в системе n кон. = 0,4 – у + 0,6 – y + y = 1 – y.
В ходе реакции изменяется число молей составляющих процесса, поэтому и изменяется молярная масса системы, (г/моль).

Нужно рассчитать мольные доли компонентов Ni в конечной газовой смеси. (Этот прием в математике называют нормировкой).
 ,
,  ,
, 
Теперь можно записать выражение для расчета М кон.смеси:
 (в)
(в)
Из уравнения (в) у = 0,2 моль. Если из 1 моля исходной смеси (22,4 л) получили 0,2 моль пропена (или 4,48 л), то из 10 л той же исходной смеси:

Выход пропена на пропин с учетом избытка второго реагента водорода составит

Ответ: V (C3H6) = 2 л, η (С3Н6) = 50 %.
17. Тест
Укажите верное соответствие авторов и их открытий:
| I. Теория химического строения | А. Семенов Н.Н. |
| II. Цепной механизм реакции замещения | Б. Кучеров М.Г. |
| III. Синтез 1,3 – бутадиена из этанола | В. Бутлеров А.М. |
| IV. Получение ацетальдегида из ацетилена | Г. Лебедев С.В. |
1) I – B; II – Г; III – B; IV – A;
2) I – B; II – А; III – Г; IV – Б;
3) I – Б; II – Г; III – А; IV – В;
4) I – Г; II – А; III – B; IV – Б.
Ответ: правильно 2-ой.
18. Вычислите массу ацетилена, производимого в нашей стране за год, если четверть этой массы идет на получение винилацетилена для дальнейшего использования в синтезе хлоропренового каучука. Этот каучук занимает 35 % всего производимого каучука, чья общая масса 2,7 млн т если выходы реакции образования винилацетилена 82 %, реакции его взаимодействия с хлороводородом – 7/8, реакции полимеризации 0,9. Тип № 8.
Решение:
Масса хлоропренового каучука m (х.к.) = 2,7 ∙ 0,35 = 0,945 млн т.
Реакция получения винилацетилена (η = 82 %):

Реакция гидрогалогенирования винилацетилена с получением хлоропрена (η = 87,5 % (7/8)):

Реакция полимеризации хлоропрена (получением хлоропренового каучука):
 (η = 90 %)
(η = 90 %)
Найдем массу мономера хлоропренового каучука с учетом его 90 % - ного выхода m (мономера) = 0,945/0,9 = 1,5 млн т, массу винилацетилена m (винилацетилена) = 1,05/0,875 = 1,2 млн т; ацетилена m (ацетилена на винилацетилен) = 1,2/0,82 = 1,46 млн т;
Так как четверть массы ацетилена идет на получение винилацетилена (из условия задачи), то общая масса производимого ацетилена в стране: m (С2Н2) = 1,46/0,25 = 5,84 млн т
Ответ: m (С2Н2) = 5,84 млн т.
19. Ацетиленовый углеводород, часто используемый в препаративной химии, и содержащий пять углеродных атомов в главной цепи, может максимально присоединить 80 г брома с образованием продукта реакции массой 104 г. Определите строение ацетиленового углеводорода, если известно, что он не реагирует с аммиачным раствором оксида серебра. Тип № 3.
Решение
Реакция бромирования ацетиленовых углеводородов

Найдем количество вещества брома:  моль. Из уравнения реакции следует, что число молей ацетиленового углеводорода n (СnH2n-2) = 0,5/2 = 0,25.
моль. Из уравнения реакции следует, что число молей ацетиленового углеводорода n (СnH2n-2) = 0,5/2 = 0,25.
Масса углеводородного радикала составит m R = 104 – 80 = 24 г, это и есть масса исходного алкина.
Найдем молярную массу алкина по формуле:
 , М (СnH2n-2) = 24/0,25 = 96 г.
, М (СnH2n-2) = 24/0,25 = 96 г.
14n – 2 = 96; n = 7
Отсутствие реакции с аммиачным раствором Ag2O указывает на то, что в углеводороде нет концевой тройной связи.
Формула вещества С7Н12.
Строение алкина

Ответ: 4,4 – диметилпентин – 2.






