Эквивалентная (нормальная) концентрация (или нормальность) показывает число молей эквивалентов растворенного вещества, содержащееся в 1 л раствора:
 , (3.9)
, (3.9)
где  – масса растворенного вещества, г;
– масса растворенного вещества, г;  – эквивалентная масса, г×моль-1; V – объем раствора, л (дм3).
– эквивалентная масса, г×моль-1; V – объем раствора, л (дм3).
Единицей измерения эквивалентной концентрации служит [С] = 1 моль/дм3= 1 моль/л. Однонормальным называется раствор, в 1 л которого содержится один моль эквивалентов растворенного вещества (1N). Растворы, содержащие доли молей эквивалентов в 1 л раствора, например, 0.1; 0.2; 0.02; 0.001, называются соответственно децинормальными (0.1N), двудецинормальными (0.2N), двусантинормальными (0.02N), миллинормальпымн (0.001N) и т. д. Растворы, содержащие 2, 3, 4 и т. д. молей эквивалента в 1л раствора, называются соответственно, двунормальными (2N), трехнормальными (3N), четырехнормальными (4N) и т. д.
При переходе от молярных концентраций к нормальным и наоборот следует учитывать число молей эквивалентов ( ), образующих моль данного вещества. Для растворов соединений типа НС1, НNОз, КОН, NaF и т. п., для которых число молей эквивалентов совпадает с количеством молей молярная и эквивалентная концентрации численно совпадают. Для соединений типа СаС12, Н2S04, ВаС12, Са(ОН)2 и т. д. 1 моль эквивалентов составляет 0,5 моля молекул. В соответствии с этим 1N растворы этих веществ будут в то же время 0,5 М, а 1 М растворы — двухнормальными (2N).
), образующих моль данного вещества. Для растворов соединений типа НС1, НNОз, КОН, NaF и т. п., для которых число молей эквивалентов совпадает с количеством молей молярная и эквивалентная концентрации численно совпадают. Для соединений типа СаС12, Н2S04, ВаС12, Са(ОН)2 и т. д. 1 моль эквивалентов составляет 0,5 моля молекул. В соответствии с этим 1N растворы этих веществ будут в то же время 0,5 М, а 1 М растворы — двухнормальными (2N).
Использование эквивалентных концентраций растворов упрощает расчеты. Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. Например, 1 моль эквивалентов ВаС12 осаждает из раствора серной кислоты 1 моль эквивалентов ВаS04, оставляя в растворе 1 моль эквивалентов НС1:
ВаС12 + Н2S04 ® ВаS04 + НС1.
Так как растворы с одинаковой эквивалентной (нормальной) концентрацией содержат одинаковое число молей эквивалентов, то объемы этих растворов реагируют друг с другом в соотношении 1:1. Поэтому для нейтрализации 1л 1N раствора соляной кислоты (НС1) требуется прибавить: 1л 1N раствора щелочи (например, NаОН); либо 0.5л 2N раствора щелочи; либо 0.25л 4N раствора щелочи. Если применять более разбавленные растворы, то для нейтрализации 1л 1N раствора НС1 необходимо применить 2 л 0.5N щелочи; 4 л 0.25N щелочи и т. д.
Произведение эквивалентной концентрации раствора на его объем в литрах показывает общее число молей эквивалентов, содержащееся в данном объеме раствора. Обозначив нормальности двух реагирующих растворов через N1 и N2. а их объемы через V1 и V2, получим:
 или
или 
Следовательно, объемы реагирующих друг с другом растворов обратно пропорциональны их эквивалентным концентрациям.
Пример1. Определить эквивалентную концентрацию раствора гидроксида натрия NаОН, если в 400 см3 раствора содержится 3.2 г NаОН.
Решение. Эквивалентная масса гидроксида натрия
 г×моль-1.
г×моль-1.
Количество молей эквивалентов гидроксида натрия, содержащееся в 400 см3 раствора,  моль. Тогда эквивалентная концентрация раствора NaOH будет равна
моль. Тогда эквивалентная концентрация раствора NaOH будет равна
 моль/дм3 =0.2N.
моль/дм3 =0.2N.
Пример 2. В объеме серной кислоты Н2SO4, равном 500мл, содержится 196 г Н2SO4. Определить молярную и эквивалентную концентрации раствора кислоты.
Решение. Молярная масса серной кислоты
 г×моль-1,
г×моль-1,
а эквивалентная масса 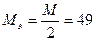 г×моль-1. Тогда молярная концентрация раствора Н2SO4:
г×моль-1. Тогда молярная концентрация раствора Н2SO4:  моль/л = 4М,
моль/л = 4М,
а эквивалентная  моль/л = 8N.
моль/л = 8N.
П р и м е р 3. Для нейтрализации 50 мл раствора серной кислоты Н2SO4, израсходовано 25 мл 0.4N раствора щелочи NaOH. Определить нормальность раствора серной кислоты.
Р е ш е н и е. Используя закон эквивалентов  , получим
, получим
 .
.
3.2.3 Безразмерные концентрации растворов






