МИНОБРНАУКИ РОССИИ
федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Санкт-Петербургский государственный технологический институт (технический университет)»
(СПбГТИ(ТУ))
Кафедра физической химии
Ю.П.Акулова, Е.Н. Смирнова, А.А. Ильин,В.Н. Нараев
ОСНОВЫ НЕКОТОРЫХ РАЗДЕЛОВ ХИМИИ. ТЕОРИЯ И ЗАДАЧИ
Учебное пособие
Санкт-Петербург
УДК 546; 544
В учебном пособии представлен теоретический материал для практических занятий и самостоятельной работы студентов по разделам «Периодическая система элементов и строение атомов», «Окислительно-восстановительные реакции», «Способы выражения концентрации растворов», приведены примеры решения задач и многовариантные индивидуальные задания.
Учебное пособие предназначено для бакалавров очной и заочной форм обучения по направлениям: 15.03.04 – Автоматизация технологических процессов и производств; 27.03.03 – Системный анализ; 09.03.01 – Информатика и вычислительная техника; 08.03.01 – Промышленное и гражданское строительство; 15.03.02 – Технологические машины и оборудование; 18.03.02 – Энерго- и ресурсо- сберегающие процессы в химической технологии, нефтехимии и биотехнологии.
Освоение дисциплины предполагает формирование компетенций в соответствии с ФГОС ВПО: ОПК-1 – использовать полученные знания теоретических основ фундаментальных разделов химии при решении профессиональных задач;ОПК-3 – использовать основные законы естественнонаучных дисциплин в профессиональной деятельности; ПК-1 – выполнять стандартные операции по предлагаемым методикам; ПК-2 – владеть базовыми навыками использования современной аппаратуры при проведении научных исследований; ПК-3 – владеть системой фундаментальных химических понятий; ПК-7 – владеть методами безопасного обращения с химическими материалами с учетом их физических и химических свойств.
Рис. 1, табл. 13, библиогр. 8 названий.
Рецензенты:
И.А. Соколов д.х.н., проф., зав. кафедрой общей и неорганической химии СПбГПУ,
Б.А. Лавров, д.т.н., профессор кафедры общей химической технологии и катализа СПбГТИ(ТУ)
Методические указания утверждены учебно-методической комиссией факультета веществ и материалов 2015г.
Рекомендовано к изданию РИСо СПбГТИ(ТУ).
Санкт-Петербург
 |
ОГЛАВЛЕНИЕ
Введение 5
1 Строение атома и периодический закон 6
1.1 Современные представления о микрочастицах 6
1.2 Квантово-механическая модель атома. Атомные орбитали.
Квантовые числа – параметры состояния электронов в атоме 7
1.3 Энергетические состояния электрона в атоме водорода 10
1.4 Многоэлектронные атомы. Принципы заполнения электронных орбиталей 10
1.5 Взаимосвязь между строением атомов химических элементов и их положением в Периодической системе Д.И. Менделеева. Электронные формулы атомов химических элементов 12
1.6 Периодичность свойств атомов химических элементов. Атомные радиусы, потенциал ионизации, сродство к электрону, электроотрицательность 16
1.7 Многовариантное задание 18
1.8 Контрольные вопросы 19
2 Окислительно-восстановительные реакции 20
2.1 Характерные особенности окислительно-восстановительных реакций 20
2.2 Степени окисления атомов в соединениях 21
2.3 Типы окислительно-восстановительных реакций 23
2.4 Зависимость окислительно-восстановительных свойств элементов
от строения их атомов 24
2.5 Окислительно-восстановительные превращения важнейших
окислителей и восстановителей 25
2.6 Составление уравнений окислительно-восстановительных реакций 29
2.7 Определение эквивалентов окислителей и восстановителей 33
2.8 Многовариантные задания 34
2.8.1 Задание 1 34
2.8.2 Задание 2 35
2.8.3 Задание 3 35
2.8.4 Задание 4 36
2.9 Контрольные вопросы 37
3 Растворы 38
3.1 Способы выражения количества вещества в растворе 39
3.2 Способы выражения концентрации растворов 40
3.2.1 Массовые концентрации растворов 41
3.2.2 Объемные концентрации растворов 42
3.2.3 Безразмерные концентрации растворов 45
3.3 Примеры решения типовых задач 45
3.3.1 Вычисление процентного содержания веществ в растворе 45
3.3.2 Вычисление массы растворенного вещества или растворителя
по данной массе раствора и его концентрации 46
3.3.3 Вычисление массы раствора определенной концентрации
по данной массе растворенного вещества или растворителя 46
3.3.4 Вычисление массы растворенного вещества или массы
растворителя, необходимой для получения раствора
определенной концентрации 47
3.3.5 Смешение растворов разных концентраций 47
3.3.6 Расчеты, связанные с использованием плотности растворов 48
3.3.7 Переход от одних способов выражения концентрации к другим 49
3.3.8 Приготовление разбавленных растворов из концентрированных 50
3.9 Отношения между эквивалентными концентрациями и
объемами растворов реагирующих веществ 51
3.4 Многовариантные задания 52
3.4.1 Задание 1 52
3.4.2 Задание 2 53
3.4.3 Задание3 53
3.4.4 Задание 4 54
3.5 Контрольные вопросы 55
4 Общие рекомендации к лабораторному практикуму 56
4.1 Темы лабораторных работ 56
Литература 57
Приложение 58
Введение
Курс общей и неорганической химии для нехимических специальностей вуза принадлежит к числу общенаучных учебных дисциплин и является важной составляющей в естественнонаучной подготовке механического факультета и факультета информационных технологий и управления. Курс химии опирается на знание студентами основ химии, физики и математики в объеме программ обязательного среднего (полного) образования.
Целью курса является формирование современного естественнонаучного мировоззрения, овладение базовыми знаниями в области общей и неорганической химии, развитие навыков самостоятельной работы, необходимых для применения химических знаний при изучении специальных дисциплин и дальнейшей практической деятельности.
В пособии в краткой форме изложены основные положения современной квантово-механической модели строения атома и современная трактовка Периодического закона. Также рассматриваются основные понятия теории окислительно-восстановительных процессов, приведена методика составления уравнений окислительно-востановительных реакций и прогнозирования продуктов реакции в зависимости от условий ее осуществления. Кроме того приведены различные способы выражения состава жидких растворов, в которых растворителем служит вода или органические жидкости.
В учебном пособии представлены многовариантные контрольные задания по рассмотренным разделам и контрольные вопросы для проверки усвоения материала. Вариант контрольного индивидуального задания определяется по номеру фамилии студента в списке учебной группы. При оформлении контрольных заданий необходимо соблюдать следующие правила:
· должны быть указаны номер задания и номер варианта
· условия задания должны быть переписаны полностью
· задания строго соответствуют номеру индивидуального варианта
· на каждой странице следует оставлять поля для замечаний преподавателя.
В результате изучения курса на практических занятиях, в лабораторном практикуме и в самостоятельной работе студенты приобретают знания и умения для изучения других общенаучных, профессиональных и специальных дисциплин и в дальнейшей практической деятельности.
1 Строение атома и периодический закон
1.1 Современные представления о микрочастицах
На данном уровне развития научных представлений о строении материи считается, что пределом её делимости являются элементарные, или фундаментальные, частицы: электроны, протоны, нейтроны и др. За последние десятилетия, благодаря появлению мощных ускорителей и тщательному изучению состава космических лучей, стало известно около 400 видов элементарных частиц, из которых состоит всё многообразие окружающего нас мира. С точки зрения химической организации материи представляют интерес только три элементарных частицы, которыми представлено вещество: протоны, нейтроны и электроны.
Упрощенно можно считать, что при взаимодействии протонов и нейтронов образуются положительно заряженные ядра, которые, притягивая отрицательно заряженные электроны, образуют атомы, формирующие низший уровень химической организации материи. Следующим более высоким уровнем химической организации материи являются молекулы, состоящие из атомов.
Атом – электронейтральная микросистема, состоящая из взаимодействующих элементарных частиц: протонов, нейтронов и электронов. В условных единицах заряд электрона составляет -1, а протона +1. Протоны и нейтроны образуют ядро атома, имеющее условно положительный заряд, равный суммарному заряду протонов. Суммарный заряд электронов в атоме равен заряду ядра, но имеет условно отрицательный знак.
Линейные размеры атома составляют приблизительно 10-10 м, а ядра»10-14 ¸ 10-15 м.
Основная масса атома сосредоточена в ядре и характеризуется массовым числом A, равным сумме чисел протонов и нейтронов. Количество протонов численно совпадает с зарядом ядра Z в относительных единицах. Если число нейтронов в ядре обозначить буквой N, то массовое число в относительных атомных единицах массы будет равно
A = N + Z. (1.1)
Заряд ядра Z является главной характеристикой атома. Значение Z определяет число электронов в атоме (N e = Z) и положение химического элемента в Периодической системе. Заряд ядра атома соответствует порядковому номеру элемента в Периодической таблице Д.И.Менделеева.
Химический элемент представляет собой вид (совокупность) атомов, имеющих одинаковый заряд ядра. Атом – наименьшая частица химического элемента, являющаяся носителем его свойств. Химический элемент – составная часть простых и сложных веществ. В настоящее время известно 110 химических элементов.
Атомы с одинаковым зарядом ядра (т.е. с одинаковым числом протонов), но различным массовым числом (т.е. различным количеством нейтронов в ядре) называются изотопами; с одинаковыми N, но различными Z и A - изотонами; с одинаковыми A, но различными Z и N – изобарами.
Относительная атомная масса элемента является средней величиной массовых чисел его природных изотопов с учетом их распространенности, поэтому массовые числа элементов являются дробными.
Основой современной теории строения атома являются законы и положения квантовой (волновой) механики, изучающей движение микрообъектов (электронов, протонов и других элементарных частиц).
Электроны и другие элементарные частицы имеют двойственную природу, обладая одновременно и корпускулярными и волновыми свойствами (корпускулярно-волновой дуализм). Эта особенность проявляется в таких явлениях, как фотоэффект и эффект Комптона (корпускулярные свойства), а также дифракция и интерференция (волновые свойства).
1.2 Квантово-механическая модель атома. Атомные орбитали.
Квантовые числа – параметры состояния электронов в атоме
Для описания движения микрочастиц в атоме применяют вероятностный подход, т.е. для них определяется не их точное положение, а вероятность нахождения в той или иной области около ядерного пространства. Поэтому такие понятия классической механики, как траектория движения электрона, его координаты и скорость в тот или иной момент времени, в квантовой механике не имеют смысла. Поэтому говорят о «состоянии электрона» в атоме. Состояние электрона в атоме описывается квантово-механической моделью электронного облака, плотность соответствующих частей которого пропорциональна вероятности нахождения там электрона. Электронное облако не имеет четко определенных границ, так как существует некоторая вероятность нахождения электрона даже на относительно удаленных от ядра расстояниях. Поэтому обычно под электронным облаком понимают ту часть (область) околоядерного пространства, ограниченного условной поверхностью, где вероятность нахождения данного электрона является наибольшей. Эта область пространства называется орбиталью. Орбиталь охватывает примерно 90 % возможных мест пребывания электрона.
Основной запас энергии электрона в атоме (связанный с его удаленностью от ядра и размерами электронной орбитали) характеризуется главным квантовым числом n, которое может принимать целочисленные значения от 1 до ∞, а для атомов элементов в нормальном (невозбужденном) состоянии – от 1 до 7. Состояния электрона с одним и тем же значением главного квантового числа называются энергетическим уровнем (электронным слоем или электронной оболочкой). В таблице 1.2 приведены условные обозначения уровней по спектроскопической номенклатуре в зависимости от значения n.
Таблица 1.1 – Условное обозначение энергетических уровней
| Значение n | |||||||
| Условное обозначение уровня | K | L | M | N | O | P | Q |
Чем выше значение n, тем больше энергия и размер электронного облака. Наименьшее значение энергии уровня соответствует n = 1. На этом уровне электроны связаны с ядром наиболее прочно и находятся ближе всего к ядру.
Энергия электрона зависит не только от того, на каком расстоянии от ядра он находится, но и от величины момента количества движения (или, другими словами, составляющей энергии электрона, связанной с его движением) вокруг ядра. Орбитальный момент количества движения определяется орбитальным (побочным или азимутальным) квантовым числом, которое характеризует форму орбитали и условно обозначается буквой l. Оно приобретает все целочисленные значения в интервале от 0 до (n - 1). Каждому значению главного квантового числа n соответствует определенное число значений орбитального квантового числа, т.е. энергетический уровень состоит из совокупности энергетических подуровней, несколько различающихся по энергии вследствие различных орбитальных моментов количества движения. Так для первого энергетического уровня (n = 1) возможен только один подуровень с l = 0. Для энергетических уровней с n = 2 возможны два подуровня: с l = 0 и l= 1, а с n = 3 - три подуровня. Число возможных энергетических подуровней на энергетическом уровне строго определено и численно совпадает с величиной главного квантового числа n. Квантовые подуровни в зависимости от значения l принято обозначать строчными буквами латинского алфавита, как это показано в таблице 1.3.
Таблица 1.2 – Обозначение электронных орбиталей
| Значение орбитального квантового числа l | ||||
| Условное обозначение орбитали | s | p | d | f |
Решение уравнения Шредингера показывает, что s -орбитали имеют форму шара (сферы), p -орбитали - форму гантели, d -орбитали - форму розетки (сложной гантели), а f -орбитали имеют ещё более сложную форму.
|
|
|
|
|
|
|
|
|

s (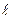 = 0) p (
= 0) p (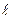 = 1) d (
= 1) d (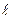 = 2)
= 2)
Рисунок 1.1 – Формы электронных облаков
Исследования показали, что в магнитном поле энергия электрона на подуровне зависит от пространственной ориентации (расположения) орбитали относительно силовых линий внешнего магнитного поля. Энергия электрона при этом зависит и от взаимодействия магнитного поля движущегося электрона с внешним магнитным полем и изменяется скачкообразно, принимая строго определённые значения, т.е. квантуется. Вследствие этого орбитали располагаются в пространстве только строго определенным образом. Так, p -орбитали располагаются взаимно перпендикулярно друг другу относительно декартовых осей координат. В соответствии с направлением координат p -орбитали обозначаются px, py, pz .. В квантовой механике число различных ориентаций орбиталей в пространстве определяется магнитным квантовым числом ml. Для каждого данного значения орбитального квантового числа lмагнитное квантовое число mlпринимает все целочисленные значения от -l до +l, включая 0.
Кроме орбитального момента количества движения электрон обладает собственным моментом количества движения, которое условно можно представить себе как вращение вокруг собственной оси. Это движение носит название " спин " (от англ. spin - вращаться, вертеться). Представление о спине, как собственном угловом моменте электрона, обусловленном его вращением вокруг собственной оси, не является вполне верной моделью. Однако оно удобно для понимания некоторых характеристик электрона (собственный момент и спин-орбитальное взаимодействие). Для спинового квантового числа электрона возможны только два значения, а именно, ms = + ½ или ms = - ½.
Таким образом, для полного описания состояния электрона в атоме необходимы четыре квантовых числа: n, l, ml, ms.
1.3 Энергетические состояния электрона в атоме водорода
Атом водорода имеет только один электрон. В основном (невозбуждённом) состоянии этот единственный электрон характеризуется следующим набором из четырёх квантовых чисел:
n = 1; l = 0; ml = 0; ms = + ½.
При возбуждении атома водорода электрон может переходить на уровни с большей энергией, для которых главное квантовое число равно 2, 3, 4, 5 и т.д.
Для наглядного представления электронной структуры атома или другими словами заселенности орбиталей электронами, каждую атомную орбиталь условно изображают в виде квантовой ячейки, энергетическое состояние которой характеризуется тремя квантовыми числами n, l, ml. Ячейка является символическим изображением орбитали. Электрон в квантовой ячейке условно изображают в виде стрелки, направление которой указывает значение спинового квантового числа. Стрелкой вида условно обозначают электрон со спиновым квантовым числом ms = + ½, а стрелка ¯ обозначает электрон c ms= - ½. Квантовая ячейка может быть свободной, занятой одним или двумя электронами. Причем в последнем случае оба электрона характеризуются противоположными (антипараллельными) спинами.
В пределах одного и того же электронного слоя (при одном и том значении главного квантового числа n) s -, p -, d - и f -электронные состояния атома водорода имеют одинаковую энергию, т.е. говорят, что они вырождены.
1.4 Многоэлектронные атомы. Принципы заполнения электронных орбиталей
Электрон в многоэлектронном атоме испытывает притяжение к ядру и отталкивание со стороны других электронов. При рассмотрении многоэлектронных атомов используется приближение, согласно которому каждый электрон будет как бы независим от других и его можно описать одноэлектронной волновой функцией – атомной орбиталью (АО). В этом случае каждый электрон находится на определенной орбитали той же формы и симметрии, что и в атоме водорода, а его состояние однозначно определяется квантовыми числами n, l, ml, ms. Существенное отличие многоэлектронного атома от атома водорода заключается прежде всего в энергетических характеристиках электронов.
Многоэлектронный атом представляет динамическую систему электронов движущихся в центральном поле ядра. Для ответа на вопрос, какие атомные орбитали и в какой последовательности будут заполняться электронами в его основном состоянии, следует руководствоваться следующими принципами.
Принцип минимума энергии: электрон в первую очередь занимает ту из орбиталей, энергия которой является наименьшей.
В соответствии принципом наименьшей энергии в атоме происходит распределение электронов по энергетическим уровням, а в рамках одного и того же уровня по подуровням.
Принцип (запрет) Паули: в атоме не может быть двух электронов, находящихся в одинаковых состояниях, т.е. имеющих одинаковые значения всех четырех квантовых чисел. В соответствии с принципом Паули электроны, находящиеся на одних и тех же атомных орбиталях и, следовательно, имеющие одинаковые значения трёх квантовых чисел (n, l и ml ), обязательно должны отличаться величинами спина (ms = ± ½). Правило запрета ограничивает число мест для электронов на данном энергетическом уровне, поскольку, на одной орбитали могут находиться только 2 электрона. В противном случае все электроны заняли бы орбиталь с наименьшей энергией. Так для n = 1 (минимум энергии), l = 0, ml = 0, и электроны могут отличаться друг от друга только спиновым квантовым числом: ms = + ½ или ms = - ½. Третьему электрону запрещено находиться на уровне с указанным n. Аналогично легко показать, что при n = 2 максимальное число электронов равно 8, при n = 3 восемнадцать (18).
Как видно, максимальное число электронов на энергетическом уровне с данным значением главного квантового числа равно 2n2.
Принцип Паули, являющийся одним из наиболее важных законов квантовой механики, относится ко всем элементарным частицам, имеющим полуцелый спин.
Правило Хунда: наиболее устойчивому состоянию атома соответствует состояние с максимально возможным числом неспаренных электронов на вырожденных орбиталях. Правило Хунда определяет порядок заполнения орбиталей одного подуровня (с одинаковыми значениями и n и l), в пределах которого электроны заполняют максимальное число орбиталей. При таком размещении суммарный спин электронов в данном подуровне и в атоме в целом будет максимально возможным.
Распределение электронов в атоме по энергетическим уровням осуществляется в соответствии с принципом наименьшей энергии. В первую очередь заполняются орбитали того уровня, энергия которого меньше. Из приведенных данных следует, что энергия электрона на данной орбитали в основном определяется значениями главного (n) и побочного (l) квантовых чисел. Поэтому энергетическим уровням с меньшей энергией соответствуют меньшие значения суммы (n +l). Вследствие этого заполнение орбиталей электронами осуществляется в порядке увеличения суммы главного и побочного квантовых чисел (n + l). Эту закономерность называют первым правилом Клечковского. Если орбитали имеют равные величины сумм (n+l), то порядок заполнения подчиняется второму правилу Клечковского, которое гласит: при одинаковых значениях сумм (n+ l) сначала заполняется орбиталь с меньшим значением главного квантового числа.
Основное значение правил Клечковского заключается в их предсказательном характере, они дают возможность определить электронные структуры как известных, так и неизвестных еще только синтезируемых элементов.
Отклонения от ожидаемого по правилу Клечковского порядка заполнения электронных слоев наблюдаются для некоторых атомов в основном состоянии: 24Cr, 29Cu, 42Mo, 46Pd, 47Ag, 67Gd, 79Au. Эти отклонения объясняются тем, что наполовину и полностью заполненные орбитали подуровня обладают повышенной устойчивостью (второе правило Хунда).
1.5 Взаимосвязь между строением атомов химических элементов и их положением в Периодической системе Д.И. Менделеева. Электронные формулы атомов химических элементов
В настоящее время п ериодический закон формулируется следующим образом: Свойства химических элементов, а также свойства и формы соединений этих элементов находятся в периодической зависимости от величины заряда ядра их атомов.
Периодический закон, формализованный в графической форме, имеет вид таблицы, называемой Периодической системой элементов Д.И. Менделеева. Известно более 400 вариантов изображения периодической системы, но наибольшее распространение получили восьми-, восемьнадцати- и тридцатидвухклеточные таблицы, соответствующие емкости энергетических слоев из 8, 18 и 32 электронов.
Периодическое изменение свойств элементов теория строения атомов объясняет периодическим повторением строения внешнего энергетического уровня. В этом заключается физический смысл периодического закона.
Химические элементы в Периодической системе объединяются в естественные совокупности в зависимости от строения электронных оболочек. Эти совокупности элементов в таблице изображаются горизонтальными и вертикальными рядами. Горизонтальные ряды называются периодами, вертикальные – группами и подгруппами.
Период представляет собой горизонтальный ряд элементов, в атомах которых происходит последовательное заполнение одинакового количества электронных уровней. Различная длина периодов связана с различиями в последовательности заполнения орбиталей. Номер периода совпадает со значением главного квантового числа n внешнего заполняемого уровня и показывает общее число энергетических уровней, занятых электронами в невозбужденном атоме (в нормальном состоянии). В пределах одного и того же периода элементы, у которых идет заполнение d- и f- орбиталей, объединяются в семейства. Так в четвертом, пятом и шестом периодах это семейства из десяти 3 d - (от скандия до цинка), 4d - (от иттрия до гадолиния Gd) и 5d- (от лантана и гафния до ртути Hg) элементов. В шестом и седьмом периодах эти семейства состоят из четырнадцати 4 f -элементов (лантаноидов) от церия до лютеция и 5 f -элементов (актиноидов) от тория до лоуренсия.
По максимальному числу электронов на внешнем энергетическом уровне невозбужденного атома химические элементы располагаются в вертикальных рядах, называемых группами. В Периодической системе восемь групп. В группах химические элементы подразделяются на подгруппы: элементы, у которых идет заполнение s- и p -орбиталей, образуют главную подгруппу или подгруппу A, а в побочную подгруппу или подгруппу B объединяются элементы с заполнением d -орбиталей. Физический смысл номера группы заключается в том, что он, как правило, указывает число электронов, которые могут участвовать в образовании химических связей.
Схему распределения электронов в атоме можно представить в виде формул электронных конфигураций, где показатель степени при условном обозначении орбитали указывает число находящихся на ней электронов.
Элементы малых периодов.
Первый период состоит всего из двух элементов: H и He. У этих элементов заполняется К слой (1 s -орбитали), причем атом гелия имеет полностью заполненную орбиталь: 2He –1s2.
2-ой и 3-й периоды содержат по 8 элементов. У элементов 2-го периода заполняется слой L (n = 2): сначала 2s-орбитали, а потом последовательно три 2 p -орбитали. В атоме неона достигается максимально возможное число электронов на втором квантовом слое, и электронная формула будет иметь вид: 10Ne –1s22s22p6. Таким образом, общее число элементов во втором периоде соответствует максимально возможному числу электронов 2n2 = 8.
У элементов третьего периода заполняется M-слой (n = 3), состоящий из 3 s -, 3 p - и 3 d -орбиталей. Как и во втором периоде, у двух первых элементов (Na и Mg) заполняются s -орбитали, у шести последних (от Al до Ar) – p -орбитали. У последнего элемента 3-го периода - аргона Ar (как и у Ne) завершается заполнение s - и p -орбиталей: 1s22s22p63s23p6. Его внешний слой (M‑слой) представляет собой совокупность четырех двухэлектронных облаков (одного в форме шара, трех других в форме гантели). У атомов элементов 3-периода в двух первых квантовых слоях (K и L) повторяется электронная конфигурация атома неона.
Элементы, в атомах которых идёт заполнение s -орбиталей, называются s -элементами, а элементы, в атомах которых заполняются p ‑орбитали, – p -элементами.
Элементы больших периодов.
Периоды 4-й и 5-й содержат по 18 элементов. У атомов элементов 4-го периода начинает заполняться 4 s ‑орбиталь слоя N (n=4). Появление электрона в 4 s -состоянии при наличии свободных 3 d -орбиталей обуславливается экранированием (заслонением) ядра плотным и симметричным электронным слоем 3s23p6. В связи с отталкиванием от этого слоя для 19-го электрона атома калия и 20-го электрона атома кальция оказывается энергетически выгодным 4 s -состояние:
19K – 1s22s22p63s23p64s и 20Ca – 1s22s22p63s23p64s2
При дальнейшем возрастании заряда ядра у следующего после кальция элемента – скандия – 3d -состояние становится энергетически более выгодным, чем 4 p. Поскольку в d -состоянии может находиться десять электронов, 3 d ‑орбитали заполняются и в атомах следующих элементов 4-го периода, например:
21Sc – 1s22s22p63s23p63d1 4s2 и 30Zn –1s22s22p63s23p63d104s2
Элементы, в атомах которых заполняются d -орбитали, называются d ‑элементами. У d -элементов 4-го периода слой M достраивается до 18 электронов.
После заполнения 3 d -орбиталей у последующих шести элементов (от Ga до Kr) заполняются p -орбитали внешнего слоя. Таким образом, 4-й период начинается двумя s-элементами и заканчивается шестью p ‑элементами, но в отличие от 2-го и 3-го периодов между s - и p ‑элементами располагаются десять d -элементов.
В пятом периоде заполнение электронных слоев и подслоев происходит, как и в 4-м периоде, а именно: у двух первых s -элементов(Rb и Sr) и шести последних p-элементов (In - Xe) заполняется внешний слой. Между s - и p -элементами располагаются десять d -элементов (от Y до Cd), у которых заполняются d -орбитали предвнешнего слоя (4 d ‑подслой).
Шестой период содержит 32 элемента и также начинается двумя s-элементами (Cs и Ba). Далее, у лантана начинает заполняться d ‑орбиталь предвнешнего слоя (5 d -подслой):
57La – 1s22s22p63s23p63d104s24p64d105s25p65d1 6s2
У четырнадцати следующих за лантаном элементов от церия (Ce) до лютеция (Lu) энергетически более выгодно оказывается 4 f ‑состояние по сравнению с 5 d ‑состоянием. Поэтому у этих элементов происходит заполнение 4 f -орбиталей (третий снаружи слой). Затем продолжается заполнение 5 d ‑орбиталей (Hf - Hg). И этот период завершается шестью p -элементами (Tl - Rn). Таким образом, в 6-м периоде, кроме двух s ‑элементов, десяти d -элементов и шести p ‑элементов, располагаются еще четырнадцать f -элементов.
В седьмом периоде имеются два s-элемента (Fr и Ra), за ними следуют d ‑элемент (Aс) и четырнадцать f ‑элементов (Th - Lr), далее снова d ‑элементы (Ku и Ns). 7-ой период не завершен.
Все отмеченное выше позволяет сделать вывод, что по мере роста заряда ядра периодически повторяются сходные электронные структуры атомов элементов, а, следовательно, повторяются и их свойства, зависящие от строения электронной оболочки атомов. В таблице 1.4 представлен порядок заполнения электронами энергетических уровней атомов.
Следует отметить, что пока нет однозначного понимания, в какую группу следует помещать водород. Основная особенность этого элемента заключается в том, что в его атоме единственный электрон находится в непосредственной близости от ядра и не отделен от его действия промежуточными электронными слоями. Исходя из числа внешних электронов, водород следует разместить в первой группе. Однако его положительно заряженный ион H+ не имеет никакого сходства с катионами металлов из этой группы. Напротив, если ходить из того, что атому водорода не хватает до завершения внешнего уровня одного электрона и способности этого атома образовывать отрицательно заряженный ион, то водород нужно поместить в седьмую группу. Вследствие отмеченных особенностей положение водорода в периодической системе в значительной мере условно.
Электронное строение атомов обусловливает следующие закономерности в изменении химических свойств элементов:
· в периодах слева направо с ростом заряда ядра атомов металлические свойства элементов ослабевают, а неметаллические усиливаются;
· в группах сверху вниз с ростом заряда ядра атомов металлические свойства элементов усиливаются, а неметаллические ослабевают.
Таблица 1.3 – Заполнение электронами энергетических уровней атомов
Сумма
(n + 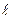 ) )
| n |
| Состояние | Максимальное число электронов в данном состоянии | Номер периода | Число элементов в периоде | Последовательность заполнения электронами уров- ней и подуровней атомов элементов |
| 1s | От H к He заполняется подуровень 1s. | ||||||
| 2s 2p | От Li к Ne заполняется подуровень 2s, а затем 2p. | ||||||
| 3s 3p | От Na к Ar заполняется подуровень 3s, а затем 3p. Остается незаполненным подуровень 3d. | ||||||
| 4s 3d 4p | От K к Kr заполнение идет в последовательности 4s3d4p.Остаются незаполненными подуровни 4d и 4f. | ||||||
| 5s 4d 5p | От Rb к Xe заполнение идет в последовательности 5s, 4d, 5p. Остаются незаполненными подуровни 4f, 5d, 5f. | ||||||
| 6s 4f 5d 6p | От Cs к Rn заполнение идет в последовательности 6s, 4f, 5d, 6p. | ||||||
| 7s 5f 6d 7p 8s | - | Не завершен |
1.6 Периодичность свойств атомов химических элементов. Атомные радиусы, потенциал ионизации, сродство к электрону, электроотрицательность
Свойства элементов, зависящие от строения электронной оболочки атома, изменяются по периодам и группам периодической системы. Поскольку в ряду элементов-аналогов электронные структуры лишь сходны, но не тождественны, то при переходе от одного элемента в группе к другому для них наблюдается не простое повторение свойств, а их более или менее отчетливо выраженное закономерное изменение. Химическая природа элемента обусловлена способностью его атома терять или приобретать электроны. Эта способность количественно оценивается величинами энергий ионизации и сродства к электрону.
Потенциалом ионизации (I) называется минимальное количество энергии, необходимое для отрыва и полного удаления электрона из атома в газовой фазе при T=0K без передачи освобожденному электрону кинетической энергии. Потенциал ионизации является положительной величиной и имеет наименьшие значения у атомов щелочных металлов и наибольшие у атомов благородных (инертных) газов.
Сродством к электрону (Ee) называется энергия, выделяемая или поглощаемая при присоединении электрона к атому в газовой фазе при T=0K без передачи частице кинетической энергии. Максимальным сродством к электрону обладают галогены, особенно фтор (E e = -328 кДж/моль). Величины I и E e выражают в килоджоулях на моль (кДж/моль) или в электрон-вольтах на атом (эВ).
Л.Полинг ввел понятие электроотрицательность (Х) как способность связанного атома смещать к себе электроны химических связей, повышая около себя электронную плотность. Т.е. Х характеризует стремление данного атома к присоединению электронов при образовании им химической связи. Для количественной оценки X предложено несколько различных методов. По Р.Маликену электроотрицательность атома оценивается полусуммой потенциала ионизации и сродства к электрону свободных атомов
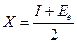
Наибольшее распространение в учебной литературе получила шкала электроотрицательностей, предложенная Л.Полингом, в которой электроотрицательность выражается в относительных величинах. За единицу шкалы Полинга условно принята электроотрицательность атома лития (X = 1.0), а обладающий наибольшей способностью притягивать электроны атом фтора имеет X = 4.0.
В периодах наблюдается общая тенденция роста потенциала ионизации и электроотрицательности с ростом заряда ядра атома, в группах эти величины с увеличением порядкового номера элемента убывают.
Размеры атомов и ионов определяются размерами электронной оболочки, которая не имеет строго определенных границ. Поэтому за радиус свободного атома или иона можно принять теоретически рассчитанное расстояние от ядра до положения главного максимума плотности внешних электронных облаков. Это расстояние называется орбитальным радиусом. На практике обычно используют значения радиусов атомов и ионов, находящихся в соединениях, вычисленные исходя из экспериментальных данных. Зависимость атомных и ионных радиусов от заряда ядра атома элемента носит периодический характер. В периодах по мере увеличения атомного номера радиусы имеют тенденцию к уменьшению. Наибольшее уменьшение характерно для элементов малых периодов, поскольку у них заполняется внешний электронный уровень. В больших периодах в семействах d - и f -элементов это изменение менее резкое, так как у них заполнение электронов происходит в предпредвнешнем слое. В подгруппах радиусы атомов и однотипных ионов в общем увеличиваются.
1.7 Многовариантное задание
1. 1. Для химического элемента (таблица 1.5) написать электронную формулу атома. Указать, в соответствии с какими правилами происходит заполнение электронных уровней и подуровней?
2. К каким элементам (s -, p -, d - или f -) относится указанный химический элемент? Указать номер периода, группы, подгруппы. Как изменяется заряд ядра и радиус атома в данных периоде и группе?
3. Написать электронную формулу атома в возбужденном состоянии. Какую валентность может проявлять данный атом в соединениях?
Таблица 1.4 – Варианты задания 1
| № варианта | Порядковый номер элемента в Периодической системе |
Продолжение таблицы1.4
| № варианта | Порядковый номер элемента в Периодической системе |
1.8 Контрольные вопросы
1. Из каких элементарных частиц состоит атом?
2. Чем определяется заряд ядра атома и количество электронов в атоме? Как заряд ядра атома связан с положением элемента в периодической системе?
3. Чему равно массовое число атома в относительных атомных единицах?
4. Какие атомы называются изотопами?
5. Какой моделью описывается состояние электрона в атоме? Что характеризует атомная орбиталь?
6. Какими квантовыми числами описывается состояние электрона в атоме?
7. Что характеризуют главное квантовое число n и орбитальное (побочное) квантовое число l? Какие значения могут принимать эти числа?
8. Что характеризуют магнитное квантовое число ml и спиновое число ms? Какие значения могут принимать эти числа?
9. В соответствии с какими принципами происходит распределение электронов по энергетическим уровням в основном состоянии атома? Какие элементы называются s-, p-, d- и f- элементами?
10. Какое максимальное количество электронов может находиться на энергетическом уровне?
11. Как формулируется периодический закон?
12. Чем объясняется периодическая повторяемость свойств химических элементов?
13. Что показывает номер периода в Периодической системе? Как образуются семейства в периодах?
14. О чем можно судить по номеру группы в Периодической системе?
15. Как количественно оценивается способность атома терять или присоединять электрон?
16. Что характеризует электроотрицательность атома? Как изменяется эта величина в периодах и группах Периодической системы?
2 Окислительно-восстановительные реакции
2.1 Характерные особенности окислительно-восстановительных реакций
Из многообразия химических реакций можно выделить две существенно отличающиеся друг от друга группы. К первой относятся реакции, в ходе которых не изменяются степени окисления атомов химических элементов, входящих в состав реагирующих веществ. Такими реакциями являются:
реакции обмена, например,
BaCl2 + K2SO4 = BaSO4 + 2 KCl;
реакции присоединения, например,
CaO + 2 H2O = Ca(OH)2;
реакции разложения, например,
CaCO3 = CaO + CO2.
Другую группу образуют химические реакции, в ходе которых степени окисления атомов изменяются. Такие реакции называются окислительно‑восстановительными. Они сопровождаются переходом электронов от одних атомов или ионов к другим.
Окисление – процесс, в котором частица (атом, молекула, ион) отдаёт один или несколько электронов. Вещества, молекулы, атомы или ионы которых способны отдавать электроны, повышая свою степень окисления, называются восстановителями. В процессе отдачи электронов восстановитель окисляется.
Процесс,в котором частица (атом, молекула, ион) присоединяет один или несколько электронов, называется восстановлением. Вещества, молекулы, атомы или ионы которых могут присоединять электроны, понижая степень окисления, называются окислителями. Присоединяя электроны, окислитель восстанавливается.
В качестве примера рассмотрим реакцию образования сульфида железа:
Fe + S = FeS
В ходе реакции атом железа отдает два электрона, повышая степень окисления от нуля до плюс двух (процесс окисления):
0 +2
Fe - 2 ē ® Fe
Атом серы, принимая два электрона, понижает степень окисления от нуля до минус двух (процесс восстановления):
0 -2
S + 2 ē ® S
Сера – более электроотрицательный элемент, поэтому принимает электроны от железа, выступая в качестве окислителя, и восстанавливается. Железо, являясь восстановителем, окисляется.
2.2 Степени окисления атомов в соединениях
Степенью окисления n химического элемента (окислительным числом) называют условный заряд его атома в соединении, вычисленный в предположении, что все связи в молекуле окислителя или восстановителя являются ионными. Т.е. степень окисления – это электрический заряд, который возник бы на атоме, если бы все электронные пары, с помощью которых он образует в соединениях химические связи с другими атомами, были бы полностью смещены к атомам наиболее электроотрицательного элемента. Эта величина носит формальный характер и, в большинстве случаев, далека от истинных значений электрических зарядов, возникающих на атомах вследствие смещения электронных облаков.
Степень окисления может приобретать отрицательное, положительное (целое и дробное) и нулевое значения и ставится над символом элемента в формуле соединения сверху с предшествующим знаком плюс или минус, например:
+1 +7 -2 +1 +6 -2 +1 -1
KMnO4 H2SO4 HCl
Атомы наиболее электроотрицательных элементов, в сторону которых смещены связующие электронные облака, имеют отрицательное значение степени окисления. Положительные степени окисления приобретают атомы, отдающие свои электроны другим атомам.
Степень окисления элементов в одноатомных ионах численно совпадает с их зарядом. При составлении окислительно-восстановительных реакций заряды реально существующих ионов принято записывать со знаком, стоящим после цифры. Например, 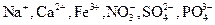 . Единицу при записи степени окисления элемента в соединении (заряда иона) часто опускают.
. Единицу при записи степени окисления элемента в соединении (заряда иона) часто опускают.
Степень окисления элемента в соединении следует отличать от его валентности, с которой первая может не совпадать. Согласно теории валентных связей количественно валентность характеризуется числом ковалентных связей, которые атом образует с другими атомами в соединении, т.е. она выражается отличным от нуля целым числом без знака. Так, например, степени окисления углерода в соединениях CH4, CH3Cl, CHCl3, CCl4 составляют, соответственно, -4, -2, +2, +4. Валентность же углерода, т.е. число образуемых им ковалентных связей, во всех этих соединениях равна 4.
При определении степени окисления атомов элементов в соединениях следует учитывать следующие положения:
1. Водород в большинстве соединений проявляет степень окисления +1.
Исключение: гидриды щелочных и щелочноземельных металлов (NaH,
KH, CaH2 и т.п.), в которых степень окисления водорода -1.
2. Кислород в подавляющем большинстве соединений имеет степень
окисления, равную -2.
Исключение:
· пероксиды (H2O2, Na2O2, K2O2, BaO2 и т.п.), в которых степень окисления атомов кислорода равна -1;
· надпероксиды (KO2, RbO2, CsO2 и т.п.), в которых степень окисления -1 имеет сложный надпероксидный ион [O2]-1 и, следовательно, формально степень окисления каждого атома кислорода равна -1/2;
· озониды (KO3, RbO3,CsO3 и т.п.), в которых озонид‑ион [O3]-1 имеет единичный отрицательный заряд и, следовательно, формально степень окисления каждого атома кислорода равна -1/3;
· фториды кислорода OF2 и O2F2, где степень окисления кислорода составляет, соответственно, +2 и +1.
3. Степени окисления атомов элементов в простых веществах
(N2, Cl2, O2, Pb, Cu и др.) принимаются равными нулю.
4. Постоянную степень окисления в соединениях проявляют
щелочные металлы (+1), металлы главной подгруппы второй
группы периодической системы, цинк и кадмий (+2).
5. Высшая положительная степень окисления атомов элементов
определяется номером группы в Периодической системе
элементов Д.И.Менделеева. Исключение составляют элементы
подгруппы меди (Cu, Ag, Au), кислород, фтор, а также металлы
восьмой группы.
6. Алгебраическая сумма степеней окисления всех атомов элементов,
входящих в молекулу химического соединения, всегда равна нулю.
Алгебраическая сумма степеней окисления всех атомов элементов,
составляющих сложный ион, равна его заряду.
На основании этих правил для определения степени окисления атома элемента в соединении, например, азота в гидроксиде аммония NH4OH, составляется уравнение вида n +1 -2 +1
NH4 O H 5×(+1) + 1×(-2) + 1×n = 0
Решая уравнение с одной неизвестной величиной относительно степени окисления азота в соединении, получим n = -3.
Основные степени окисления элементов главных подгрупп приведены в таблице 2.1.
Таблица 2.1 – Степени окисления элемента в соединениях в зависимости от положения в Периодической системе
| Номер группы в Периодической системе элементов N | ||||||
| I | II | III | IV | V | VI | VII |
| Степень окисления элемента в соединениях равна номеру группы n = + N | 1. Наивысшая возможная степень окисления элемента в соединениях равна номеру группы n = + N 2. Промежуточная степень окисления элемента в соединениях равна номеру группы минус два*: n = + (N - 2) 3. Наименьшая возможная степень окисления элемента в соединениях равна номеру группы минус восемь: n = N – 8 |
F
n = -1
 Cl +7
+5
Br +3
+1
I -1 Cl +7
+5
Br +3
+1
I -1
|
* - Азот проявляет несколько промежуточных степеней окисления: +4, +3, +2, +1.
Из таблицы видно, что высшая степень окисления элементов главных подгрупп в соединениях, как правило, совпадает с номером группы Периодической таблицы. Например, для серы, стоящей в шестой группе, устойчивыми степенями окисления будут +6, +4, -2. Для элементов главной подгруппы VII группы (кроме F), как показано в таблице, устойчивыми степенями окисления являются: +7, +5, +3, +1, -1.
Для элементов в побочных группах необходимо запомнить следующие устойчивые степени окисления: Cu: +2, (+1); Ag +1; Au: +3, +1; Zn: +2;
Cd:+2; Hg +2 (+1); Cr +6, +3; Mn +7, +6, +4, +2; Fe +3, +2; Co +2; Ni +2.
2.3 Типы окислительно-восстановительных реакций
Окислительно-восстановительные реакции делятся на три основные типа:
· межмолекулярного окисления-восстановления;
· внутримолекулярного окисления‑восстановления
· реакции диспропорционирования по степеням окисления (называемые также реакциями дисмутации или реакциями самоокисления ‑ самовосстановления).
При протекании реакций межмолекулярного окисления - восстановлениястепень окисления изменяют атомы элементов, входящих в состав различных молекул, например:
+2 -2 0 +2 -2 +4 -2
2 FeS + 3 O2 = 2 FeO + 2 SO2
В реакциях внутримолекулярного окисления‑восстановления степени окисления изменяют атомы различных элементов, входящих в состав молекулы одного и того же соединения. Механизм внутримолекулярного окисления‑восстановления характерен для реакций термического разложения соединений, например: +1 +5 - 2 +1 -1 0
2 KClO3 = 2 KCl + 3 O2
Реакции диспропорционирования по степеням окисления (дисмутации) – это реакции, в которых атомы одного и того же элемента выступают в роли и восстановителя и окислителя, например:
0 -2 +4
4 S + 8 NaOH = 3 Na2S + Na2SO3 + 4 H2O
2.4 Зависимость окислительно-восстановительных свойств элементов
от строения их атомов
Протекание окислительно-восстановительных реакций предполагает присутствие в реакционной системе атомов, молекул или ионов, взаимно противоположных по своей способности отдавать или присоединять электроны. Способность атомов элементов присоединять электроны, т.е. окислять другие вещества, характеризуется энергией сродства к электрону. Элементы с наивысшей энергией сродства к электрону (т.е. неметаллы, особенно фтор и кислород) обладают наибольшей окислительной способностью. В периодах с повышением заряда ядра атомов элементов окислительные свойства нарастают, достигая максимума у галогенов, а восстановительные свойства простых веществ понижаются. В главных подгруппах периодической системы при увеличении заряда ядра окислительные свойства ослабевают, а восстановительные – усиливаются.
Наиболее часто встречающиеся окислители можно расположить в ряд в порядке убывания силы их окислительной способности (для растворов с кислой средой):
F2 > MnO 4- > PbO2 > HClO > ClO4 - > BrO4- > Cr 2 O 7 2- > Cl 2 > MnO2 >
>O2 >Br2> 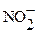 >
> 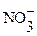 > Fe3+ > I2 >
> Fe3+ > I2 > 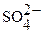
Как видно, самым сильным окислителем является фтор. Окислительная способность галогенов в группе по мере увеличения заряда ядра уменьшается. В тоже время восстановительная способность галогенид-ионов при переходе от F- к I- возрастает.
Атомы металлов обладают только восстановительными свойствами, поскольку на внешнем энергетическом уровне они имеют 1, 2 или 3 электрона. Способность атомов металлов отдавать электроны и превращаться в катионы характеризуется потенциалом ионизации. Чем ниже значение потенциала ионизации, тем сильнее проявляется восстановительная способность металла. Самые сильные восстановители – щелочные и щелочноземельные металлы.
По мере убывания восстановительных свойств металлы располагают в виде так называемого ряда напряжений (в кислой среде):
K>Ba>Sr>Ca>Na>Mg>Be>Al>Mn>Zn>Cr>Fe>Cd>Co>Ni>Sn>Pb>H>Sb>Bi>Cu>Ag>Hg>Pt>Au
Металлы, стоящие в этом ряду за водородом, не вытесняют водород из его соединений, вследствие чего они не растворяются в соляной и разбавленной серной кислотах. Металлы, стоящие в ряду напряжений до водорода, являются сильными восстановителями (активные металлы), могут энергично вытеснять водород.
Окислительно-восстановительные свойства сложных веществ зависят от величины степени окисления атома элемента, изменяющего её в реакции.
Окислительные свойства характерны для тех сложных веществ, в которых атомы элементов, способных изменять степени окисления, находятся в наивысших степенях окисления. Например, активными окислителями (и только окислителями!) являются перманганат калия KMnO4, бихромат калия K2Cr2O7, серная кислота H2SO4 (концентрированная!), поскольку атомы марганца, хрома и серы находятся в наивысших для них степенях окисления, и, следовательно, они могут только принимать электроны. Только восстановителями могут выступать вещества, в состав которых входят атомы в самых низших степенях окисления.
Вещества, в состав которых входят атомы элементов в промежуточных степенях окисления, могут проявлять окислительно-восстановительную двойственность: с одними реагентами быть окислителями, а по отношению к другим – восстановителями.
2.5 Окислительно-восстановительные превращения важнейших окислителей и восстановителей
Прежде чем составлять уравнения окислительно-восстановительных реакций, необходимо выяснить, какие из реагирующих веществ будут окислителем и восстановителем, возможные продукты реакции и влияние кислотности среды.
Рассмотрим наиболее часто используемые окислители и восстановители, а также продукты их превращения в зависимости от условий протекания реакции.
Окислители
1. Простые вещества
O2 + восстановитель ® 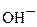 (в щелочной и нейтральной средах)
(в щелочной и нейтральной средах)
® H2O (в кислой среде)
O2 + 2 H2O + 4 ē ® 4 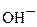
O2 + 4 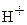 + 4 ē ® 2H2O
+ 4 ē ® 2H2O
Галогены: F2 (Cl2, Br2, I2) + восстановитель ® 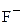 (
(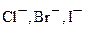 )
)
F2 + 2 ē ® 2 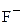
2. Ионы металлов в высших степенях окисления:
 + восстановитель ®
+ восстановитель ® 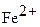
 + ē ®
+ ē ® 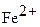
PbO2 + восстановитель ® 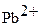 (в кислой среде)
(в кислой среде)
PbO2 + 4 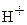 + 2 ē ®
+ 2 ē ® 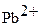 + 2H2O
+ 2H2O
MnO2 + восстановитель ® 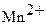 (в кислой среде)
(в кислой среде)
MnO2 + 4 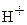 + 2 ē ®
+ 2 ē ® 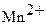 + 2H2O
+ 2H2O
б) Высшие кислородные кислоты и их соли:
H2SO4(конц.) + восстановитель ® SO2
SO42- + 4 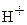 + 2 ē ® SO2 + 2 H2O
+ 2 ē ® SO2 + 2 H2O
H2SO4(конц.) + активный восстановитель ® H2S
(например, с активным металлом Zn, Mg или KI)
HNO3(конц.) + восстановитель ® NO2
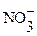 + 2
+ 2 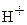 + ē ® NO2 + H2O
+ ē ® NO2 + H2O
HNO3(разб.) + восстановитель ® NO
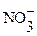 + 4
+ 4 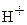 + 3 ē ® NO + 2H2O
+ 3 ē ® NO + 2H2O
HNO3(сильно разб.) + активный восстановитель ® 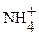
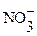 + 10
+ 10 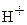 + 8 ē ®
+ 8 ē ® 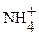 + 3H2O
+ 3H2O
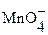 + восстановитель ®
+ восстановитель ® 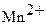 (в кислой среде)
(в кислой среде)
MnO4- + 8






