Ход и данные опыта
В данном опыте через исследуемые растворы пропускался электрический ток. По яркости свечения электрической лампочки определялось к каким соединениям по электропроводности (электролит/ неэлектролит); сильный электролит/ слабый электролит) относится данное соединение (таблица 1).
Таблица 1.
| Исследуемый раствор | Яркость свечения лампочки | Неэлеткролит/ электролит (слабый/ сильный) |
| Дистиллированная вода | ||
| 1 М сахар | ||
| 1 М КОН | ||
| 1 М NaNO3 | ||
| 1 М СН3СООН | ||
| 1 М NH4OH | ||
| CH3COONH4 (CH3COOH + NH4OH → CH3COONH4 + H2O) |
Анализа результатов опыта
1.Отметьте по яркости свечения лампочки сильные и слабые электролиты. Чем измеряется сила электролита и как она зависит от количества ионов в растворе?
_____________________________
2. Запишите уравнения диссоциации исследуемых веществ, а для слабых электролитов также выражения и значения констант диссоциации (КД).
____________________________________________________________________________________________
3. Сделайте общий вывод о зависимости степени диссоциации от природы электролита.
_______________________________________________________________________
__________________________________________________________________
2. Смещение равновесия диссоциации слабого электролита
2.1. Влияние разбавления раствора на степень электролитической диссоциации
Ход и данные опыта
Для проведения опыта электрический ток пропускали через растворы уксусной кислоты 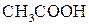 различных концентраций: концентрированный, 1 М и 0,1 М. Наблюдали за яркостью свечения лампочки (таблица)2.
различных концентраций: концентрированный, 1 М и 0,1 М. Наблюдали за яркостью свечения лампочки (таблица)2.
Таблица 2.
| Исследуемый раствор | Яркость свечения лампочки |
| Концентрированная CH3COOH | |
| 1 М СН3СООН | |
| 0,1 M CH3COOH |
Анализа результатов опыта
1. Чем объясняется усиление свечения лампочки при разбавлении раствора? В какую сторону сместилось равновесие диссоциации уксусной кислоты и почему?
________________________________________________________________________________________
2. Сделайте вывод о зависимости степени диссоциации слабого электролита от разбавления раствора. Запишите, исходя из закона разбавления Оствальда, выражение, связывающее степень диссоциации и концентрацию раствора.
__________________________________________________________________________
2.2. Влияние введения одноименных ионов на степень диссоциации слабых электролитов
Ход и данные опыта
а) В одну из пробирок с раствором гидроксида аммония NH4OH с раствором фенолфталеина добавляли небольшое количество хлорида аммония NH4Cl и сравнивали цвет полученного раствора с цветом раствора в контрольной пробирке.
Наблюдения:_______________________________________________________
Анализа результатов опыта
1. Запишите уравнения диссоциации NH4OH и NH4Cl.
__________________________________________________________________
2. Объясните изменение окраски фенолфталеина изменением концентрации ионов OH– в растворе. Как это связано со смещением равновесия диссоциации NH4OH при добавлении к раствору хлорида аммония?
__________________________________________________________________________
3. Сделайте вывод о влиянии введения одноименных ионов на степень диссоциации гидроксида аммония. Повлияет ли и как на степень диссоциации гидроксида аммония добавление к раствору сильного основания?
____________________________________________________________________________________
Ход и данные опыта
В одну из пробирок с раствором уксусной кислоты 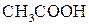 с раствором метилоранжа добавляли небольшое количество ацетата натрия
с раствором метилоранжа добавляли небольшое количество ацетата натрия 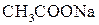 и сравнивали цвет полученного раствора с цветом раствора в контрольной пробирке.
и сравнивали цвет полученного раствора с цветом раствора в контрольной пробирке.
Наблюдения:________________________________________________________
Анализа результатов опыта
1. Запишите уравнение диссоциации CH3COOH и CH3COONa.
_______________________________________________________
2. Объясните, как смещается равновесие диссоциации уксусной кислоты при добавлении к ней ацетат-ионов (CH3COO–) из соли. Как меняются при этом концентрация ионов Н+ в растворе и степень диссоциации уксусной кислоты?
__________________________________________________________________________
3. Объясните, повлияет ли и как на степень диссоциации уксусной кислоты добавление к ней сильной кислоты.
______________________________________________________________________
3. Гидролиз солей. Образование кислых и основных солей при ступенчатом гидролизе
Реакция среды растворов солей
Ход и данные опыта
Втри пробирки с дистиллированной водой добавили несколько капель лакмуса. Одну из пробирок оставьте в качестве контрольной, а в остальные добавили небольшое количество солей NaCl и Al2(SO4)3. Наблюдения занесены в таблицу 3.
Таблица 3.
| Соль | Изменение окраски индикатора при добавлении соли |
| NaCl | |
| Al2(SO4)3 |
Анализа результатов опыта
1. Объясните, почему не изменилась окраска раствора лакмуса при растворении соли NaCl.
___________________________________________________________________
2. Какие ионы обусловили изменение цвета лакмуса в растворе Al2(SO4)3 В результате какого процесса появились эти ионы? Дайте определение гидролиза.
________________________________________________________________________________
3. Возможен ли полный гидролиз этой соли? Почему сульфат алюминия подвергается ступенчатому гидролизу? Напишите ионно-молекулярное и молекулярное уравнения реакций гидролиза Al2(SO4)3 Подтверждается ли вывод о характере среды экспериментом?
_______________________________________________________________________________
4. Сделайте общий вывод, при гидролизе каких солей образуются основные соли.
_____________________________________________________________________________________________
5. Как избежать гидролиза соли Al2(SO4)3 при приготовлении водного раствора? Ответ поясните на основании принципа смещения равновесия.
_________________________________________________________________________
Гидролиз карбоната натрия
Ход и данные опыта
В пробирку с дистиллированной водой добавили несколько капель лакмуса и небольшое количество карбоната натрия Na2CO3.
Наблюдения:_____________________________________________________
Анализа результатов опыта
1. Объясните, какие ионы обусловили изменение цвета лакмуса. В результате какого процесса появились эти ионы? На что указывает отсутствие выделения диоксида углерода при растворении соли?
____________________________ ________________________________________________
2. Напишите ионно-молекулярное и молекулярное уравнения реакций гидролиза с учетом наблюдений в эксперименте. Поясните, почему карбонат натрия подвергается ступенчатому гидролизу? Подтверждается ли вывод о характере среды экспериментом?
________________________
3. Сделайте общий вывод, при гидролизе каких солей образуются кислые соли.
_________________
4. Как избежать гидролиза этой соли при приготовлении водного раствора? Ответ поясните на основании принципа смещения равновесия.
______________________________________________________________________________
4. Влияние температуры на степень гидролиза солей
Ход и данные опыта
В пробирку с дистиллированной водой добавили небольшое количество  и несколько капель фенолфталеина. Затем ½ полученного раствора нагревали.
и несколько капель фенолфталеина. Затем ½ полученного раствора нагревали.
Наблюдения:_______________________________________________________
Анализа результатов опыта
1. Какая среда должна быть в растворе этой соли? Напишите ионно-молекулярное и молекулярное уравнение реакции гидролиза. Подтверждается ли вывод о характере среды экспериментом?
____________________________________________________________________
2. На основании изменения окраски при нагревании сделайте вывод об изменении концентрации ионов OH– в растворе. В каком направлении сместилось равновесие гидролиза и почему?
_______________________________________________________________________
3. Укажите причину увеличения степени гидролиза соли с повышением температуры.
_________________________________________________________________
Необратимый гидролиз
Ход и данные опыта
В пробирку поместили равные объёмы (1-2мл) растворов солей Al2(SO4)3 и Na2CO3.
Наблюдаем выпадение осадка и выделение пузырьков газа.
Анализ результатов опыта
1. Напишите ионно-молекулярное и молекулярное уравнение реакции гидролиза с учетом наблюдений в эксперименте.
2. Объясните необратимость процесса совместного гидролиза исследуемых солей.
Ответы на контрольные вопросы
1. Вычислите концентрацию цианид-ионов в О,1М растворе синильной кислоты HCN. Как изменится концентрация этих же ионов, если pH раствора HCN будет равен 3?
______________________________________________________________________________________________________
2. Одинаковы ли значения pH растворов КOH и NH4OH одинаковой концентрации, равной 0,01М? Ответ обосновать уравнениями диссоциации и расчетами.
____________________________________________________________________________________________________
3. Запишите в ионно-молекулярной и молекулярной формах уравнения ступенчатого гидролиза солей CuSO4 и Na3PO4. Как избежать гидролиза этих
солей при приготовлении их водных растворов? Ответ пояснить с позиций принципа смещения равновесия гидролиза.
_______________________________________________________ _________________________________________ ____________________________________________________________________________________________________________
4. Рассчитайте pH 0,5М раствора AlCl3, учитывая только первую ступень гидролиза. Запишите уравнения гидролиза в ионно-молекулярной и молекулярной формах.






