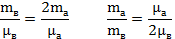Определить давление кислорода в баллоне объемом V = 1 м3 при температуре t=27 °С. Масса кислорода m = 0,2 кг.
Определить давление кислорода в баллоне объемом V = 1 м3 при температуре t=27 °С. Масса кислорода m = 0,2 кг.
| V = 1 м3 μ = 0,032кг/моль m = 0,2 кг t=27 °С | Т=300К | Записываем уравнение Менделеева-Клапейрона и находим из него давление, производимое газом:
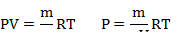 
|
| Р-? |
 Баллон емкостью V= 12 л содержит углекислый газ. Давление газа Р = 1 МПа, температура Т = 300 К. Определить массу газа.
Баллон емкостью V= 12 л содержит углекислый газ. Давление газа Р = 1 МПа, температура Т = 300 К. Определить массу газа.
| V = 12 л μ =0,044кг/моль Т=300К Р =1 МПа | 0,012м3 1∙106Па | Записываем уравнение Менделеева-Клапейрона и находим массу газа
 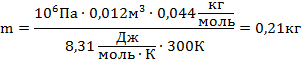
|
| m -? |
 При температуре Т = 309 К и давлении Р = 0,7 МПа плотность газа ρ = 12 кг/м3. Определить молярную массу газа.
При температуре Т = 309 К и давлении Р = 0,7 МПа плотность газа ρ = 12 кг/м3. Определить молярную массу газа.
| V = 12 л Т=309К Р =0,7 МПа ρ = 12 кг/м3 | 0,012м3 0,7∙106Па | Записываем уравнение Менделеева-Клапейрона
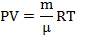 Так как масса газа может быть определена через плотность газа и его объем имеем:
Так как масса газа может быть определена через плотность газа и его объем имеем:

|
| μ -? | ||
Отсюда находим молярную массу газа:

|
 Какова плотность водорода при нормальном атмосферном давлении и температуре 20°С.
Какова плотность водорода при нормальном атмосферном давлении и температуре 20°С.
| V = 12 л t=20°C Р =105 Па μ =0,002кг/моль | 0,012м3 T=293К | Нормальное атмосферное давление – это давление, равное 105 Па. И эту информацию запишем как данные задачи. Записываем уравнение Менделеева-Клапейрона
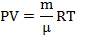
|
| ρ -? | ||
Так как масса газа может быть определена через плотность газа и его объем имеем:
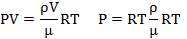 Отсюда находим плотность газа:
Отсюда находим плотность газа:

|
 До какой температуры Т1 надо нагреть кислород, чтобы его плотность стала равна плотности водорода при том же давлении,но при температуре Т2 = 200 К?
До какой температуры Т1 надо нагреть кислород, чтобы его плотность стала равна плотности водорода при том же давлении,но при температуре Т2 = 200 К?
| Т2=200К ρ1 = ρ2 μ1 =0,032кг/моль μ2 =0,002кг/моль | Записываем уравнение Менделеева-Клапейрона для кислорода и для водорода через плотности газов:
 Так как по условию давление у двух газов одинаковое, то можно приравнять правые части данных уравнений:
Так как по условию давление у двух газов одинаковое, то можно приравнять правые части данных уравнений: 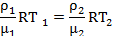 Сократим на R и на плотность ρ (по условию плотности газов равны) и найдем Т1
Сократим на R и на плотность ρ (по условию плотности газов равны) и найдем Т1
|
| Т1 -? | |

|
 В сосуде объемом 4·10-3 м3 находится 0,012 кг газа при температуре 177°С. При какой температуре плотность этого газа будет равна 6·10-6 кг /см3, если давление газа остается неизменным.
В сосуде объемом 4·10-3 м3 находится 0,012 кг газа при температуре 177°С. При какой температуре плотность этого газа будет равна 6·10-6 кг /см3, если давление газа остается неизменным.
| V=4·10-3 м3 m=0,012 кг t1=177°C ρ2=6·10-6 кг /см3 | Т1=450К 6 кг/м3 | 

|
| Т2 -? | 
|
Смесь газов
 В баллоне объемом 25 литров находится 20 г азота и 2 г гелия при 301К. Найдите давление в баллоне.
В баллоне объемом 25 литров находится 20 г азота и 2 г гелия при 301К. Найдите давление в баллоне.
| V = 25 л μ1 = 0,028кг/моль m1 = 20 г μ2 = 0,004кг/моль m2 = 2 г Т=301К | 0,025м3 0,02кг 0,002кг | Записываем уравнение Менделеева для каждого газа и находим из него давление газов
 По закону Дальтона результирующее давление в сосуде равно сумме парциальных давлений газов:
По закону Дальтона результирующее давление в сосуде равно сумме парциальных давлений газов:
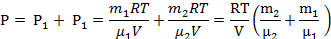
|
| Р-? | 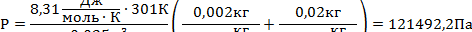
|
 Определить плотность смеси, состоящей из 4 граммов водорода и 32 граммов кислорода при давлении 7°С и давлении 93кПа?
Определить плотность смеси, состоящей из 4 граммов водорода и 32 граммов кислорода при давлении 7°С и давлении 93кПа?
| μ1 = 0,002кг/моль m1 = 4 г μ2 = 0,032кг/моль m2 = 32 г t=7°С Р =93кПа | 0,004кг 0,032кг T=280K 93000Па |  По закону Дальтона:
По закону Дальтона: 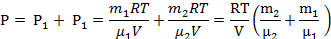

|
| ρ-? | 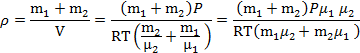
| |

|
 Сосуд емкостью 2V разделен пополам полупроницаемой перегородкой. В одной половине находится водород массой mВ и азот массой mА. В другой половине вакуум. Во время процесса поддерживается постоянная температура Т. Через перегородку может диффундировать только водород. Какое давление установиться в обеих частях сосуда?
Сосуд емкостью 2V разделен пополам полупроницаемой перегородкой. В одной половине находится водород массой mВ и азот массой mА. В другой половине вакуум. Во время процесса поддерживается постоянная температура Т. Через перегородку может диффундировать только водород. Какое давление установиться в обеих частях сосуда?
| μа m1 = m2 = m3 = m μв μк Т |
Диффундирует только водород. | ||||
| РI-? РII-? | |||||
половину меньшей, чем была, и весь азот. А во втором отсеке только половина массы водорода. Тогда для первого отсека установившееся давление равно:
 Для отсека II можно так же определить установившееся давление:
Для отсека II можно так же определить установившееся давление:
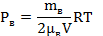
|
 Вакуумированный сосуд разделен перегородками на три равных отсека, каждый объемом V. В средний отсек ввели одинаковые массы кислорода, азота и водорода. В результате чего давление в этом отсеке стало равно Р. Перегородка I проницаема только для молекул водорода, перегородка II проницаема для молекул всех газов. Найти давления Р1 Р2 и Р3, установившиеся в каждом отсеке, если температура газа поддерживается постоянной и равной Т.
Вакуумированный сосуд разделен перегородками на три равных отсека, каждый объемом V. В средний отсек ввели одинаковые массы кислорода, азота и водорода. В результате чего давление в этом отсеке стало равно Р. Перегородка I проницаема только для молекул водорода, перегородка II проницаема для молекул всех газов. Найти давления Р1 Р2 и Р3, установившиеся в каждом отсеке, если температура газа поддерживается постоянной и равной Т.
| μа m1 = m2 = m3 = m μв μк Р |
После диффундирования газов через перегородки в первом отсеке окажется треть массы водорода. Во втором и в третьем отсеках будет треть водорода, половина массы кислорода и половина всей массы азота. Тогда для первого отсека установившееся давление равно: | ||||
| Р1-? Р2-? Р3-? | |||||



| |||||
 Если до диффундирования первоначальное давление во втором отсеке было Р, то можно записать:
Если до диффундирования первоначальное давление во втором отсеке было Р, то можно записать:
 Отсюда можно найти
Отсюда можно найти
 Находим выражение для давления во втором и в третьем отсеках
Находим выражение для давления во втором и в третьем отсеках
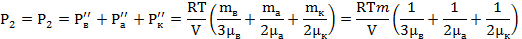
| |||||
 И тогда давление в первом отсеке равно:
И тогда давление в первом отсеке равно:

|
С химическими реакциями
 В сосуде находится смесь азота и водорода. При температуре Т, когда азот полностью диссоциирован на атомы, давление равно Р (диссоциацией водорода можно пренебречь). При температуре 2Т, когда оба газа полностью диссоциированы, давление в сосуде 3Р. Каково отношение масс азота и водорода в смеси?
В сосуде находится смесь азота и водорода. При температуре Т, когда азот полностью диссоциирован на атомы, давление равно Р (диссоциацией водорода можно пренебречь). При температуре 2Т, когда оба газа полностью диссоциированы, давление в сосуде 3Р. Каково отношение масс азота и водорода в смеси?
| μа μв Т1 =Т Т2 =2Т Р1=Р Р2=3Р |
И результирующее давление в сосуде по закону Дальтона равно:
| |

| ||
И результирующее давление в сосуде по закону Дальтона равно:
|
 В герметично закрытом сосуде находится 1 моль неона и 2 моля водорода. При температуре Т1=300К, когда весь водород молекулярный, атмосферное давление в сосуде Р1=105 Па. При температуре Т2=3000К давление возросло до Р2=1,5∙105 Па. Какая часть молекул водорода диссоциировала на атомы?
В герметично закрытом сосуде находится 1 моль неона и 2 моля водорода. При температуре Т1=300К, когда весь водород молекулярный, атмосферное давление в сосуде Р1=105 Па. При температуре Т2=3000К давление возросло до Р2=1,5∙105 Па. Какая часть молекул водорода диссоциировала на атомы?
| ν1=1 моль ν2=2 моль Т1 =300К Т2 =3000К Р1=105 Па Р2=1,5∙105 Па | При температуре Т1 давление газа в сосуде складывается из парциальных давлений двух газов и равно:
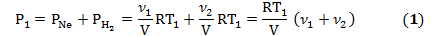 При температуре Т2 давление газа равно:
При температуре Т2 давление газа равно:

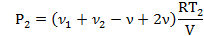
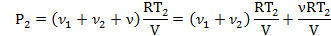
|

| |
Из уравнения (1):
 Из первого находим объем V:
Из первого находим объем V:

| |

 
|
 В закрытом баллоне находится смесь из m1= 0,50 г водорода и m2 = 8,0 г кислорода при давлении Р1= 2,35∙105 Па. Между газами происходит реакция с образованием водяного пара. Какое давление Р установится в баллоне после охлаждения до первоначальной температуры? Конденсации пара не происходит.
В закрытом баллоне находится смесь из m1= 0,50 г водорода и m2 = 8,0 г кислорода при давлении Р1= 2,35∙105 Па. Между газами происходит реакция с образованием водяного пара. Какое давление Р установится в баллоне после охлаждения до первоначальной температуры? Конденсации пара не происходит.
| V = 25 л μ1 = 2г/моль m1 = 0,5 г μ2 = 32г/моль m2 = 8 г | 
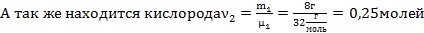 В сосуде будет происходить реакция водорода с кислородом с образованием воды:
В сосуде будет происходить реакция водорода с кислородом с образованием воды:

|
| Р-? | Из уравнения реакции видно, что если в реакцию вступит весь водород, то кислорода только половина |
В результате образуется ν3=0,25 молей водяного пара и останется ν4= 0,125молей кислорода.
По закону Дальтона результирующее давление в сосуде равно сумме парциальных давлений
 Так как известно, что до реакции давление в сосуде было Р1, то для этого момента можно так же применить закон Дальтона:
Так как известно, что до реакции давление в сосуде было Р1, то для этого момента можно так же применить закон Дальтона:
 Решаем полученные уравнение в системе относительно неизвестного:
Решаем полученные уравнение в системе относительно неизвестного:

|





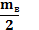
 Следовательно, после завершения установочных процессов, в отсеке I будет водород, массой на
Следовательно, после завершения установочных процессов, в отсеке I будет водород, массой на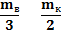


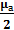 Т Т
Рв Ра
Т Т
Рв Ра
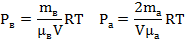
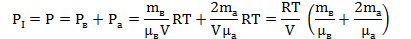
 2Т 2Т
Р'в Р'а
2Т 2Т
Р'в Р'а