В результате активации липопероксидных реакций и гидролаз (главным образом липаз и фосфолипаз) в клетке накапливаются гидроперекиси липидов, свободные жирные кислоты, фосфолипиды (например, глицерофосфолипиды, фосфатидилхолины, фосфатидилэтаноламины, фосфатидилсерины. Эти соединения получили название амфифильных в связи с их способностью проникать и фиксироваться как в гидрофобной, так и в гидрофильной зоне мембран.Накопление в клетке амфифилов в большом количестве сопровождается массированным внедрением их в мембраны, что ведёт к формированию обширных кластеров и микроразрывов в них.
Расстройства процесса репарации мембран
При воздействии повреждающих факторов репаративный ресинтез альтерированных или утраченных липидных, белковых, липопротеидных, гликопротеидных и других молекул мембран, а также их синтез de novo существенно подавляются. Эффективность восстановления мембран становится недостаточной. Это потенцирует степень и масштаб повреждения мембранного аппарата клеток.
Нарушения конформации макромолекул
Изменения нормальной конформации (пространственной структуры, формы) макромолекул белка, ЛП, гликопротеинов и других соединений приводят к значительным изменениям физико‑химического состояния клеточных мембран и их рецепторов. Причинами этого являются расстройства энергообеспечения клеток; отклонения физико‑химических параметров клетки от нормы (например, развитие ацидоза, гипер‑ или гипоосмии). В результате изменяется третичная и четвертичная структуры макромолекул, что нарушает их конформацию и функцию, в том числе – снижает активность БАВ (ферментов, гормонов, цитокинов и др.).
Перерастяжение и разрыв мембран
Перерастяжение и разрыв мембран набухших клеток в связи с их гипергидратацией – важный механизм повреждения и гибели как органоидов, так и клетки в целом. Гипергидратация является следствием значительного увеличения осмотического и онкотического давления в клетках. Это, в свою очередь, обусловлено избытком в них гидрофильных молекул органических соединений (молочной и пировиноградной кислот, альбуминов, глюкозы и др.), а также ионов, накопившихся в связи с расстройствами метаболизма.
Дисбаланс ионов и воды
Дисбаланс ионов и воды в клетке, как правило, развивается вслед за или одновременно с расстройствами энергетического обеспечения и повреждением мембран и ферментов. В результате существенно изменяется трансмембранный перенос многих ионов. В наибольшей мере это относится к K+, Na+, Ca2+, Mg2+, Cl–, т.е. ионам, которые принимают участие в таких жизненно важных процессах, как возбуждение, проведение потенциалов действия (ПД), электромеханическое сопряжение и др.
Ионный дисбаланс характеризуется изменением соотношения отдельных ионов в цитозоле и нарушением трансмембранного соотношения ионов как по обе стороны плазмолеммы, так и внутриклеточных мембран.
Проявления ионного дисбаланса многообразны. Наиболее существенны для функционирования и самого существования клеток изменения ионного состава, определяемые разными мембранными АТФазами и дефектами мембран.
Катионы. Вследствие нарушения работы Na+,K+‑АТФазы плазмолеммы в цитозоле клетки накопливается избыток Na+и уменьшается содержание K+. При расстройстве Na+‑Ca2+–ионообменного механизма плазмолеммы (обмен двух Na+, входящих в клетку, на один Ca2+, выходящий из неё), а также Ca2+‑АТФаз, в цитозоле существенно увеличивается содержание Ca2+ (рис. 5– 8).
Ы ВЁРСТКА вставить файл «ПФ Рис 05 0 8 Направление градиентов и содержание отдельных ионов»

Рис. 5–8. Направление градиентов и содержание отдельных ионов (на примере кардиомиоцитов).
Анионы. Нарушения трансмембранного распределения катионов сопровождаются изменением содержания в клетке и анионов Cl–, OH–, HCO3– и др. (рис. 5– 9).
Ы ВЁРСТКА вставить файл «ПФ Рис 05 9 Дисбаланс ионов и жидкости в клетке при ее повреждении»
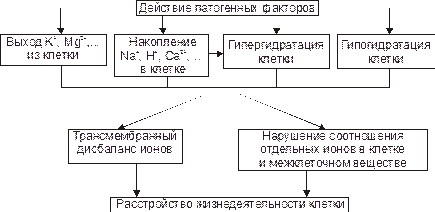
Рис. 5–9. Дисбаланс ионов и воды в клетке при её повреждении.
Важными последствиями ионного дисбаланса являются изменения объёма клеток и клеточных органоидов (гипо– и гипергидратация), а также нарушения электрогенеза в возбудимых клеточных элементах (например, в кардиомиоцитах, нейронах, скелетных мышечных волокнах, гладкомышечных клетках — ГМК).
Гипергидратация клеток. Основная причина гипергидратации — повышение содержания Na+ и Ca2+, а также отганических веществ в повреждённых клетках. Это сопровождается увеличением в них осмотического давления и накоплением воды. Клетки при этом набухают, объём их увеличивается, что сочетается с растяжением и нередко микроразрывами цитолеммы и мембран органелл.
Гипогидратация клеток. Гипогидратация клеток наблюдается, например, при лихорадке, гипертермии, полиурии, инфБ (холере, брюшном тифе, дизентерии). Указанные состояния ведут к потере организмом воды, сопровождающейся выходом из клеток жидкости и растворённых в ней белков (в том числе ферментов), а также других органических и неорганических водорастворимых соединений.
Нарушения электрогенеза в виде изменений характеристик МП и ПД имеют существенное значение, поскольку они нередко являются одним из важных признаков наличия и характера повреждения клеток. Примером могут служить изменения ЭКГ при повреждении клеток миокарда, электроэнцефалограммы при нарушении структуры и функций нейронов головного мозга, электромиограммы при изменениях в мышечных клетках. Патогенез такого рода повреждений возбудимых клеток приведён на рис. 5– 10.
Ы ВЁРСТКА вставить файл «ПФ Рис 05 10 Изменения свойств возбудимой клетки при ее повреждении»

Рис. 5–10. Изменения электрофизиологических свойств возбудимой клетки при её повреждении.
Генетические нарушения
Повреждения генома и/или механизмов экспрессии генов, репликации и репарации ДНК, клеточного цикла – существенные механизмы альтерации, имеющие фатальные последствия. Эти повреждения играют существенную роль при малигнизации клеток и процессах онкогенеза. На рис. 5– 11 приведены основные изменения генетической программы клеток, происходящие под влиянием повреждающих факторов.
Ы ВЁРСТКА вставить файл «ПФ Рис 05 11 Механизмы нарушения генетической программы при повреждении клетки»
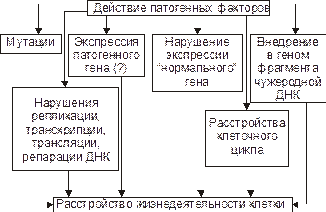
Рис. 5–11. Нарушения генетической программы и/или механизмов её реализации при повреждении клетки.
Причинами повреждения генома клетки и её гибели могут стать прямое или опосредованное действие на генетический аппарат патогенных агентов различного характера. Нарушения структуры ДНК и/или её деградация часто являются пусковым звеном гибели клетки. Наиболее значимыми причинами повреждений ДНК являются: – разрушение фрагментов ДНК при воздействии на неё сверхсильных патогенных агентов, чаще всего химического или физического характера (например, высоких доз ионизирующего излучения, алкилирующих агентов, свободных радикалов, гидроперекисей липидов); – расщепление ДНК при значительной активации нуклеаз (предсуществующих или синтезирующихся de novo); – деградация ДНК активированными трансферазами, что сопровождается разрывами межнуклеотидных связей. Указанные и другие факторы включают различные механизмы нарушения генетической информации, механизмов её реализации или активации программы смерти клетки.
Механизмы нарушений в геноме. К числу наиболее существенных механизмов нарушения генетической информации клетки относятся: – мутации, – неконтролируемая дерепрессия генов (например, онкогенов или генов апоптоза), – подавление активности жизненно важных генов (например, программирующих синтез ферментов), – трансфекция (внедрение в геном чужеродной ДНК, например ДНК вируса герпеса или опухоли); – нарушения репарации ДНК.
Ниже приведены отдельные последствия повреждения генома, имеющие наибольшее значение в патологии человека.
Энзимопатии (нарушения структуры и функции энзимов и ферментативного катализа. Это фатальным образом сказывается на всех сторонах жизнедеятельности клеток (например, многие из тысяч моногенных заболеваний являются следствием дефекта генов, кодирующих структуру ферментов).
Нарушения к леточного цикла (дефекты даже одного из сотен факторов, регулирующих клеточный цикл, неизбежно приводят к расстройству пролиферации клеток, в том числе - к бесконтрольному размножению повреждённой клетки и формированию малигнизированных клонов).
Активация онкогенов (этот процесс является ключевым звеном канцерогенеза).
Неконтролируемая активация апоптоза (приводящая, например, к иммунодефицитным состояниям или гипотрофии тканей и органов).






