а)Орынбасу реакциялары негізіндегі галогендеу.
б)Қосылу реакциялары негізіндегі галогендеу.
в)Хлор туындылардың ыдырау реакциялары негізіндегі галогендеу.
2.Галогендеу реакцияларының термодинамикасы.
3.Галогендеуші агенттер.
4.Радикалдық-тізбектік хлорлау.
1. Галогендеу дегеніміз- органикалық қосылыстарға галоген атомдарын енгізу процестері.Олар: F-,Cl-,Br-,I- -иодтау деп бөлінеді.Органикалық синтездегі галогендеу реакцияларының маңызы ерекше.Бұл реакциялар нәтижесінде Cl органикалық еріткіштер винилхлорид,дихлорэтан (аралық өнім) және хлор,фтор пестицидтері алынады.Органикалық қосылыстардың галоген туындыларын 3 жолмен алуға болады:
1.Орынбасу негізіндегі немесе субститутивті (S) орынбасу.
Орынбасу сутегі атомы үшін жүреді:
RH+Cl2 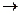 RCl+HCl
RCl+HCl
Немесе бір галоген орнын екіншісі басуы мүмкін
RCl+NaBr 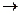 RBr+NaCl.
RBr+NaCl.
2.Қосылу реакциялары негізіндегі галогендеу немесе аддитивті галогендеу.Бұл реакциялар С=С,С 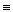 С,С-Ar байланыстары бойынша жүреді:
С,С-Ar байланыстары бойынша жүреді:
а)СH2=CH2 +Сl2 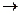 ClCH2-CH2Cl
ClCH2-CH2Cl
б)CH 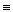 CH + 2Cl2
CH + 2Cl2 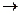 CHCl2-CHCl2
CHCl2-CHCl2
в)C6H6 + 3Cl2 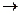 C6H6Cl6
C6H6Cl6
Сонымен қатар гидрогалогендеу реакциялары жүреді.Аддитивті хлорлау
мысалына фозген синтезі жатады:
СО + Сl2 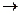 COCl2
COCl2
3.Хлор туындылардың ыдырау реакциялары негізіндегі галогендеу
а)Дегидрохлорлау
СH2Cl-CH2Cl 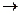 CH2=CHCl +HCl
CH2=CHCl +HCl
б)Дехлорлау
ССl3-CCl3 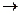 Cl2 + CCl2=CCl2
Cl2 + CCl2=CCl2
в)Хлор әсерінен С-С байланыстарының үзілуі.Бұл реакцияны хлордың әсерінен
жүретін болғандықтан хлоролис немесе хлоринолис деп атайды.
ССl3-CCl3 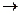 2CCl4
2CCl4
г) Пиролиз реакциялары нәтижесінде жоғары температурада С-С
байланыстардың үзілуі жүреді:
ССl3-ССl2-CCl3 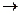 CCl4 + ССl2 = ССl2
CCl4 + ССl2 = ССl2
2. Галогендеу реакцияларының энергетикалық сипаттамалары әр түрлі болып келеді.Галогендеу реакцияларының жылу эффектісі F2 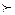 Cl2
Cl2 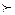 Br2
Br2 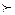 I2 қатарында кемиді.
I2 қатарында кемиді.
RCH3 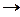 RCH2X -
RCH2X - 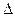 Ho298
Ho298
-HX
x=F 460
x=Cl 105
x=Br 34
x=I -50
Фторлау реакциялары кезінде С-С және С-Н байланыстарының үзілу энергиясынан артық энергия бөлінеді.Сондықтан мұндай көп мөлшердегі энергия органикалық заттардың терең ыдырауын тудыруы мүмкін.Фторлау кезінде ыдырауды болдырмау шаралары қарастырылады.Керісінше,иодтау реакциялары теріс жылу эффектілерімен сипатталады және бұл реакциялар қайтымды болып келеді.Сондықтан I туындылар жанама жолмен алынады.
3. Галогендеуші агент ретінде бос галогендер мен сусыз галогенсутектер маңызды.Галогендер органикалық еріткіштерде ериді.Ерігіштігі фторға қарай кемиді. Br2 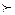 Cl2
Cl2 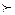 F2 және галогенсутектердің күші HI
F2 және галогенсутектердің күші HI 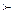 HBr
HBr 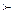 HCl
HCl 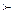 HF қатарында кемиді.Сондықтан галогендеу процестерін сұйық фазада жүргізген қолайлы.Галогендеуші реагенттердің ішінде ең қауіптісі F2 және HF. Олар тері қабаты мен тыныс алу органдарын тітіркендіреді және улы болып табылады. Хлор NaCl ерітіндісінен электролиз әдісімен алынады.
HF қатарында кемиді.Сондықтан галогендеу процестерін сұйық фазада жүргізген қолайлы.Галогендеуші реагенттердің ішінде ең қауіптісі F2 және HF. Олар тері қабаты мен тыныс алу органдарын тітіркендіреді және улы болып табылады. Хлор NaCl ерітіндісінен электролиз әдісімен алынады.
Галогендеу реакцияларын жүргізу механизмі бойынша екіге бөлінеді:
1.Радикалды-тізбектік
2.Ионды катализдік
Бірінші түріне парафин,олефин,ароматты көмірсутектердегі сутек атомдарының орынбасу реакциялары жатады.Бұл реакциялардың механизмі тармақталмаған тізбекті болып келеді.Бұл кезде аралық Cl атомдары мен бос радикалдары түзіліп отырады.Бірінші сатыда Cl жоғарғы температураның әсерінен Cl радикалы мен Cl-дың жұтылған бөлшегіне ыдырап отырады 1Иницирлеу әдісі
а) Cl2 + Қабырға® Cl· + Cl адс.
б) Cl2®2 Cl
Тізбектің пайда болу сатысы хлордың органикалық заттармен әрекеттесуі:
в) Cl2 + органикалық заттар
СH2=CH2 + Cl2® ClCH2-CH2·+ Cl·
Иницирлеу химиялық әсерден де жүреді:
(C6H5COO)2®2C6H5COO·®2C6H5·+2CO2
C6H5·+ Cl2 ®C6H5Cl + Cl·
2.Тізбектің үзілу сатысы.
- Cl·+ RH®R·+ HCl
- R·+ Cl2® RCl+ Cl·
-

 Cl·+ =С=С= ® Cl
Cl·+ =С=С= ® Cl 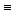 С-С· =
С-С· = - Cl
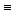 С-С· = + Cl2 ® Cl
С-С· = + Cl2 ® Cl 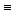 С-С
С-С 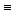 Cl + Cl·
Cl + Cl·
· Cl


 Cl·® - Cl® - Cl + Cl· +
Cl·® - Cl® - Cl + Cl· +  ¼® C6H6Cl6
¼® C6H6Cl6
3.Тізбектің үзілу сатысы.
- Cl·+ Қабырға® Cl адс
2 Cl·® Cl2
3. R·+ Cl·® RCl
Егер реакция ортасында О2 сияқты ингибиторлар болса,реакция жылдамдығы оның концентрациясына кері тәуелділікте болады.
V=k [ Cl2] [ О2]-1
Сондықтан радикалды-тізбектік хлорлау кезінде О2 қоспасы болмайтын таза хлор алу керек және ингибитор әсері 3500 С-дан жоғары болмайды.Реакцияға иондық реакция катализатор қатыспаған жағдайда бүйір тізбектің хлорлануы жүреді:
C6H5-CH3+Cl2®C6H5CH2Cl®C6H5CHCl2
C-H байланысының үзілу энергиясы төмендегідей қатарда өседі:
ArCH2-H << ArCH2-CH2-H < RH << CAr-H
Осы қатарда Еакт де өседі.
Лекция №8.
Ионды –катализдік галогендеу.
Мақсаты: Қанықпаған көмірсутектерде жүретін ионды-катализдік галогендеу
процестерінің механизмін оқып үйрену.
Сұрақтары:1.Бос галогендер көмегімен қосылу реакциялары негізіндегі
галогендеу.
2.Ионды-катализдік галогендеу өнімдері.
3.Гидрогалогендеу реакцияларының жүру ерекшеліктері.
1. Галогендер көмегімен қосылу реакциялары еселі байланыстары бар көмірсутектерде,ароматты қосылыстарда немесе гетероатомды қосылыстарда жүреді.Қосылу реакциялары С=С байланысы негізінде жүрсе,оларды аддитивті галогендеу деп атайды.Олефиндерді хлорлау реакциялары газды фазада радикалды механизммен жүреді.Апротонды еріткіштер болатын сұйық фазада АЕ механизммен жүреді.Бұл кезде аралық p және s комплекстер түзіледі.
H2C=CH2+Cl2®CH2=CH2+(Cl®Cl+FeCl3) ®H2CCl CH2Cl
| ® |
H2C+ CH2Cl
AE реакцияға түсу бейімділігі төмендегі қатарда кемиді.Аралық катионның тұрақтылығына байланысты өзгереді:
RCH=CH2 > CH2=CH2 > CH2=CHCl
AE -ге бәсеке түрде R қосылу жүруі мүмкін.Оны болдырмау үшін ингибитор қосады.Ал,катализатор қатысуымен реакцияның селективтілігін арттыруға болады.Бұл процестердің нәтижесінде 1,2-дихлорэтан, 1,2-дихлорпропан (каучук), 1,2-дибромэтан, 1,1,2-трихлорэтан.
2. Хлоргидриндену реакциясы.
Хлордың олефиндерге сулы ортадағы әсері кезінде хлоргидриндер түзіледі:
RCH=CH2 + Cl2 +H2O ® RCH(OH)-CH2Cl + HCl
Хлоргидриндеу реакциясы кезінде сулы ортадағы хлор молекуласы электрофильді агент қызметін атқарады:
-Сl- +
CH2=CH2 + Cl2® CH2=CH2®ClCH2-CH2 + H2O®ClCH2-CH2OH
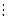 хлоргидрин
хлоргидрин
Cl
¯
Cl
Хлоргидрин және аралық s комплекс пен Сl- ионы арасында жүретін жанама реакциялар нәтижесінде екі жанама өнім алынуы мүмкін:
+Cl2 + +HOCH2-CH2Cl

 ClCH2-CH2Cl ClCH2-CH2 (ClCH2-CH2)2O
ClCH2-CH2Cl ClCH2-CH2 (ClCH2-CH2)2O
дихлорэтан s-комплекс -H+ дихлордиалкил эфирі
Реакцияның селективтілігі Сl- ионы концентрациясына және хлоргидрин концентрациясына тікелей байланысты болады.
3. Қос және үш байланыстың гидрогалогенденуі.
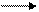 а)RCH=CH2 + HX RCHX-CH3
а)RCH=CH2 + HX RCHX-CH3
Бұл экзотермиялық және қайтымды реакция.Оңға жылжыту үшін 500С төмен
температурада жүргізіледі.
НХ активтілігі: HI 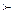 HBr
HBr 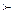 HCl
HCl 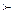 HF
HF
HI катализаторсыз қосылады.Катализатор ролін апротонды = (FeCl3)
катализаторлары атқарады.
+ -
CH2=CH2 + HCl ®CH2=CH2 ® HCl + AlCl3® CH3-CH2 + AlCl4 ®CH3-CH2Cl +
+ AlCl3
Жанама реакция ретінде полимерлену реакциялары жүреді.
+ + +
CH3-CH2 + CH2=CH2 ® CH3-(CH2)2 - CH2 + CH2=CH2® CH3-(CH2)4- CH2






